DC-GPC3聯合CIK細胞的體外抗肝癌作用
韓秋青 ,姜錦 ,王玉亮
肝癌是全球第五大惡性腫瘤,具有很高的發病率和死亡率,全球每年約有62萬患者被新診斷為肝癌[1]。由于中國人群中的慢性乙型肝炎病毒感染率較高,使得我國占到了世界所有新診斷肝癌病例的55%,成為全世界肝癌最高發的地區之一[2]。目前抗腫瘤生物免疫治療模式在國內外備受關注,其對于清除微小的轉移灶和隱匿瘤,預防腫瘤的復發和轉移有較好的效果[3]。既往研究發現通過體外誘導的樹突狀細胞(dendritic cells,DC)與細胞因子誘導的殺傷細胞(cytokine-induced killer cells,CIK)共孵育,可以有效提高CIK細胞的增殖能力及廣譜抗腫瘤能力[4],但缺乏特異識別腫瘤細胞的特性。研究顯示,磷脂酰肌醇蛋白聚糖-3(glypican-3,GPC3)可作為一個新的肝癌診斷、判斷預后的生物標志物,以及肝癌生物免疫治療新的靶點[5]。本研究擬將GPC3基因轉染DC所得到的DC-GPC3與CIK共培養,觀察其生物活性及體外抗肝癌作用。
1 材料與方法
1.1 實驗材料 人肝癌細胞株HepG2和SK-Hep-1,白細胞介素(IL)-2依賴細胞株CTLL-2由衛生部危重病急救醫學重點實驗室于液氮凍存。人DC、DC-GPC3及CIK由衛生部危重病急救醫學重點實驗室于液氮凍存。RPMI 1640培養基(美國GIBCO公司);胎牛血清(以色列Biological Industries公司);重組粒單-集落刺激因子(GM-CSF)、IL-4、腫瘤壞死因子(TNF)-α、IL-2、抗 CD3 單抗、異硫氰酸熒光素/藻紅蛋白(FITC/PE)標記的鼠抗人CD單抗(美國BD公司);IL-2、干擾素γ(IFN-γ)酶聯免疫吸附試驗(ELISA)試劑盒(美國R&D公司);乳酸脫氫酶(LDH)釋放實驗檢測試劑盒(美國Promega公司)。FACS Calibur流式細胞儀(美國BD公司);CO2培養箱(美國Thermo公司);凈化工作臺(北京東聯哈爾儀器制造有限公司);多模式微孔板檢測儀(美國PE公司)。
1.2 流式細胞術檢測人DC、DC-GPC3以及CIK免疫表型 復蘇液氮罐凍存人DC、DC-GPC3及CIK,置于含10%胎牛血清的RPMI 1640培養基中,調整細胞濃度至5×106細胞/mL,按各流式抗體試劑說明書操作,檢測DC、DC-GPC3及 CIK 特異表面標志:DC(CD80、CD83、CD86)、CIK(CD3+CD8+、CD3+CD56+)。
1.3 DC和CIK細胞共培養 以DC-GPC3與CIK細胞按1∶5的比例混合,接種于細胞培養板,置于37℃、5%CO2孵箱中培養48 h,獲得DCIK-GPC3作為實驗組,調整細胞濃度為2×107/mL;以DC與CIK細胞按1∶5的比例混合,接種于細胞培養板,置于37℃、5%CO2孵箱中培養48 h,獲得DCIK作為對照組,調整細胞濃度為2×107/mL。同時設單獨培養的CIK細胞作為空白對照組,動態觀察細胞形態。
1.4 流式細胞術檢測人CIK、DCIK及DCIK-GPC3免疫表型 按各流式抗體試劑說明書操作,檢測CIK、DCIK及DCIK-GPC3特異表面標志CD3+CD8+及CD3+CD56+雙陽性細胞。
1.5 MTT法檢測細胞培養上清液中IL-2生物活性 取對數生長期IL-2依賴細胞株(CTLL-2),用完全培養液調整細胞濃度1×106/mL,加入96孔細胞培養板,每孔加入100μL,每孔分別加入CIK、DCIK及DCIK-GPC3細胞培養上清液50μL或稀釋的IL-2標準品,并設3個平行孔,以1640培養液做陰性對照。細胞培養24 h后,加入20μL MTT(5 g/L),再培養4 h,用DMSO溶解孔中活細胞產生的甲瓚結晶,待結晶完全溶解后將96孔細胞培養板置于多模式微孔板檢測儀,測定570 nm波長處各孔的光密度(OD)值,根據稀釋IL-2標準品OD值繪制標準曲線,以標準品IL-2活性單位作橫坐標,OD值作縱坐標,計算出各組細胞培養上清液IL-2生物活性。
1.6 細胞培養上清液中IL-2、IFN-γ濃度檢測 使用ELISA試劑盒測定CIK、DCIK及DCIK-GPC3細胞培養上清液IL-2、IFN-γ濃度,按照說明書操作。
1.7 細胞毒活性測定 分別以DCIK-GPC3、DCIK及CIK作為效應細胞,以對數生長期GPC3陽性的HepG2作為靶細胞,效應細胞與靶細胞按20∶1、50∶1比例混合接種于96孔細胞培養板,37℃、5%CO2培養箱中孵育24 h后,采用LDH釋放法按操作說明書檢測效應細胞的細胞毒活性。同時以對數生長期GPC3陰性的SK-Hep-1作為對照靶細胞,與DCIK-GPC3、DCIK按1∶20比例混合,采用LDH釋放法檢測細胞毒活性。
1.8 統計學方法 采用SPSS 16.0統計軟件分析數據,計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間多重比較采用SNK-q檢驗;2組間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 DC及DC-GPC3免疫表型 DC表面CD80陽性細胞所占比例為82%,CD83陽性細胞所占比例為78%,CD86陽性細胞所占比例為86%;DC-GPC3表面CD80陽性細胞所占比例為83%,CD83陽性細胞所占比例為80%,CD86陽性細胞所占比例為87%,見圖 1。
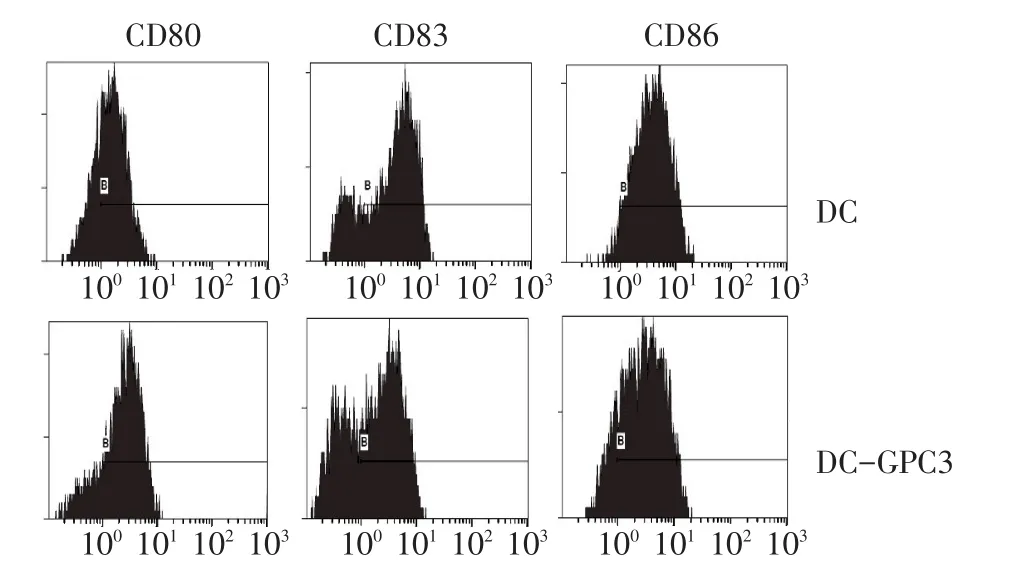
Fig.1 The phenotypic characteristics of DC and DC-GPC3圖1DC及DC-GPC3免疫表型
2.2 各組效應細胞免疫表型 DCIK-GPC3表面CD3+CD8+和CD3+CD56+雙陽性細胞百分比較DCIK及CIK明顯增高,差異有統計學意義(F分別為39.983、65.371,P<0.01),見圖 2。
2.3 各組效應細胞分泌IL-2生物活性及濃度檢測 各組效應細胞分泌IL-2生物活性及濃度水平差異有統計學意義(F分別為31.414、110.780,P<0.01),CIK、DCIK、DCIK-GPC3 培養上清液分泌 IL-2生物活性及濃度依次升高,組間多重比較差異均有統計學意義(P<0.05),見圖 3、4。
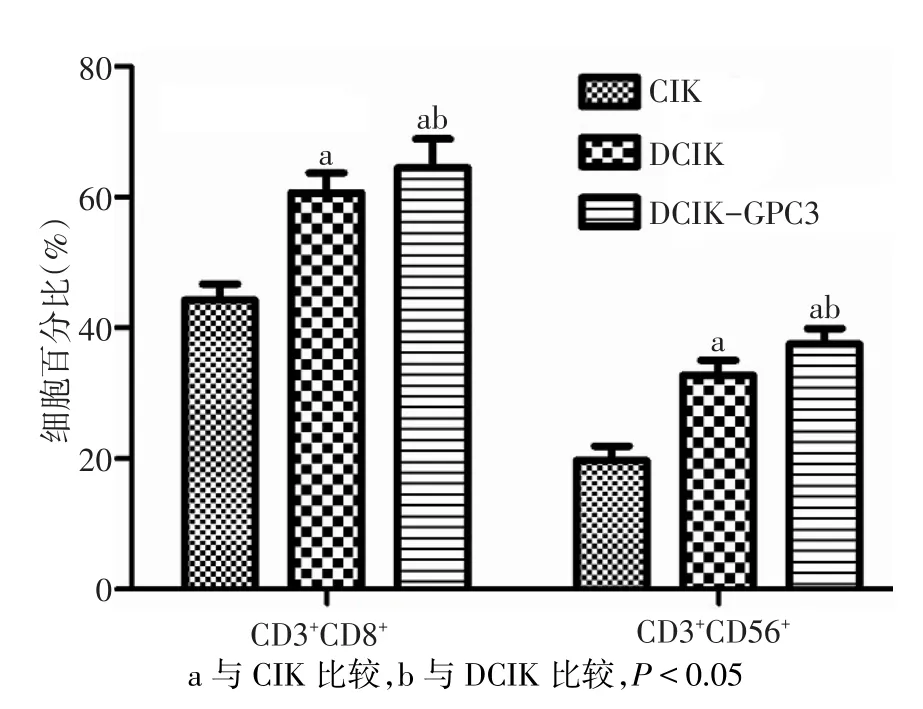
Fig.2 The phenotypic characteristics of effector cells圖2 各組效應細胞免疫表型
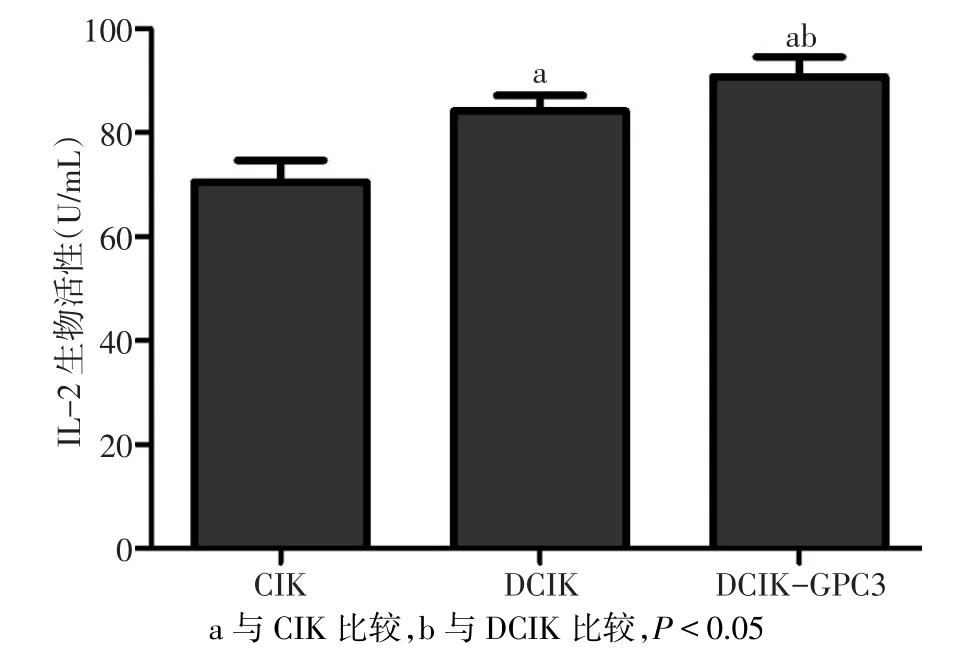
Fig.3 The biological activity of secreted IL-2 of effector cells in supernatants圖3 各組效應細胞培養上清液分泌IL-2生物活性

Fig.4 The concentration of secreted IL-2 of effector cells in supernatants圖4 各組效應細胞培養上清液分泌IL-2濃度
2.4 各組效應細胞分泌IFN-γ濃度比較 各組效應細胞分泌IFN-γ濃度差異有統計學意義(F=30.636,P<0.01)。CIK、DCIK、DCIK-GPC3 培養上清液分泌IFN-γ濃度依次升高,組間多重比較差異均有統計學意義(P<0.05),見圖5。
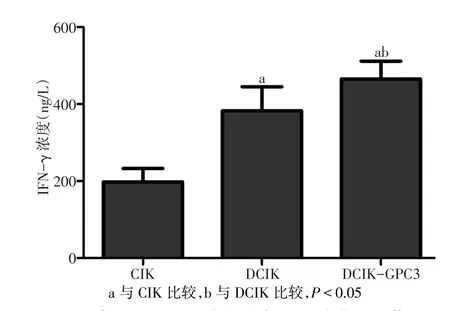
Fig.5 The concentration of secreted IFN-γ of effector cells in supernatants圖5 各組效應細胞培養上清液分泌IFN-γ濃度
2.5 各組效應細胞對肝癌細胞毒活性比較 在20∶1及50∶1效靶比,各組效應細胞對GPC3陽性的HepG2細胞毒活性差異有統計學意義(F分別為28.127、34.088,P<0.01),CIK、DCIK、DCIK-GPC3對HepG2細胞的細胞毒活性依次升高,組間多重比較差異均有統計學意義(P<0.05),見圖6。而在20∶1效靶比,DCIK-GPC3對 GPC3陰性的 SKHep-1細胞的細胞毒活性與DCIK比較差異無統計學意義(34.5%±3.1%vs.35.5%±3.7%,n=4,t=0.414,P>0.05)。
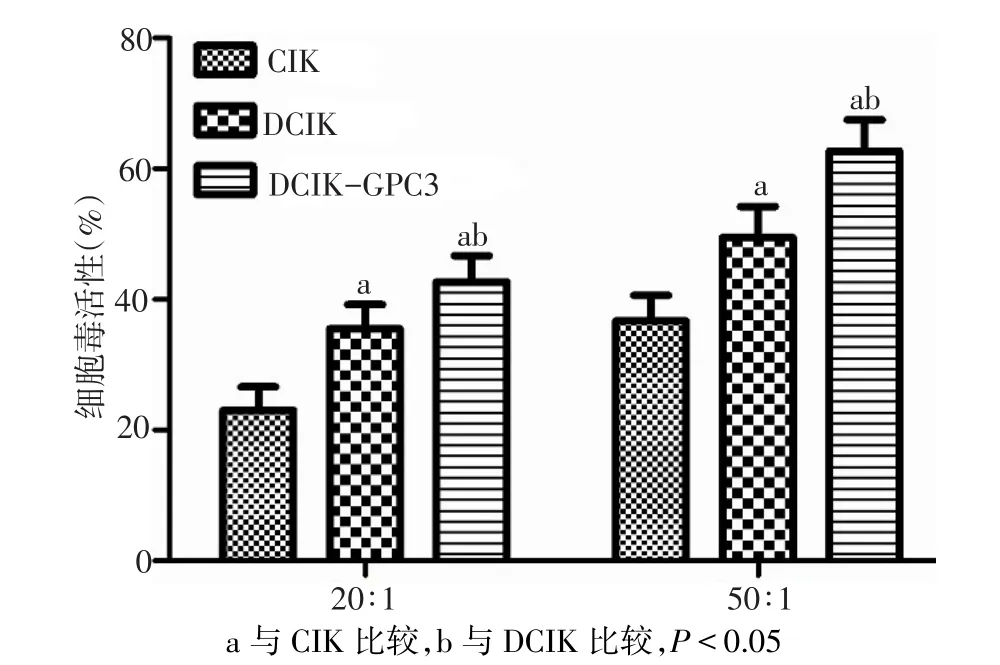
Fig.6 The cytotoxic activity against HepG2 of effector cells圖6 各組效應細胞對HepG2細胞的細胞毒活性
3 討論
3.1 GPC3作為肝癌治療靶點 近年國內外研究已證實,GPC3可成為一個新的肝癌診斷、判斷預后的生物標志物,以及肝癌生物免疫治療新的靶點[5]。如Bi等[6]將人源化抗GPC3抗體的單鏈可變片段與抗CD3抗體融合來制備靶向GPC3和CD3雙特異性T細胞誘導劑,結果顯示,其在體內外高效、特異性殺傷GPC3陽性表達的人類肝癌細胞。Sawada等[7]進行了 GPC3 肽疫苗作為肝細胞肝癌(HCC)患者的輔助治療的Ⅱ期臨床試驗,結果顯示,手術加疫苗接種的HCC患者術后復發率低于單純接受手術的患者。GPC3肽疫苗可降低GPC3陽性腫瘤患者的1年復發率。因此,以GPC3為分子靶點的治療是HCC治療的有希望的候選方法。
3.2 DCIK-GPC3免疫表型 DCIK是DC與CIK共培養獲得的一群異質效應細胞,成熟DC抑制了CD4+CD25+Treg細胞,后者可以明顯抑制CIK中的CD3+CD8+和CD3+CD56+效應細胞發揮活性。加入DC可以有效消除這種免疫抑制效應,DCIK細胞的增殖以及殺傷活性明顯增強。因此,將CIK和DC聯合治療惡性腫瘤,將有助于解除部分腫瘤患者T細胞的免疫無能,從而發揮協同抗腫瘤作用[8-9]。CIK表型以CD3+CD8+和CD3+CD56+雙陽性細胞為主,本實驗結果顯示,DCIK-GPC3免疫表型CD3+CD8+和CD3+CD56+雙陽性細胞百分比較DCIK及CIK細胞明顯增高,這表明DC-GPC3和CIK細胞之間存在很重要的免疫調節關系,CIK細胞可以識別成熟的DC-GPC3,DC-GPC3又可以促進CIK效應細胞數量增多,這可以保證了DCIK-GPC3細胞具有更強的細胞毒活性。
3.3 DCIK-GPC3體外抗肝癌作用 本課題組前期研究證實,DCIK-GPC3效應細胞可明顯抑制肝癌移植瘤生長[10],在此基礎上,本實驗研究結果顯示,隨著效應細胞與靶細胞比例增加,各組對GPC3陽性的HepG2細胞的細胞毒性顯著增加;在相同效靶比條件下,DCIK-GPC3、DCIK對HepG2細胞的細胞毒活性較CIK顯著提高,其中以DCIK-GPC3的細胞毒活性最為顯著。進一步在相同效靶比條件下,DCIK-GPC3對GPC3陰性的SK-Hep-1細胞的細胞毒活性與DCIK相比并無顯著增高。這提示靶向GPC3的DCIK-GPC3對肝癌細胞的殺傷效應依賴GPC3分子的表達,具有較高的特異性,對高表達GPC3抗原肝癌細胞有更強的殺傷能力,從而彌補了DCIK非特異性殺傷的不足。本研究結果顯示,與DCIK及CIK相比,DCIK-GPC3培養上清液中IL-2生物活性、濃度以及上清液中IFN-γ濃度水平均顯著升高,提示DCIK-GPC3高效釋放的生物活性物質IL-2及IFN-γ可正反饋促進DCIK-GPC3的高度活化,從而顯著增強CIK效應細胞對肝癌細胞的特異性直接殺傷作用。
總之,CIK與DC-GPC3共培養可獲得更強的特異性殺傷肝癌細胞活性,本研究為DCIK-GPC3治療肝癌的臨床轉化提供了理論和實驗依據。
[1]Zhu RX,Seto WK,Lai CL,et al.Epidemiology of hepatocellular carcinoma in the Asia-Pacific region[J].Gut Liver,2016,10(3):332-339.doi:10.5009/gnl15257.
[2]Wang FS,Fan JG,Zhang Z,et al.The global burden of liver disease:the major impact of China[J].Hepatology,2014,60(6):2099-2108.doi:10.1002/hep.27406.
[3]Mittica G,Capellero S,Genta S,et al.Adoptive immunotherapy against ovarian cancer[J].J Ovarian Res,2016,9(1):30.doi:10.1186/s13048-016-0236-9.
[4]Mesiano G,Todorovic M,Gammaitoni L,et al.Cytokine-induced killer(CIK)cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors[J].Expert Opin Biol Ther,2012,12(6):673-684.doi:10.1517/14712598.2012.675323.
[5]Zhou F,Shang W,Yu X,et al.Glypican-3:A promising biomarker for hepatocellular carcinoma diagnosis and treatment[J].Med Res Rev,2017 Jun 16.doi:10.1002/med.21455.
[6]Bi Y,Jiang H,Wang P,et al.Treatment of hepatocellular carcinoma with a GPC3-targeted bispecific T cell engager[J].Oncotarget,2017,8(32):52866-52876.doi:10.18632/oncotarget.17905.
[7]Sawada Y,Yoshikawa T,Ofuji K,et al.Phase II study of the GPC3-derived peptide vaccine as an adjuvant therapy for hepatocellular carcinoma patients[J].Oncoimmunology,2016,5(5):e1129483.doi:10.1080/2162402X.2015.1129483.
[8]Mu Y,Zhou CH,Chen SF,et al.Effectiveness and safety of chemotherapy combined with cytokine-induced killer cell/dendritic cell-cytokine-induced killer cell therapy for treatment of gastric cancer in China:A systematic review and meta-analysis[J].Cytotherapy,2016,18(9):1162-1177.doi:10.1016/j.jcyt.2016.05.015.
[9]Zhang Y,Zhang X,Zhang A,et al.Clinical applications of dendritic cells-cytokine-induced killer cells mediated immunotherapy for pancreatic cancer:an up-to-date meta-analysis[J].Onco Targets Ther,2017,10:4173-4192.doi:10.2147/OTT.S143382.
[10]靳燕宇,王玉亮,宋揚,等.DC-GPC3聯合CIK細胞體內抗肝癌作用[J].天津醫藥,2017,45(10):1021-1024.Jin YY,Wang YL,Song Y,et al.Antitumor effect of DC-GPC3 cocultured with CIK on hepatocellular carcinoma in vivo[J].Tianjin Med J,2017,45(10):1021-1024.doi:10.11958/20170626.

