不同濃度西紅花苷對RANKL誘導的小鼠破骨細胞分化的影響
林思思,章禮煒,孫旺,施更生△
牙周炎主要是由局部因素引起的牙周支持組織的慢性炎癥,是最常見的口腔疾病之一,在世界范圍內有較高的患病率[1-3]。牙周炎是造成牙齒過早脫落的首要原因,其中以牙齦炎癥、牙周袋形成、附著喪失、牙槽骨吸收為主要臨床癥狀[4-5],但目前牙周炎的研究主要以抑制牙菌斑、減少炎癥為主,而針對抑制骨吸收的研究較少。西紅花苷又稱西紅花素,是從我國中藥藏紅花中提取出來的,是西紅花的一種水溶性類胡蘿卜素類化合物西紅花酸與不同糖結合而成的一系列酯苷[6]。隨著近年來國內外對西紅花苷研究的逐漸深入,發現西紅花苷能夠減少骨關節炎動物模型的骨退化[7]。然而,西紅花苷對破骨細胞的直接影響還未被研究清楚,因此本文研究不同濃度的西紅花苷對核因子κB受體激動劑配體(receptor activator of nuclear factor kappa B ligand,RANKL)誘導的破骨細胞生成的影響。
1 材料與方法
1.1 細胞與試劑 RAW264.7小鼠巨噬細胞購自恩澤醫療集團公共科研平臺,西紅花苷、抗酒石酸酸性磷酸酶(TRAP)染色試劑盒購于Sigma公司,西紅花苷采用去離子水稀釋至儲存濃度(40 mmol/L),青-鏈霉素溶液(100×)、CCK-8試劑盒購于碧云天生物科技有限公司,RANKL購于R&D systems,α-MEM培養基、胎牛血清、DMEM均購于Gibco公司,Revert Aid First Strand cDNA Synthesis Kit購自美國Fermentas公司,FS SYBR Green Master購自上海Roche公司。
1.2 方法
1.2.1 細胞培養 將小鼠巨噬細胞RAW264.7在含10%胎牛血清、1%青-鏈霉素的α-MEM培養基中常規培養,當細胞融合度至70%~80%時,胰酶消化后按1∶2進行傳代。
1.2.2 CCK-8法檢測不同濃度的西紅花苷對細胞生長活力的影響 取對數生長期的RAW264.7細胞接種于96孔板,分別取 0、6.25、12.5、25、50、100、200、400 μmol/L 的西紅花苷加入細胞培養基中,每個濃度設3個復孔,37℃分別孵育48、96 h后,棄上清,按每孔加入5μL CCK-8試劑和95μL DMEM培養基,37℃培養箱孵育2 h后,用Tecan酶標儀檢測各組細胞450 nm處的吸光度。
1.2.3 TRAP染色成熟的破骨細胞 RAW264.7細胞以4×103個/孔接種于48孔板,37℃培養箱過夜,加入100 ng/L RANKL 和 0、12.5、50、100μmol/L 的西紅花苷進行誘導,每2 d換液1次,第6天用TRAP染色,細胞用4%多聚甲醛固定20 min,在含有萘酚AS-BI磷酸鹽的孵育液中37℃孵育1 h,用去離子水反復沖洗3次,蘇木精復染3 min,PBS沖洗3次,100倍顯微鏡下觀察細胞染色情況并對破骨細胞進行計數,TRAP陽性細胞染色呈紫色,有3個細胞核以上的巨噬細胞即為成熟破骨細胞。
1.2.4 實時熒光定量PCR RAW264.7細胞以1×105個/孔接種于 6 孔板,加入 100 ng/L RANKL 和 0、12.5、50、100μmol/L的西紅花苷進行誘導,直至0μmol/L組觀察到破骨細胞形成。收集細胞,TRIzol法提取細胞總RNA,按逆轉錄試劑盒說明書逆轉錄為cDNA后進行real-time PCR反應。20μL反應體系包含cDNA模板1μL,上、下游引物各0.25μL,ddH2O 8.5μL,SYBR Green 10μL。反應條件:50℃預變性 2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min,40個循環。每個樣品均設3個復孔,在實時熒光定量儀ABI 7500上進行,以GADPH為內參,采用2-ΔΔCt法分析破骨細胞特異性基因降鈣素受體(CTR)、活化 T 細胞核因子 1(NFATC1)、C-fos、TRAP的mRNA表達水平,相應的引物委托生工生物工程(上海)股份有限公司合成,引物序列見表1。

Tab.1 Primers for qRT-PCR表1qRT-PCR引物序列表
1.3 統計學方法 采用SPSS 19.0軟件進行數據分析,符合正態分布的計量資料以均數±標準差(±s)表示,多組間均數比較采用單因素方差分析,組間多重比較采用SNK-q檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 西紅花苷對細胞活性的影響 CCK-8檢測結果顯示,在 0~100μmol/L范圍內,西紅花苷對RAW264.7細胞的生長無明顯影響。當西紅花苷濃度≥100μmol/L時,細胞增殖活力下降,顯示出明顯的抑制增殖作用,見圖1。后續實驗選取0~100μmol/L西紅花苷進行實驗。
2.2 西紅花苷對RANKL誘導的RAW264.7形成破骨細胞的影響 TRAP染色可觀察到西紅花苷的濃度越高,TRAP染色陽性細胞越少,抑制RAW264.7細胞形成破骨細胞的作用越明顯,見圖2。
2.3 熒光實時定量PCR結果 隨著西紅花苷濃度的升高,破骨細胞中 CTR、NFATC1、C-fos、TRAP 的mRNA表達水平逐漸降低,見圖3。
3 討論
牙周病指發生在牙齦、牙周膜等牙齒支持組織的慢性炎癥性疾病[8],由于其周期較長,牙周組織的反復炎癥可以造成附著喪失和牙槽骨的吸收[9],當牙齦中的慢性炎癥向深部牙周組織擴展到牙槽骨附近時,骨表面和骨髓腔內分化出破骨細胞和單核-巨噬細胞,發生陷窩狀骨吸收,或使骨小梁變細,骨髓腔增大,破骨細胞和單核細胞是與骨吸收相關的兩種細胞部分。牙槽骨吸收是牙周炎的一個主要病理變化,由于牙槽骨的吸收,使牙齒的支持組織喪失,牙齒早期脫落,并且可以造成缺牙區牙槽骨寬度不夠、上頜竇底較低、下牙槽神經管較近等問題,不利于后期缺牙區種植修復。牙周炎的發病機制目前尚未明確,但是目前研究已知牙菌斑微生物是引起牙周炎的重要因素[10]。牙菌斑微生物可以引起牙齦炎癥,而宿主免疫炎癥反應在對抗細菌感染時產生的基質金屬蛋白酶、致炎因子、前列腺素等炎癥介質是導致牙周組織破壞的主要因素[11-13]。而目前治療牙周炎的藥物大多都是針對抑制炎癥介質,較少研究抑制骨吸收的藥物。因此,本文選用研究藥物抑制骨吸收具有一定的創新性。
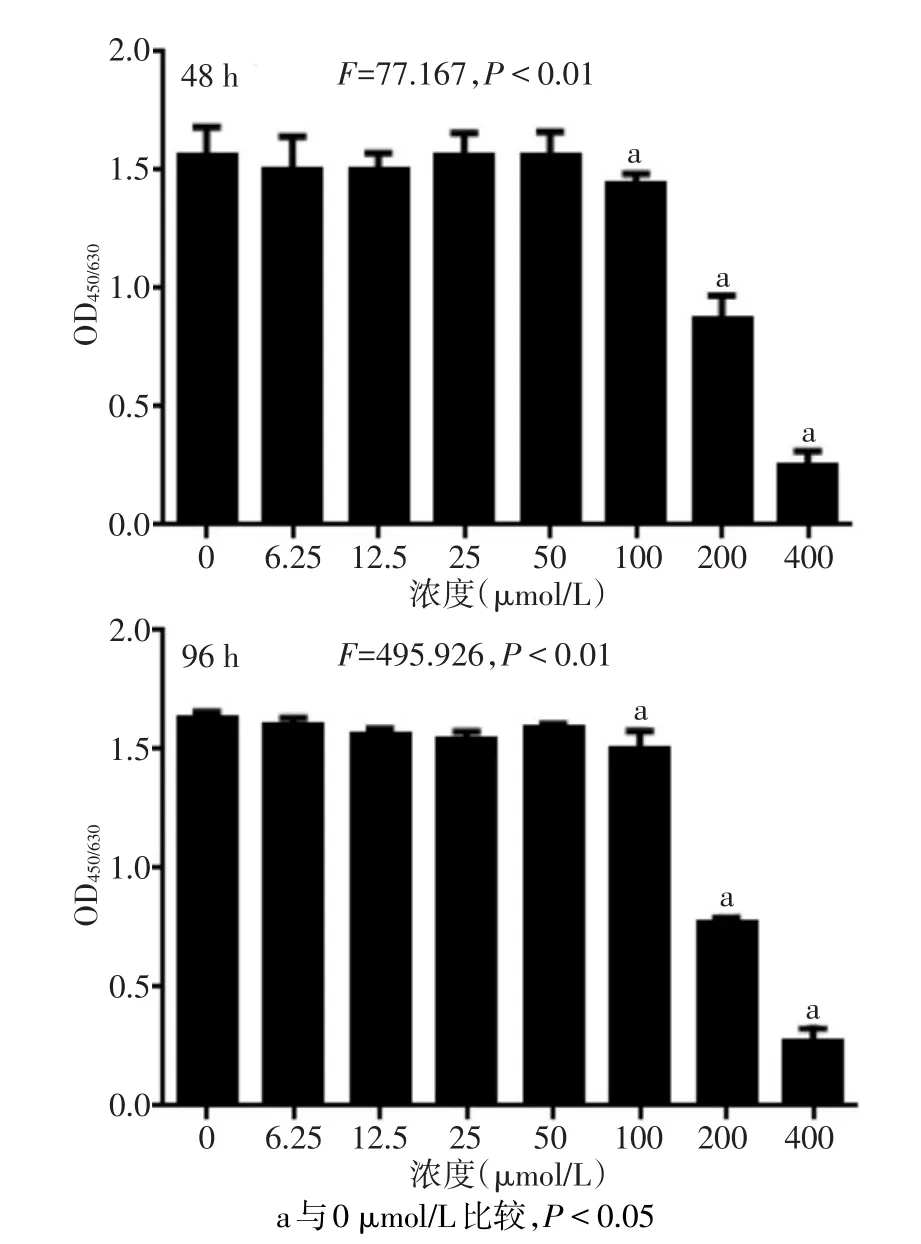
Fig.1 The effects of 0-400μmol/L of crocin on the viability of RAW264.7 cells圖1 0~400μmol/L西紅花苷對RAW264.7細胞生長活力的影響
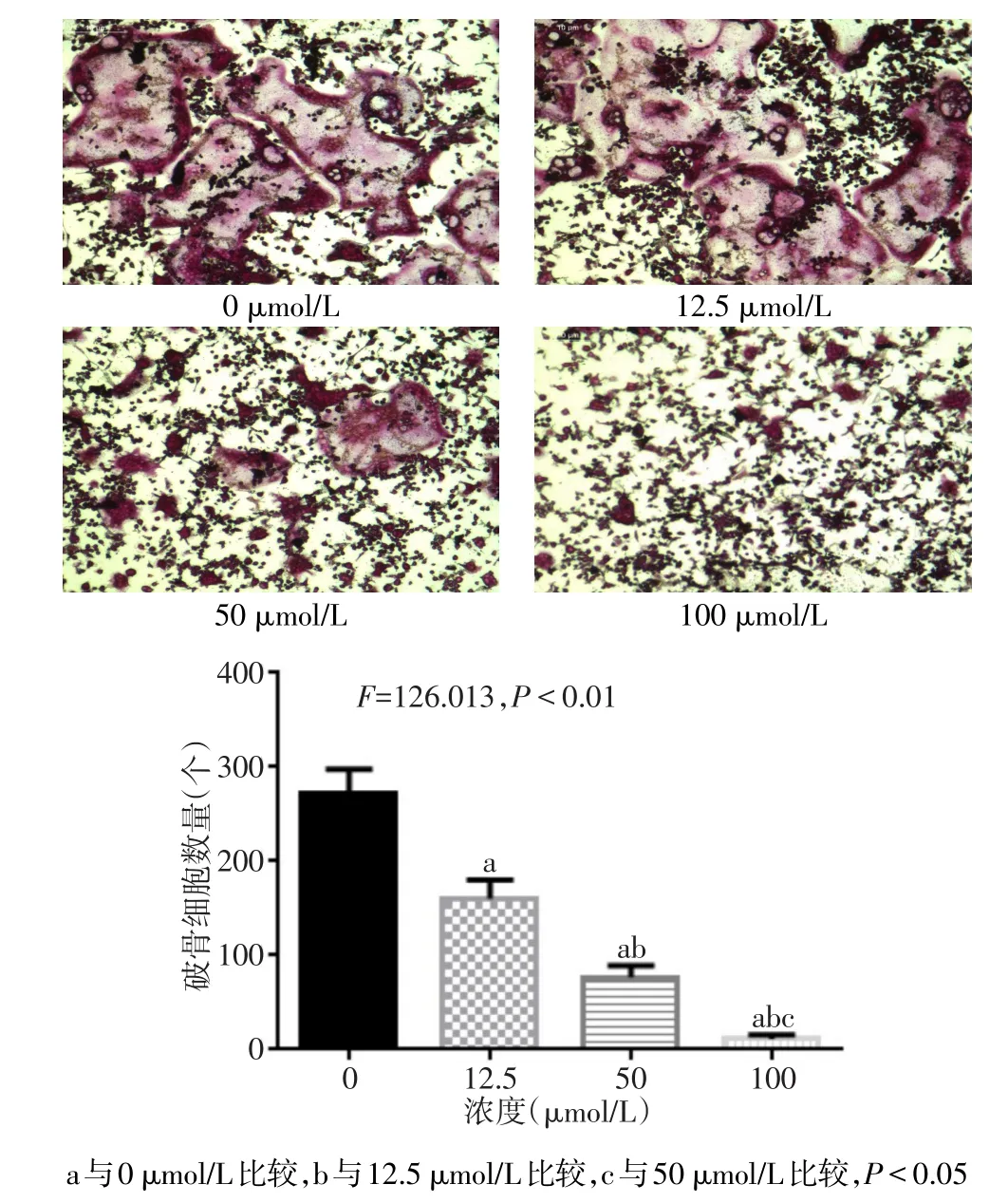
Fig.2 The effects of different concentrations of crocin on receptor activator of RANKL-induced osteoclastogenesis圖2 不同濃度西紅花苷對RANKL誘導形成破骨細胞的影響
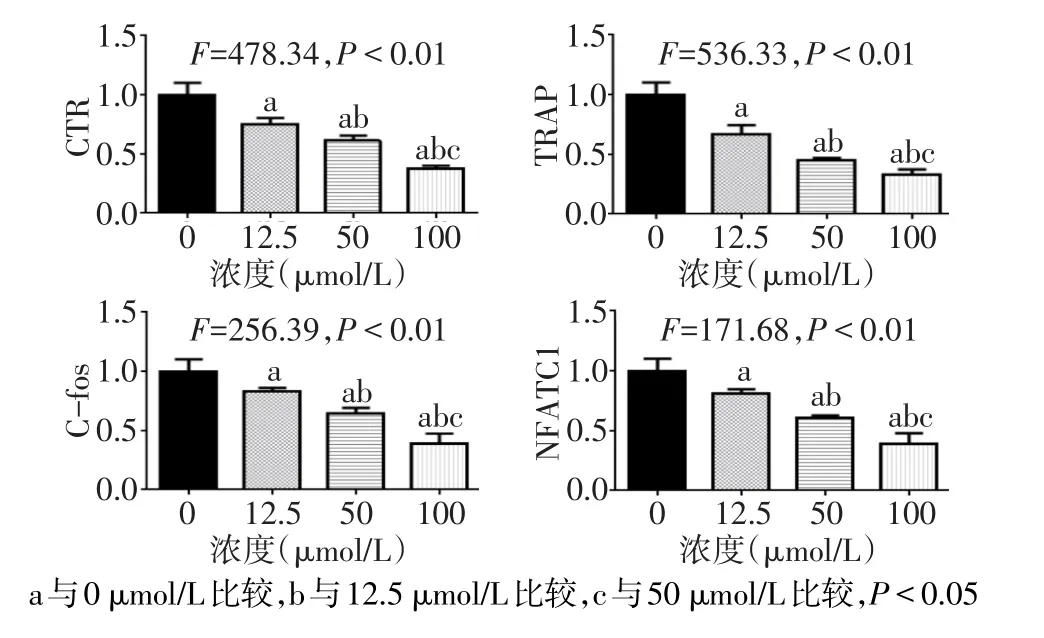
Fig.3 The effects of different concentrations of crocin on expression levels of TRAP,CTR,NFATC1 and C-fos mRNA圖3 不同濃度西紅花苷對破骨細胞TRAP、CTR、NFATC1、C-fos mRNA表達的影響
西紅花又稱藏紅花,是一種鳶尾科番紅花屬的多生花卉,其藥用部位為西紅花的干燥柱頭,是我國傳統中藥材。西紅花苷是西紅花中提取物之一,主要存在于西紅花中的非四萜類色素,包括西紅花苷-1、西紅花苷-2、西紅花苷-3、西紅花苷-4和西紅花酸,均是胡蘿卜烯類化合物在植物體內的氧化產物[14]。近幾年研究表明,西紅花苷具有明顯的抗腫瘤、保護心血管的功效[15-16]。Hire 等[15]發現西紅花苷可以通過抑制細胞的有絲分裂從而抑制乳腺癌細胞的增殖。Ghorbanzadeh等[16]研究發現,西紅花苷可以通過提高miR-126和miR-210的表達、激活蛋白激酶B(Akt)和細胞外調節蛋白激酶(ERK1/2)信號通路而促進大鼠心臟血管生成,預防心血管疾病的發生。隨著對西紅花苷研究的逐漸深入,Hemshekhar等[7]發現西紅花苷可以通過調節基質金屬蛋白酶(MMP)-3、MMP-13、MMP-9、透明質酸酶和非酶類如腫瘤壞死因子(TNF)-α、白細胞介素(IL)-1b、NF-κB等水平和改善抗氧化能力而緩解小鼠軟骨和骨退化。國內Cao等[17]發現西紅花苷可通過抑制無機礦物質的流失,而減少骨質疏松的發生,同時西紅花苷濃度越高,抑制破骨細胞形成的效果越明顯。因此本研究將不同濃度(0~400μmol/L)的西紅花苷加入RAW264.7細胞中,用CCK-8實驗篩選出適宜的西紅花苷實驗濃度,然后在一定濃度內(0~100μmol/L)證實了西紅花苷的濃度越高,RAW264.7細胞誘導分化成破骨細胞的數量越少,同時破骨細胞的特異性基因CTR、NFATC1、C-fos、TRAP mRNA表達量越少,提示在一定濃度范圍內,西紅花苷濃度越高,抑制破骨細胞形成的效果越明顯。本研究為西紅花苷用于牙周炎的研究提供了實驗依據,今后應進一步觀察西紅花苷對成骨細胞的影響及機制。
[1]Hong JW,Noh JH,Kim DJ.The Prevalence and associated factors of periodontitis according to fasting plasma glucose in the korean adults:The 2012-2013 Korea National Health and Nutrition Examination Survey[J].Medicine(Baltimore),2016,95(14):e3226.doi:10.1097/MD.0000000000003226.
[2]Eke PI,Dye BA,Wei L,et al.Update on prevalence of periodontitis in adults in the United States:NHANES 2009 to 2012[J].J Periodontol,2015,86(5):611-622.doi:10.1902/jop.2015.140520.
[3]Zhang Q,Li ZX,Wang CX,et al.Prevalence and predictors for periodontitis among adults in China,2010[J].Global Health Action,2014,7:24503.doi:10.3402/gha.v7.24503.
[4]Hajishengallis G.Periodontitis:from microbial immune subversion to systemic inflammation[J].Nat Rev Immunol,2015,15(1):30-44.doi:10.1038/nri3785.
[5]Mariotti A,Hefti AF.Defining periodontal health[J].BMC Oral Health,2015,15(Suppl 1):S6.doi:10.1186/1472-6831-15-S1-S6.
[6]Alavizadeh SH,Hosseinzadeh H.Bioactivity assessment and toxicity of crocin:a comprehensive review[J].Food Chem Toxicol,2014,64:65-80.doi:10.1016/j.fct.2013.11.016.
[7]Hemshekhar M,Sebastin SM,Sunitha K,et al.A dietary colorant crocin mitigates arthritis and associated secondary complications by modulating cartilage deteriorating enzymes,inflammatory mediators and antioxidant status[J].Biochimie,2012,94(12):2723-2733.doi:10.1016/j.biochi.2012.08.013.
[8]Highfied J.Diagnosis and classification of periodontal disease[J].Aust Dent J,2009,54(Suppl 1):S11-26.doi:10.1111/j.1834-7819.2009.01140.x.
[9]Lindberg TY,B?ge T.Inflammatory mediators in the pathogenesis of periodontitis[J].Expert Rev Mol Med,2013,15:e7.doi:10.1017/erm.2013.8.
[10]Albandar JM.Global risk factors and risk indicators for periodontal diseases[J].Periodontology,2000,29:177-206.doi:10.1034/j.1600-0757.2002.290109.x.
[11]Silosi I,Cojocaru M,Foia L,et al.Significance of circulating and crevicular matrix metalloproteinase-9 in rheumatoid arthritischronic periodontitis association[J].J Immunol Res,2015,2015:218060.doi:10.1155/2015/218060.
[12]Bostr?m EA,Kindstedt E,Sulniute R,et al.Increased eotaxin and MCP-1 levels in serum from individuals with periodontitis and in human gingival fibroblasts exposed to pro-inflammatory cytokines[J].PLoS One,2015,10(8):e0134608.doi:10.1371/journal.pone.0134608.
[13]Trindade F,Oppenheim FG,Helmerhorst EJ,et al.Uncovering the molecular networks in periodontitis[J].Proteomics Clin Appl,2014,8(9/10):748-761.doi:10.1002/prca.201400028.
[14]Inoue E,Shimizu Y,Masui R,et al.Effects of saffron and its constituents,crocin-1,crocin-2,and crocetin on α -synuclein fibrils[J].J Nat Med,2018,72(1):274-279.doi:10.1007/s11418-017-1150-1.
[15]Hire RR,Srivastava S,Davis MB,et al.Antiproliferative activity of crocin involves targeting of microtubules in breast cancer cells[J].Sci Rep,2017,7:44984.doi:10.1038/srep44984.
[16]Ghorbanzadeh V,MohammadiM,Dariushnejad H,etal.Cardioprotective effect of crocin combined with voluntary exercise in rat:role of Mir-126 and Mir-210 in heart angiogenesis[J].Arq Bras Cardiol,2017,109(1):54-62.doi:10.5935/abc.20170087.
[17]Cao PC,Xiao WX,Yan YB,et al.Preventive effect of crocin on osteoporosis in an ovariectomized rat model[J].Evid Based Complement Alternat Med,2014,2014:815181.doi:10.1155/2014/825181.

