Nrf2-自噬通路在大鼠切口痛-瑞芬太尼誘導痛覺過敏中的作用
顧喜燕,王志宏,于泳浩
誘導術后痛覺過敏可增加阿片藥物用量并導致術后持續疼痛,該問題一直是瑞芬太尼臨床應用的一大困擾[1],但具體機制并不完全明確。自噬通常作為一種保護性細胞代謝途徑也參與神經痛的發生發展[2],而且自噬與體內氧化應激反應關系密切[3]。核因子 E2相關因子 2(nuclear factor E2 related factor 2,Nrf2)在應激狀態下可磷酸化入核,啟動抗氧化反應元件(antioxidant response element,ARE),增加其下游抗氧化蛋白基因及相關酶的表達,是公認的抗氧化應激的重要樞紐分子[4-5]。目前在瑞芬太尼誘導的痛覺過敏中,上述因子的表達變化鮮有研究報道。本研究旨在初步探討Nrf2在切口痛-瑞芬太尼痛敏大鼠模型中的表達變化及其與自噬、痛敏行為學的關系,為瑞芬太尼的術后痛覺過敏機制研究提供新的思路。
1 材料與方法
1.1 動物及試劑 雄性清潔級SD大鼠24只,2~2.5月齡,體質量250~300 g,購自中國人民解放軍軍事醫學科學院實驗動物中心。主要試劑:鹽酸瑞芬太尼(瑞捷,1 mg)購自宜昌人福藥業有限責任公司,用前以生理鹽水稀釋至10 mg/L;Nrf2激動劑叔丁基對苯二酚(tBHQ)購自美國MCE公司;抗Beclin-1單克隆抗體、抗LC3Ⅱ單克隆抗體、抗Nrf2單克隆抗體、抗HO-1單克隆抗體均購自Abcam公司;抗β-actin單克隆抗體購自北京華安麥科生物技術有限公司。YLS-6B智能熱板儀購自淮北正華生物儀器設備有限公司。
1.2 方法
1.2.1 動物分組及處理 24只大鼠隨機數字表法分為3組:生理鹽水+切口痛組(I組)、切口痛-瑞芬太尼痛敏組(RI組)、Nrf2激動劑組(t-BHQ組),每組8只。I組和RI組建模前分別經尾靜脈輸注生理鹽水0.1 mL/(kg·min)和瑞芬太尼1μg/(kg·min),連續輸注60 min。輸注同時于雙側后足建立Brennan切口痛模型。t-BHQ組于輸注瑞芬太尼前0.5 h開始給予腹腔注射Nrf2激動劑t-BHQ 15 mg/kg,12 h 1次,連續4次,余處理同RI組。
1.2.2 切口痛模型建立 大鼠置于50 cm×30 cm×20 cm密閉木箱中吸入七氟醚至不能站立后,腹腔注射10%水合氯醛(3 mL/kg)麻醉大鼠。于鼠尾中下1/3處穿刺留置24號靜脈留置針,醫用膠帶固定并以少許生理鹽水封管。按原定方案靜脈輸注生理鹽水或瑞芬太尼。輸注同時大鼠雙側后足底消毒后于其后緣正中0.5 cm處向前縱行切開皮膚及筋膜(約1 cm),以眼科鑷挑起跖肌,縱行充分剝離,過程中要注意保持肌肉起止附著點完整。按壓止血后縫合切口,對合皮膚使其不得重疊、內翻或裂開。碘伏消毒切口后涂少量紅霉素軟膏預防感染。
1.2.3 行為學測定 靜脈輸注前24 h(T0),輸注結束后2 h(T1)、6 h(T2)、24 h(T3)和 48 h(T4)測定動物行為學變化,包括機械縮足反應閾值(PWT)和熱縮足潛伏期(PWL)。測定環境:室溫(18~22℃)、安靜,測定前實驗鼠先適應環境30 min。采用BSEVF3電子Von Frey纖維絲測定PWT,將大鼠置于有小網孔,底部懸空放置的金屬籠內,以Von Frey纖維絲對準右后足第2、3趾間距離切口邊緣約1 cm處垂直施壓,大鼠出現快速縮足、舔足或嘶叫時停止加壓并記錄該壓力值。測定間隔為5 min,共測定5次,去除最大值和最小值,取平均值記錄為PWT值,最大壓力設定為60 g,增至此壓力無反應者剔除。YLS-6B智能熱板儀測定大鼠右后足PWL,熱板設為恒溫50℃,記錄大鼠右后足開始接觸熱板至出現回縮、踮腳、掙扎、嘶叫、舐足任一反應的時間,連續測5次,間隔5 min,去除最大值和最小值,取平均值記為PWL值。PWL上限定為30 s,超過30 s無反應者剔除。
1.2.4 脊髓組織Nrf2-自噬通路相關蛋白測定 行為學測試完畢后處死實驗大鼠,取L4~6脊髓組織,保存于-80℃。Western blot法檢測脊髓 LC3Ⅱ、Beclin-1、Nrf2和HO-1蛋白表達。冰浴下加入組織蛋白裂解液,研磨脊髓樣本成組織勻漿并提取總蛋白。BCA法測定蛋白濃度。取15μg蛋白樣品,沸水(100℃)煮10 min后迅速冷卻,10%SDS-PAGE電泳后,將目的蛋白轉至PVDF膜上(恒壓100 V,60 min),5%脫脂奶粉封閉 1 h,加入一抗 LC3Ⅱ、Beclin-1、Nrf2、HO-1 和內參 β-actin(抗體稀釋度均為 1∶1 000),4 ℃孵育過夜,次日經30 min復溫后加入堿性磷酸酶標記的山羊抗兔二抗(1∶5 000),常溫孵育1 h,暗室內加入顯色劑,曝光掃描。用Quantity One測定條帶灰度值,以目的蛋白條帶灰度值與βactin條帶灰度值的比值反映目的蛋白的表達量變化。
1.3 統計學方法 采用SPSS 17.0軟件進行統計分析,符合正態分布的計量資料以均數±標準差(x±s)表示,組間比較采用重復測量資料的方差分析,組間多重比較采用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 痛敏行為學變化 隨著處理時間的延長,3組PWT、PWL呈總體下降的趨勢(均P<0.01)。組間比較結果顯示,T1時點開始,與I組相比,RI組PWT下降、PWL縮短(P<0.05);此時,tBHQ組較RI組PWT升高、PWL延長(P<0.05),見表1、2。
2.2 Nrf2-自噬通路相關蛋白表達變化 與I組比較,RI組 LC3Ⅱ、Beclin-1 表達升高,Nrf2、HO-1 蛋白表達下降(P<0.05)。而相比 RI組,t-BHQ組Nrf2、HO-1、LC3Ⅱ、Beclin-1 蛋白表達均明顯升高(P<0.05),見圖 1、表 3。
Tab.1 Comparison of PWT at different time points between three groups表1 3組大鼠不同時間點PWT比較 (n=8,g,±s)
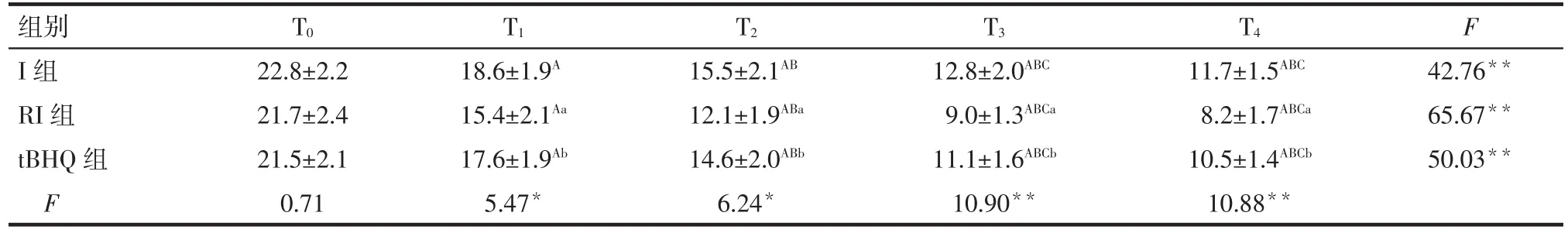
Tab.1 Comparison of PWT at different time points between three groups表1 3組大鼠不同時間點PWT比較 (n=8,g,±s)
*P<0.05,**P<0.01;F 組間=6.25,F 時間=644.21,F 交互=4.10,均 P<0.05;組內不同時間比較:A與 T0比較,B與 T1比較,C與 T2比較,P<0.05;組間比較:a與I組比較,b與RI組比較,P<0.05
?
Tab.2 Comparison of PWL at different time points between three groups表2 3組大鼠不同時點PWL的比較 (n=8,s,±s)
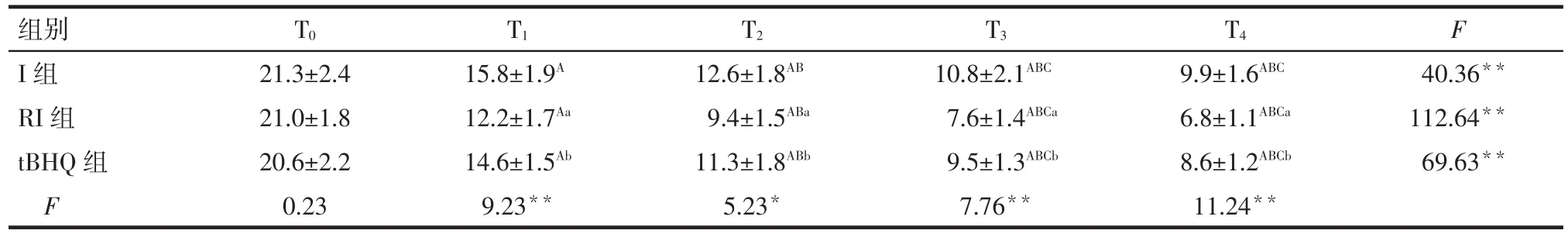
Tab.2 Comparison of PWL at different time points between three groups表2 3組大鼠不同時點PWL的比較 (n=8,s,±s)
*P<0.05,**P<0.01;F 組間=5.05,F 時間=3 862.44,F 交互=25.66,均 P < 0.05;組內不同時間比較:A與 T0比較,B與 T1比較,C與 T2比較,P<0.05;組間比較:a與I組比較,b與RI組比較,P<0.05
?
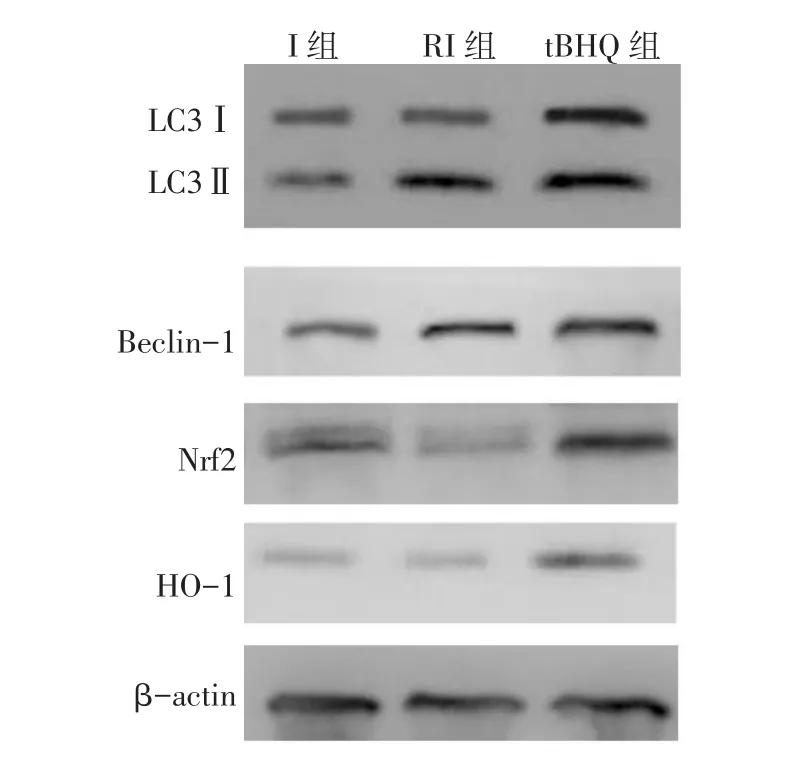
Fig.1 Western blot results of proteins in the Nrf2–autophagy pathways in spinal cord tissues between three groups圖1 3組大鼠脊髓組織Nrf2-自噬通路相關蛋白Western blot結果
Tab.3 Comparison of spinal LC3Ⅱ,Beclin-1,Nrf2 and HO-1 at T4between three groups表3 3組大鼠脊髓LC3Ⅱ、Beclin-1、Nrf2和HO-1 T4時表達的比較 (n=8,±s)
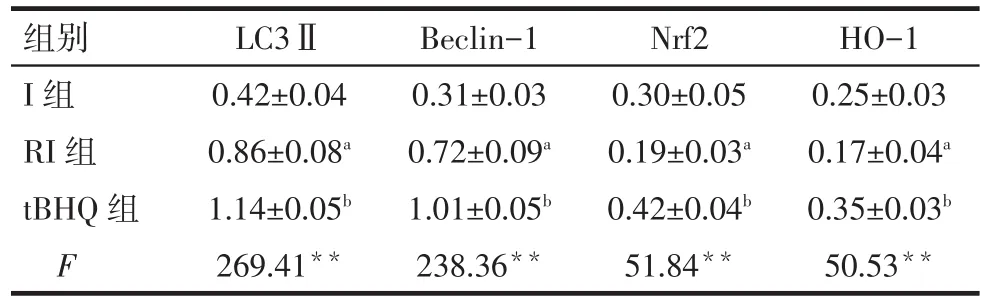
Tab.3 Comparison of spinal LC3Ⅱ,Beclin-1,Nrf2 and HO-1 at T4between three groups表3 3組大鼠脊髓LC3Ⅱ、Beclin-1、Nrf2和HO-1 T4時表達的比較 (n=8,±s)
**P<0.01;a與 I組比較,b與 RI組比較,P<0.05,tBHQ 組與 I組不進行比較
組別I組RI組tBHQ組F LC3Ⅱ0.42±0.04 0.86±0.08a 1.14±0.05b 269.41**Beclin-1 0.31±0.03 0.72±0.09a 1.01±0.05b 238.36**Nrf2 0.30±0.05 0.19±0.03a 0.42±0.04b 51.84**HO-1 0.25±0.03 0.17±0.04a 0.35±0.03b 50.53**
3 討論
阿片類藥物誘導痛覺過敏是應用阿片類藥物鎮痛過程中出現疼痛感矛盾性增加的一種現象,但目前機制并不完全清楚[6]。目前,瑞芬太尼作為短效阿片類藥物廣泛應用于臨床麻醉。而誘發術后切口痛敏是瑞芬太尼臨床應用的一個主要問題。
在阿片類制劑誘導痛敏的機制研究中,常測量用藥前后或干預因素處理前后對傷害性刺激的回避反射(甩尾、縮足等)的變化來評估其對實驗動物痛閾的影響。由于刺激強度急劇變化的傷害性刺激(如熱輻射甩尾實驗)可以掩蓋基線傷害感受閾值的變化,而縮爪試驗的緩慢上升刺激曲線(PWT、PWL)克服了這一影響,甚至可以測得基線感受閾值的細微變化,所以被臨床前研究廣泛應用[7]。自噬通過選擇性或非選擇性分解再利用多余的或結構異常的大分子或細胞結構來改善細胞功能、提高細胞生存率,是一種重要的物質代謝方式及保護機制。自噬與多種機體應激反應下的適應反應和修復過程有著復雜的關系網[8],自噬功能異常影響著機體內包括炎癥反應[9]、疼痛過程[2]在內的多種生理病理過程,調節自噬水平適度活躍對細胞代謝顯得尤為重要。Beclin-1、LC3Ⅱ是自噬體形成的起始階段和膜延伸階段的重要蛋白,也是檢測自噬水平最常用的自噬相關蛋白[10-11]。Nrf2不僅被認為是抗氧化應激的中樞調節者,同時是多種自噬凋亡基因的轉錄因子[4]并參與自噬的調節[12]。故筆者選定了Nrf2及其下游效應分子HO-1作為研究觀察蛋白。
參照本課題組的前期研究成果[13],本研究成功建立了經典切口痛-瑞芬太尼痛敏大鼠模型。與I組相比,從輸注結束后2 h(T1)開始,RI組PWT下降、PWL時間明顯縮短,痛敏現象明顯加重。在T4時RI組大鼠脊髓腰膨大組織內自噬相關蛋白(LC3Ⅱ、Beclin-1)表達明顯增加、Nrf2及其下游蛋白HO-1表達下調,提示瑞芬太尼致切口痛痛敏現象可能與自噬及Nrf2信號通路活性改變有關。雖然此前尚無阿片制劑所致痛敏與脊髓內自噬基礎活性及相關自噬通路關系的報道,但已有文獻證實,不同神經痛痛敏模型中[脊神經結扎模型(SNL)、慢性壓迫性坐骨神經損傷模型(CCI)和坐骨神經保留分支損傷模型(SNI)]脊髓自噬相關蛋白調節各有不同,而蛛網膜下腔注射氯喹抑制脊髓自噬后實驗大鼠PWT明顯降低[2],提示脊髓自噬與脊髓水平疼痛機制相關。相比于RI組,給予t-BHQ后大鼠PWT升高、PWL 延長,LC3Ⅱ、Beclin-1、Nrf2 總蛋白和 HO-1蛋白表達明顯增加,提示t-BHQ可以改善瑞芬太尼痛敏大鼠模型的痛敏行為學并增加脊髓自噬活性,而Nrf2-HO-1信號通路可能通過調節模型中大鼠脊髓自噬水平參與痛敏的調節。結果提示維持脊髓水平適度自噬活性有利于對痛敏的控制,與文獻[2]抑制自噬惡化機械性痛敏的結果一致。
綜上所述,切口痛-瑞芬太尼痛敏大鼠模型中脊髓自噬活性及Nrf2蛋白表達較對照組均有所改變,而Nrf2-HO-1信號通路可能通過調節脊髓自噬參與調節了大鼠切口痛-瑞芬太尼誘導的痛敏反應。
[1]AngstMS.Intraoperative use ofremifentanilfor TIVA:postoperative pain, acute tolerance, and opioid-induced hyperalgesia[J].J Cardiothorac Vasc Anesth,2015,29(Suppl 1):S16-22.doi:10.1053/j.jvca.2015.01.026.
[2]Berliocchi L,Maiarù M,Varano GP,et al.Spinal autophagy is differently modulated in distinct mouse models of neuropathic pain[J].Mol Pain,2015,11:3.doi:10.1186/1744-8069-11-3.
[3]Filomeni G,De Zio D,Cecconi F.Oxidative stress and autophagy:the clash between damage and metabolic needs[J].Cell Death Differ,2015,22(3):377-388.doi:10.1038/cdd.2014.150.
[4]Yamazaki H,Tanji K,Wakabayashi K,et al.Role of the Keap1/Nrf2 pathway in neurodegenerative diseases[J].Pathol Int,2015,65(5):210-219.doi:10.1111/pin.12261.
[5]Pajares M,Jiménez-Moreno N,García-Yagüe áJ,etal.Transcription factor NFE2L2 /NRF2 is a regulator of macroautophagy genes[J].Autophagy,2016,12(10):1902-1916.doi:10.1080/15548627.2016.1208889.
[6]Mao J.Opioid-induced abnormal pain sensitivity:implications in clinical opioid therapy[J].Pain,2002,100(3):213-217.
[7]Roeckel LA,Le Coz GM,Gavériaux-Ruff C,et al.Opioid-induced hyperalgesia: cellular and molecular mechanisms [J].Neuroscience,2016,338:160-182.doi:10.1016/j.neuroscience.2016.06.029.
[8]Kroemer G,Mari?o G,Levine B.Autophagy and the integrated stress response[J].Mol Cell,2010,40(2):280-293.doi:10.1016/j.molcel.2010.09.023.
[9]Shi CS,Shenderov K,Huang NN,et al.Activation of autophagy by inflammatory signals limits IL-1β production by targeting ubiquitinated inflammasomes for destruction[J].Nat Immunol,2012,13(3):255-263.doi:10.1038/ni.2215.
[10]Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2016,12(1):1-222.doi:10.1080/15548627.2015.1100356.
[11]Galluzzi L,Aaronson SA,Abrams J,et al.Guidelines for the use and interpretation of assays for monitoring cell death in higher eukaryotes[J].Cell Death Differ,2009,16(8):1093-1107.doi:10.1038/cdd.2009.44.
[12]Wang Y,Zhang J,Huang ZH,et al.Isodeoxyelephantopin induces protective autophagy in lung cancer cells via Nrf2-p62-keap1 feedback loop[J].Cell Death Dis,2017,8(6):e2876.doi:10.1038/cddis.2017.265.
[13]李依澤,王超,湯曉紅,等.切口痛-瑞芬太尼痛覺過敏大鼠脊髓背角含GluR1和GluR2亞基AMPA受體表達的變化[J].中華麻醉學雜志,2013,33(7):856-859.Li YZ,Wang C,Tang XH,et al.Changes in expression of GluR1-containing AMPA receptor and GluR2-containing AMPA receptor in spinal dorsal horn in a rat model of incisional pain-remifentanil-induced hyperalgesia[J].Chinese Journal of Anesthesiology,2013,33(7):856-859.doi:10.3760/cma.j.issn.0254-1416.2013.07.020.

