輕度尼古丁依賴對人體大腦灰質結構影響的MRI評價
董安珂, 張勇, 程敬亮, 李顏良, 朱晨迪, 許珂
吸煙造成了嚴重的健康、經濟以及社會問題,并且也是目前世界上最主要的可預防性死因[1]。在我國吸煙人群已高達3.16億[2],每年有100多萬人死于與吸煙相關的疾病,而且預計到2025年這類人群將增加1倍,到2050年將增加2倍[3]。雖然多數吸煙者有戒煙欲望,但是大多數戒煙者一般在一周內復吸[4]。尼古丁是吸煙成癮的重要原因,長期攝入尼古丁會導致多巴胺能受體等敏感性下降及數量上調,迫使吸煙者攝入更多的尼古丁來維持和提高腦內的多巴胺(dopamine,DA)水平,以維持或獲得欣快感,否則就會出現抑郁、煩躁不安等戒斷癥狀。近年來研究發現所有被濫用的藥物(如可卡因、尼古丁等)均可對神經細胞的形態和結構造成損害,進而影響其功能[5]。因此研究吸煙對腦結構的影響,進而指導戒煙治療具有重要的臨床意義。基于體素的形態學分析法(voxel-based morphometry,VBM)磁共振成像技術能定量計算腦灰質和白質的體積[6],通過對全腦灰質和白質的密度或體積進行基于體素的對比分析,可了解腦神經元的損傷情況,有助于進一步闡明吸煙對大腦的作用機制,為臨床治療提供相關依據。
材料與方法
1.研究對象
本研究于2014年8月-2016年8月通過網絡廣告、宣傳單等手段共招募輕度尼古丁依賴者(FTND<6分)77例,所有吸煙者均采用尼古丁依賴水平測試(Fagerstrom Nicotine Dependence Test,FTND)來評估其尼古丁依賴性[7],并采用量表法記錄被試者的吸煙指數(吸煙年限×每天吸煙支數/20)及飲酒程度等相關資料[8]。
吸煙者入組標準要求均符合均符合第5版精神疾病診斷與統計手冊(The Diagnostic and Statistical Manual of Mental Disorders-V,DSM-V)關于物質依賴的診斷標準[9],即每日吸煙≥10根、煙齡≥2年。排除標準:①伴有精神病性癥狀或有精神障礙家族史者;②既往有癲癇病史或者有癲癇病家族史者;③有酒精、藥物等尼古丁以外的依賴或行為(賭博、網絡游戲)成癮史;④正在接受任何藥物治療者或2周內有服用苯二氮卓類藥物者或接受過抗精神病藥物治療者;⑤有顱腦損傷史、昏迷史、腦器質性或嚴重軀體疾病者、顱內有金屬物植入或人工種植牙者;⑥不能耐受磁共振檢查者。
另外招募年齡、性別、教育程度和飲酒情等與吸煙組相匹配的37例不吸煙者作為對照組,對照組納入標準要求一生中吸煙不超過10根,排除標準與吸煙組相一致。
此次研究中的所有受試者均為男性,年齡20~55歲,右利手,MR結構像掃描前確認無腦內病灶或結構異常[10]。所有受試者自愿參加本實驗,依從性好。
本實驗通過本院醫學倫理委員會批準,所有受試者在實驗前簽署知情同意書。
2.磁共振檢查方法
使用Siemens Magnetom Skyra 3.0T磁共振掃描儀和16通道頭顱相控陣線圈。受試者取仰臥位,雙側外耳內塞入棉球減小噪音干擾,用軟海綿充分固定頭部,囑其閉上眼睛、保持清醒狀態、身體靜止不動、盡量不思考任何事情。先進行頭部常規MRI掃描,包括T1WI、T2WI、T2-FLAIR序列、DWI(b=0、1000 s/mm2)和2D小角度激發梯度回波(2D-FL)序列。然后采用3D磁化梯度回波序列(magnetization prepared rapid gradient echo,MPRAGE)行矢狀面高分辨率T1WI,掃描參數:TR 2000 ms,TE 2.06 ms,視野256 mm×256 mm,矩陣256×256,層厚1.0 mm,層間隔0 mm,層數192,TI=900 ms,翻轉角9°,體素大小1.0 mm×1.0 mm×1.0 mm。
本研究采用基于Matlab平臺的SPM8軟件先對3D MPRAGE序列T1WI(本研究中稱為結構像)數據進行后處理,從而進行基于體素的形態學分析(VBM)分析。主要包括以下幾個步驟:①轉換數據的格式。把原始圖像的醫學數字成像和通信(digital imaging and communications in medicine,DICOM)格式轉變成為神經影像信息技術處理方案(neuroimaging informatics tchnology initiative,NIFTI)格式。②分割結構。采用SPM8軟件自有的標準腦結構圖像模版,分割出結構像的腦白質、灰質及腦脊液[11]。③配準和空間的標準化。為了減少受試者因大腦不同而帶來的個體差異性,本研究利用DARTEL軟件工具對數據進行配準和標準化處理。首先把灰質密度圖仿射到標準空間的灰質模版,對灰質密度圖行非線性高階配準從而得到其空間標準化版本,采用雅克比橫列式將其轉換成灰質體積圖,然后重新采樣,最后得出相對的灰質體積圖。④空間平滑。運用半高全寬(full width at half maximum,FWHM)三維高斯核(8 mm×8 mm×8 mm)對所得圖像進行空間平滑處理,從而減少配準偏差、提高圖像的信噪比,也使圖像更符合高斯分布。
3.統計學分析
3D結構像數據經過VBM處理后得到全腦基于每個體素分析的灰質體積。采用SPM8軟件的一般線性模型,將受試者的年齡和教育年限作為協變量,使用獨立樣本t檢驗(檢驗水準α=0.05)比較輕度尼古丁依賴組與對照組間灰質體積的差異。分析結果采用Cluster-level FWE(family wise error)進行校正,每個體素的閾值設為P<0.05(雙側),FWE校正后簇體素>318 voxels,當P<0.05時,認為差異具有統計學意義。使用XJ-view軟件(http://www.alivelearn.net/xjview8/)顯示并制作腦區的模板(mask),選擇疊加背景模板,顯示不同組間的差異腦區。
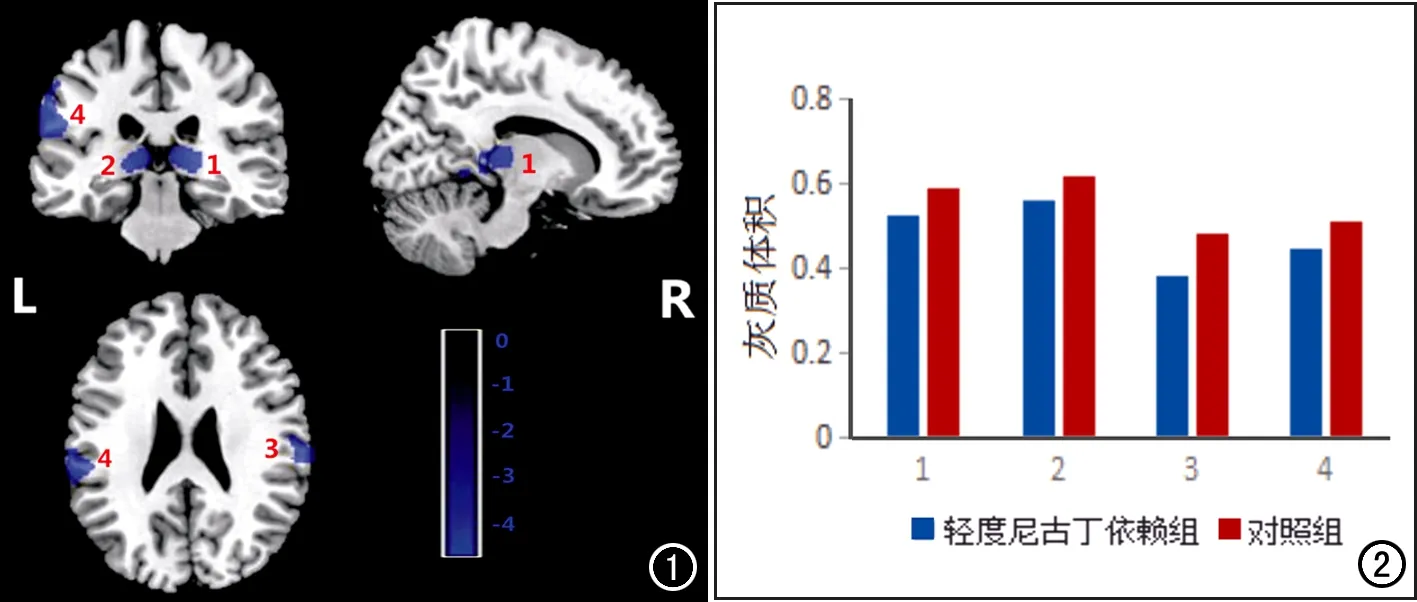
圖1 MRI VBM腦偽彩圖。與對照組比較,輕度尼古丁依賴組雙側丘腦(標號1為右側、2為左側)、雙側緣上回(標號3為右側、4為左側)的灰質體積減小(藍色區域,藍色標尺代表t值大小,顏色越亮代表灰質體積減小的程度越大),未發現灰質體積增大區域。 圖2 直方圖顯示輕度尼古丁依賴組的雙側丘腦(標號1為右側、2為左側)、雙側緣上回(標號3為右側、4為左側)的灰質體積明顯小于較對照組。
影像學結果與吸煙資料的相關性分析采用SPSS 17.0軟件。將輕度尼古丁依賴組與對照組間灰質體積差異有統計學意義的區域分別與吸煙者的吸煙年限、日吸煙量以及吸煙指數進行Spearman相關性分析,P<0.05為差異具有統計學意義。
結 果
1.受試者的基本臨床數據
兩組受試者的年齡差異無統計學意義(P>0.05);而受教育年限的差異有統計學意義(P<0.05),對照組的受教育年限稍高于輕度尼古丁依賴組(表1)。患者組吸煙情況相關指標:初始吸煙年齡10~30歲,平均(19.7±3.5)歲;吸煙年限2~40年,平均(16.1±8.1)年;日吸煙量10~35支,平均(15.9±6.4)支;FTND評分2.5±1.5;吸煙指數0.3~39.0,平均13.0±8.8。
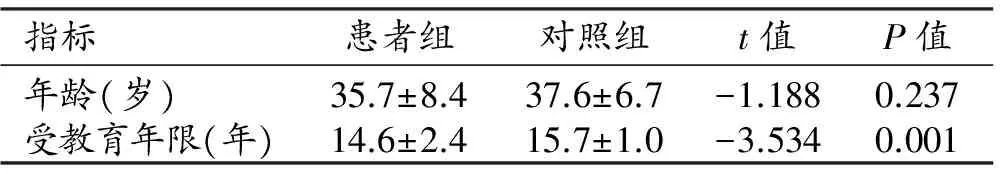
表1 輕度尼古丁依賴組與對照組基本信息表
2.影像學分析結果(VBM分析結果、灰質體積差異區與吸煙資料的相關性分析)
輕度尼古丁依賴組與對照組比較灰質體積減小的腦區主要為雙側丘腦和雙側緣上回,詳見表2;未發現灰質體積增大區域(圖1、2)。

表2 吸煙組與對照組比較體積減小的腦區
Spearman相關分析顯示(表3):雙側丘腦、右側緣上回的灰質體積與吸煙指數及吸煙年限均呈負相關,右側丘腦灰質體積還與日吸煙量呈負相關(P<0.05)。
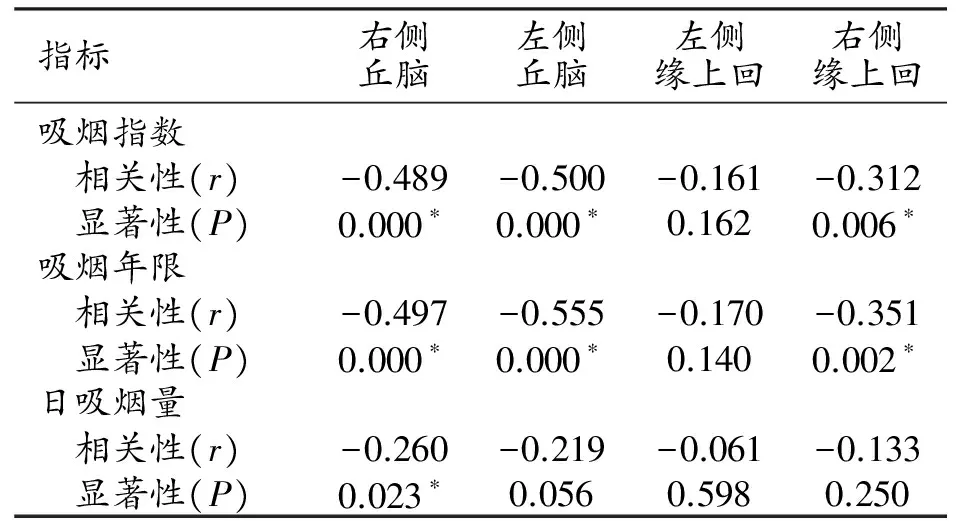
表3 兩組間有差異腦區的灰質體積與吸煙相關指標的相關性分析
注:*差異有統計學意義(P<0.05)。
討 論
1.VBM研究灰質體積與吸煙(尼古丁)成癮性的關系
腦結構形態學研究的常用方法有兩種:感興趣區(region of interest,ROI)法和基于體素的形態學測量(VBM)。VBM方法由Ashburner等[6]提出,是一種基于全腦的分析技術,利用計算機進行自動處理,在全腦內對灰、白質的局部密度或體積進行基于體素的對比分析,定量計算局部灰、白質密度和體積的改變,從而精確顯示腦組織的形態變化,進而可了解腦神經元的損傷情況[12]。VBM在體素水平對全腦高分辨率解剖像進行整體分析,不需要手動設置感興趣區,客觀性、準確性均較高,目前在中樞神經疾病所致的腦結構改變的研究中已廣泛使用[13]。吸煙對大腦結構變化的影響,尤其是煙草消費量與腦組織體積或組織局部密度之間的關聯最近受到越來越多的關注[14],然而,以往的形態學研究結果并未達成共識,并且較少有關于尼古丁依賴程度的研究。尼古丁依賴性是吸煙成癮嚴重性一個相對穩定的性狀,FTND評分是從物理角度來評估吸煙者尼古丁依賴性及成癮性的一個相對客觀的指標,也從心理方面來測量對吸煙依賴的程度,是評價吸煙相對穩定和可遺傳特性的可靠指標,也是反映吸煙者和不吸煙者間大腦解剖差異的潛在量化指標[15]。此外,由于較少暴露/輕度依賴性吸煙者之間可能具有中間的大腦表型,將所有吸煙者組合成一個組可能不能顯示出差異較小的腦區,研究認為當FTND評分<6分時,該吸煙者對尼古丁屬于輕度依賴[16],因此本研究中將FTND評分<6分的吸煙者納入輕度尼古丁依賴組,以識別輕度尼古丁依賴者與不吸煙者(對照組)間行為學差異的相關腦區,這對指導戒煙治療也具有重要意義。
2.丘腦灰質體積減小程度與吸煙成癮性的關系
研究發現尼古丁是通過獎賞回路(主要是中腦邊緣多巴胺系統(Mesolimbic Dopamine System,MLDS))引起成癮效應。尼古丁通過與中樞神經系統內的煙堿乙酰膽堿受體(nicotinic acetylcholine receptor,nAChR)有高度的親和力,尼古丁通過激活nAChR來調節多種中樞神經遞質的傳遞和釋放,導致成癮效應[17]。研究表明全腦中nAChR含量最高的部位在丘腦,nAChR激動劑能促使丘腦活性增加[18];其次,丘腦還含有多巴胺受體,尼古丁可直接或間接增加多巴胺的釋放,作用于多巴胺受體,完成獎賞效應,從而導致機體對尼古丁產生依賴;同時,多巴胺還與尼古丁成癮的渴求及增強作用相關,主要是刺激多巴難信號傳導,放大藥物以及藥物相關線索的作用,從而導致強迫性的使用藥物以致于成癮[19]。丘腦的高受體性使其成為尼古丁長期刺激的靶目標,本組結果顯示輕度尼古丁依賴者雙側丘腦的灰質體積較不吸煙者明顯減小,這一結果與既往的研究結果(長期吸煙刺激會引起丘腦體積減小及功能減弱)相一致,本研究還發現丘腦灰質體積的減小與吸煙指數呈負相關,吸煙指數是評價吸煙者到目前為止吸煙總量的相對客觀的指標,本研究結果說明丘腦受損傷的程度與一生中接受的煙霧刺激有關,吸煙量越多導致丘腦損傷越嚴重,這與以往研究一致[20]。
3.大腦皮層腦區灰質體積減小與吸煙成癮性的關系
本研究還發現輕度依賴組中雙側緣上回灰質體積較對照組減小,且右側緣上回的灰質體積與吸煙指數及吸煙年限呈負相關。結果表明輕度尼古丁依賴者吸煙量越多,右側緣上回萎縮越嚴重。緣上回即BA40區,與語言工作記憶及空間注意等功能有關[21]。Addicott等[19]使用尼古丁噴霧研究吸煙者腦功能發現,吸煙者雙側緣上回激活使其BOLD信號增加,說明尼古丁刺激可能在一定程度上激活雙側緣上回。注意控制還會通過緣上回的額頂葉回路,來促進空間注意控制網絡對認知功能的控制[22]。有研究表明,吸煙者視覺皮層注意相關神經激活的減少和在做時間任務相關活動時頂葉皮層神經激活的增加是相關的[23]。這些均可能與慢性吸煙者緣上回灰質體積的減小有關。因此,本研究結果顯示雙側緣上回灰質體積減小,而緣上回與記憶及注意力均有關,這也進一步印證了輕度尼古丁依賴者/短期吸煙者的記憶及注意力增強。
4.本研究的局限性
本研究存在以下不足之處:在輕度尼古丁依賴組與對照組比較時,未包括女性受試者,研究結果可能不適用于女性吸煙群體。因此,未來需要擴大樣本量進一步研究。本研究結果表明輕度尼古丁依賴者的腦結構與不吸煙者間確實存在一定的差異,但是不能確定其它因素(比如遺傳因素)是否也是引起這些腦區差異的內在混雜因素,因此仍然需要進一步研究來解釋這個問題。
參考文獻:
[1] Jha P,Ramasundarahettige C,Landsman V,et al.21st-century hazards of smoking and benefits of cessation in the United States[J].New England J Med,2013,368(4):341-350.
[2] 楊焱,南奕,屠夢吳,等.《2015中國成人煙草調查報告》概要[J].中華健康管理學雜志,2016,10(2):85-87.
[3] 中華人民共和國衛生部.中國吸煙危害健康報告[M].北京,人民衛生出版社,2012:1-30.
[4] Zhu SH,Lee M,Zhuang YL,et al.Interventions to increase smo-king cessation at the population level:how much progress has been made in the last two decades[J].Tob Control,2012,21(2):110-118.
[5] 袁藝,裴改改.藥物成癮的腦結構與功能影像學研究進展[J].中華行為醫學與腦科學雜志,2010,19(2):187-189.
[6] Ashburner J,Friston KJ.Voxel-based morphometry-the methods[J].NeuroImage,2000,11(6):805-821.
[7] Heatherton TF,Kozlowski LT,Frecker RC,et al.The fagerstr?m test for nicotine dependence:a revision of the fagerstr?m tolerance questionnaire[J].Brit J Addict,1991,86(9):1119-1127.
[8] Peng P,Wang Z,Jiang T,et al.Brain-volume changes in young and middle-aged smokers:A DARTEL-based voxel-based morphometry study[J].Clin Respir J,2015,11(5):621-631.
[9] American Psychiatric Association.Diaginostic and statistical ma-nual of mental fisorders (5th ed) [M].Arlington:Am Psychiatr Publ,2013:1-30.
[10] Oldfield RC.The assessment and analysis of handedness:the Edinburgh inventory[J].Neuropsychol,1971,9(1):97-113.
[11] Ashburner J,Friston KJ.Unified segmentation[J].Neuroimage,2005,26(3):839-851.
[12] Cavallari M,Moscufo N,Meier D,et al.Thalamic fractional anisotropy predicts accrual of cerebral white matter damage in older subjects with small-vessel disease[J].J Cerebr Blood Flow Metabol,2014,34(8):1321-1327.
[13] Colloby SJ,O'Brien JT,Taylor JP.Patterns of cerebellar volume loss in dementia with Lewy bodies and Alzheimer's disease:a VBM-DARTEL study[J].Psychiatr Res Neuroimaging,2014,223(3):187-191.
[14] Fritz HC,Wittfeld K,Schmidt CO,et al.Current smoking and reduced gray matter volume-a voxel-based morphometry study[J].Neuropsychopharmacology,2014,39(11):2594-2600.
[15] Dijkstra A,Tromp D.Is the FTND a measure of physical as well as psychological tobacco dependence[J].J Sub Abuse Treat,2003,23(4):367-374.
[16] Zhang X,Salmeron BJ,Ross TJ,et al.Factors underlying prefrontal and insula structural alterations in smokers[J].Neuroi-mage,2011,54(1):42-48.
[17] Dani JA,De BM.Cellular mechanisms of nicotine addiction[J].Pharmacol Biochem Behav,2001,70(4):439-446.
[18] Sutherland MT,Ray KL,Riedel MC,et al.Neurobiological impact of nicotinic acetylcholine receptor agonists:an activation likelihood estimation meta-analysis of pharmacologic neuroima-ging studies[J].Biol Psychiatr,2015,78(10):711-720.
[19] Addicott MA,Oliver JA,Joseph MF.Nicotine increases anterior insula activation to expected and unexpected outcomes among nonsmokers[J].Psychopharmacology (Berl),2017,234(7):1145-1154.
[20] Liao Y,Tang J,Liu T,et al.Differences between smokers and non-smokers in regional gray matter volumes:a voxel-based morphometry study[J].Addic Biol,2012,17(6):977-980.
[21] Deschamps I,Baum SR,Gracco VL.On the role of the supramarginal gyrus in phonological processing and verbal working memory:evidence from rTMS studies[J].Neuropsychologia,2014,53(4):39-46.
[22] Egner T,Delano M,Hirsch J.Separate conflict-specific cognitive control mechanisms in the human brain[J].Neuroimage,2007,35(2):940-948.
[23] Vossel S,Warbrick T,Mobascher A,et al.Spatial and sustained attention in relation to smoking status:behavioural performance and brain activation patterns[J].J Psychopharmacol,2011,25(11):1485-1495.

