前列腺癌體積對PI-RADS v2檢出效能的影響:基于逐層切片病理檢查
王慧慧, 胡娟, 何群, 沈棋, 王霄英, 高歌, 姜健, 王可
多參數磁共振成像(multiparametric MRI,mpMRI)是評估前列腺癌(prostate cancer,PCa)的重要影像檢查方法[1-2],檢查目的逐步由術前分期或復查演變為定性診斷[3]。為了建立前列腺mpMRI圖像解讀和報告規范,前列腺影像報告及數據系統(Prostate Imaging Reporting and Data System,PI-RADS)在2012年首次由歐洲泌尿生殖放射學會(ESUR)提出,并在2014年進行了更新和修正(命名為PI-RADS v2)[4-5]。PI-RADS v2是目前研究數據和共識的結合體,大部分標準都是基于專家的臨床經驗和共識,仍然迫切需要不同地區的研究數據進行分析和驗證,并根據這些臨床經驗和客觀數據逐步發展和不斷優化。本研究以前列腺逐層切片病理檢查為標準,探討PI-RADS v2對不同體積前列腺癌的診斷價值。
材料與方法
1.病例資料
回顧性搜集2012年11月-2017年1月于我院行前列腺mpMRI檢查的患者資料。納入標準:①臨床資料完整;②mpMRI資料完整;③于本院行前列腺根治術(radical prostatectomy,RP)并進行逐層切片病理檢查;④RP之前未進行過任何治療,包括內分泌治療和放化療等。
2.mpMRI掃描技術
使用GE Signa TwinSpeed 3.0T、Discovery HD750 3.0T和Philips Achieva TX 3.0T磁共振掃描儀[2]。患者采用仰臥位,以盆腔相控陣線圈采集圖像。前列腺mpMRI局部掃描的基本序列包括T1WI、T2WI、擴散加權成像(diffusion-weighted imaging,DWI)及動態對比增強掃描(dynamic contrast enhancement,DCE)。其中,橫軸面T2WI采用FSE/TSE序列,掃描參數:TR 3500或2924 ms,TE 85或90 ms,層厚4 mm,層間距0 mm,回波鏈長度19或14,視野24 cm ×24 cm或18 cm×26 cm,激勵次數4或3,矩陣320×256或180×244。DWI掃描使用單次激發EPI序列(b值=0和800~1000 s/mm2),并重建表觀擴散系數(apparent diffusion coefficient,ADC)圖。DCE掃描采用肝加速容積采集(liver accelerate volume acquisition,LAVA)或T1高分辨率各向同性容積激發(T1high resolution isotropic volume excitation,THRIVE)序列,使用高壓注射器經肘靜脈團注Gd-DTPA,劑量0.1 mmol/kg,注射流率2 mL/s;打藥前進行一組橫軸面掃描作為蒙片,打藥的同時進行連續橫軸面圖像采集,時間約3 min(17個時相);LAVA序列掃描參數:TR 3.1~4.5 ms,TE 1.5~2.2 ms,翻轉角15°,視野36 cm×36 cm,矩陣256×256,層厚3.8 mm;掃描層數22,并行采集空間敏感性編碼技術;eTHRIVE序列掃描參數:TR 3.15 ms,TE 1.5 ms,翻轉角10°,視野31 cm×20 cm,矩陣288×288,層厚2.5 mm,掃描層數40,并行采集空間敏感性編碼技術。
3.mpMRI圖像分析
由兩位影像科醫師(前列腺MR閱片經驗分別為2和16年)按照PI-RASD v2標準在PACS上進行獨立盲法評分(對患者的臨床資料和既往影像診斷均不知情)。PI-RADS評分的臨床意義[5]:1分,臨床顯著癌的可能性非常小;2分,臨床顯著癌的可能性較小;3分,臨床顯著癌的可能性不確定;4分,臨床顯著癌的可能性較大;5分,臨床顯著癌的可能性非常大。當PI-RADS評分≥3則認為病變為可疑陽性發現。閱片的流程是按照實際臨床工作情況設定,由兩位閱片者分別對mpMRI圖像逐層進行分析和觀察,分別記錄可疑病灶的位置和評分。
4.逐層病理切片
將離體前列腺標本置于10%的福爾馬林溶液中固定12~24 h,根治標本全部取材。將標本沿垂直背側緣切線方向做橫切面,自尖部向底部方向以3~4 mm的厚度依次進行組織切片,最后與精囊腺離斷。隨后進行常規梯度酒精脫水、透明、浸蠟和石蠟包埋,在輪轉式病理切片機上進行切片,厚度為4~5 μm,保證切片的標本組織均勻、完整、無卷曲,在完成烤片、脫蠟、HE染色、脫水和封片等各項步驟后,最終獲得HE染色病理玻片。由一位經驗豐富的泌尿病理醫師(診斷經驗30年)在顯微鏡下(40倍視野)對所有前列腺癌灶的邊界進行勾畫,并以癌灶為單位進行Gleason評分。癌灶的位置則以腫瘤細胞主要分布的部位劃分為外周帶或移行帶。使用Matlab軟件對勾畫出的癌灶逐層進行面積測量,以3 mm為厚度,計算癌灶的病理體積(面積與厚度的乘積)。臨床顯著癌的定義:癌灶體積≥0.5 cm3和/或Gleason評分≥3+4和/或有前列腺外侵犯轉移。
5.統計學方法
基于前列腺根治術后前列腺標本的逐層切片病理檢查,以PI-RADS≥3分為陽性發現,分別計算癌灶體積≥0.5 cm3、或癌灶體積<0.5 cm3且Gleason評分≥3+4時,兩位閱片者對外周帶和移行帶癌灶的檢出率。使用SPSS 19.0統計分析軟件,采用Weighted Kappa檢驗對病理證實的臨床顯著癌的PI-RADS評分進行一致性分析。Kappa值≤0.40視為一致性差,0.40
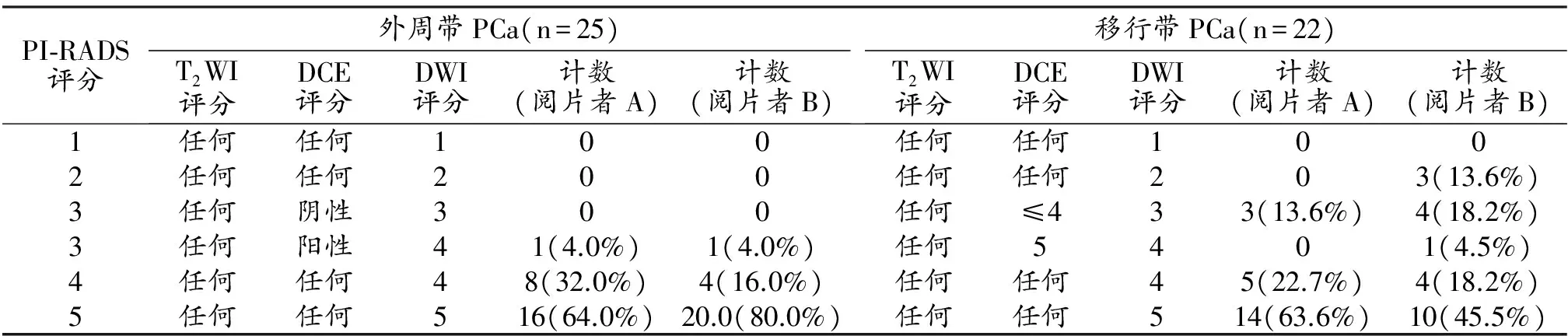
表1 體積≥0.5cm3的臨床顯著癌的評分情況
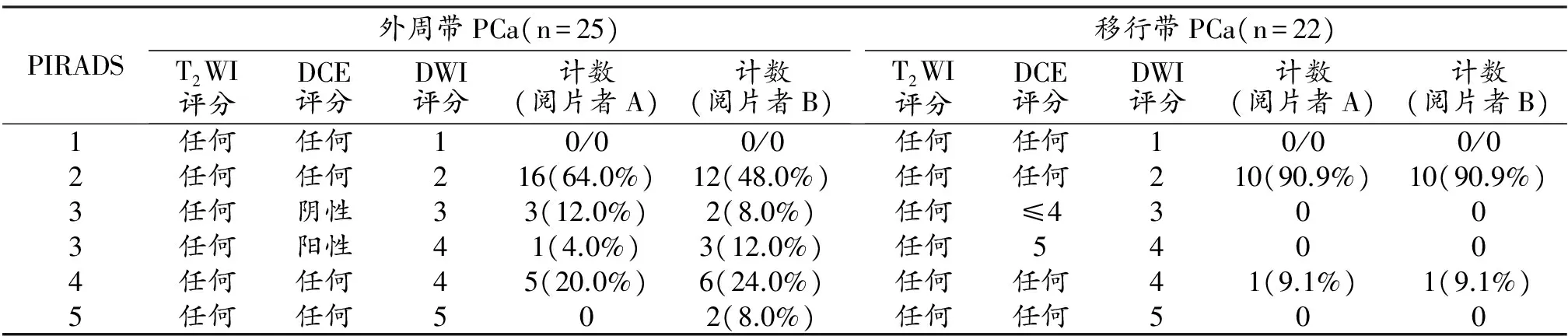
表2 體積<0.5cm3且Gleason評分≥3+4的臨床顯著癌的的評分情況
結 果
1.一般資料
共計52例患者納入分析,年齡49~76歲,平均(65.8±6.9)歲。實驗室檢查;tPSA 4.27~50.52 ng/mL,中位數11.58 ng/mL;fPSA 0.29~5.80 ng/mL,中位數1.48 ng/mL;f/tPSA范圍0.04~0.36,中位數0.11。mpMRI檢查與手術的間隔時間為21~145天,平均(65±29)天。52例患者在逐層切片病理檢查時共發現了83個臨床顯著癌病灶。
2.mpMRI檢出能力
兩位醫師對病理體積≥0.5 cm3癌灶的評估結果見表2。閱片者A對外周帶PCa(圖1)的檢出率為25/25(100%),其中DWI上評估為3分的癌灶只有1個、其DCE為陽性表現;閱片者A對移行帶PCa的檢出率為22/22(100%),其中3個癌灶在T2WI上評分為3分、但是DWI上評分為4分。閱片者B對外周帶PCa的檢出率為25/25(100%),DWI上評分為3分的癌灶有6個,其中3個病灶在DCE上表現為陽性;對移行帶癌的檢出率為19/22(86.4%),其中1個癌灶在T2WI上評分為3分、DWI上評分為5分,漏診了3例(圖2)。
兩位醫師對癌灶病理體積<0.5cm3且Gleason評分≥3+4的前列腺癌的評估結果見表2。閱片者A對外周帶PCa的檢出率為9/25(36%),在DWI上評分為3分的癌灶有4個、其中在DCE上為陽性表現者1個;對移行帶PCa的檢出率為1/11(9.1%),此例患者在各序列圖像上的評分分別為T2WI上4分、DWI上3分、DCE上為陽性表現。閱片者B對外周帶癌的檢出率為13/25(52%),DWI上評分為3分的癌灶有5個、其中DCE上為陽性表現者3個;對移行帶癌的檢出率為1/11(9.1%),與閱片者A檢出的病例一致,在各序列圖像上的評分分別為T2WI 4分、DWI 4分、DCE陽性表現。
3.兩位閱讀片者評分的一致性
將兩位閱片者對前列腺臨床顯著癌的PI-RADS評分進行一致性檢驗,結果顯示兩位閱片者評分的一致性中等,Kapppa值=0.643(P<0.001)。
討 論
前列腺mpMRI對前列腺癌的診斷、分期及隨訪具有重要的意義[6-8]。為了建立前列腺MR掃描技術、閱片和診斷報告的標準化和統一性,PI-RADS作為統一的結構式評分系統被提出[4]。PI-RADS v2是針對前列腺臨床顯著癌的mpMRI最低技術標準和最新影像診斷標準,其中對臨床顯著癌的定義為Gleason評分≥7、和/或腫瘤體積≥0.5cm3和/或前列腺外侵犯(extraprostatic extension,EPE)。與PI-RADS v1相比較,PI-RADS v2在閱片者的一致性以及對前列腺癌的診斷效能方面均有提高[9],但是閱片的一致性仍然只能達到中等程度[7,9,10]。目前針對PI-RADS v2的研究已有很多文獻報道,Zhao等[7]的研究中PI-RADS 3~5分對診斷臨床顯著癌的敏感度和特異度分別達81.9%~96.6%和83.0%~91.4%。Baldisserotto等[10]以超聲引導下穿刺活檢結果作為金標準,以PI-RADS≥3分為陽性發現時的診斷符合率為70.4%~85.2%,以PI-RADS≥4分為陽性發現時的診斷符合率為77.8%。Greer等[11]以逐層切片病理檢查作為金標準,發現PI-RADS v2對標志病灶的診斷敏感度為92%、對所有前列腺癌的診斷敏感度為63%。標志病灶定義為逐層切片病理Gleason評分最高的癌灶;如果Gleason評分一致,則選取前列腺外侵犯者為標志病灶;否則選取體積較大者為標志病灶。Vargas等[12]的研究中,mpMRI對病理體積≥0.5cm3的外周帶和移行帶PCa的檢出率分別為94%(118/125)和95%(42/44);而對病理體積<0.5cm3且Gleason評分≥4+3的癌灶,mpMRI的診斷效能非常有限,對外周帶和移行帶癌灶的檢出率僅為26%(7/27)和20%(2/10)。
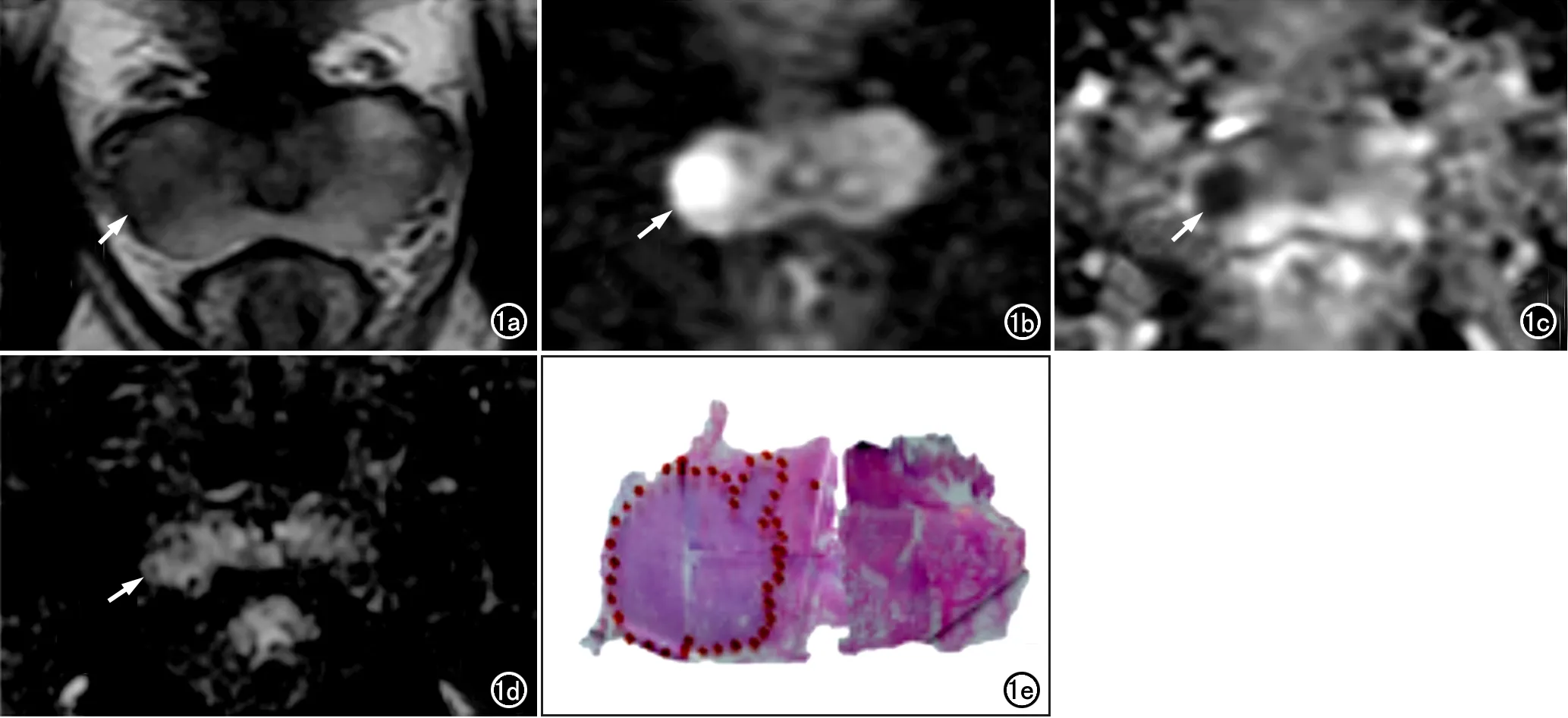
圖1 右側外周帶癌。a) T2WI示右側外周帶低信號結節(箭); b) DWI示病灶呈明顯高信號(箭); c) ADC圖示病灶呈明顯低信號(箭); d) DCE示病灶呈早期明顯強化(箭); e) 病理證實為右側外周帶癌,Gleason評分4+3,病理體積1.60cm3,閱片者A評分PI-RADS 5分,閱片者B評分PI-RADS 5分。
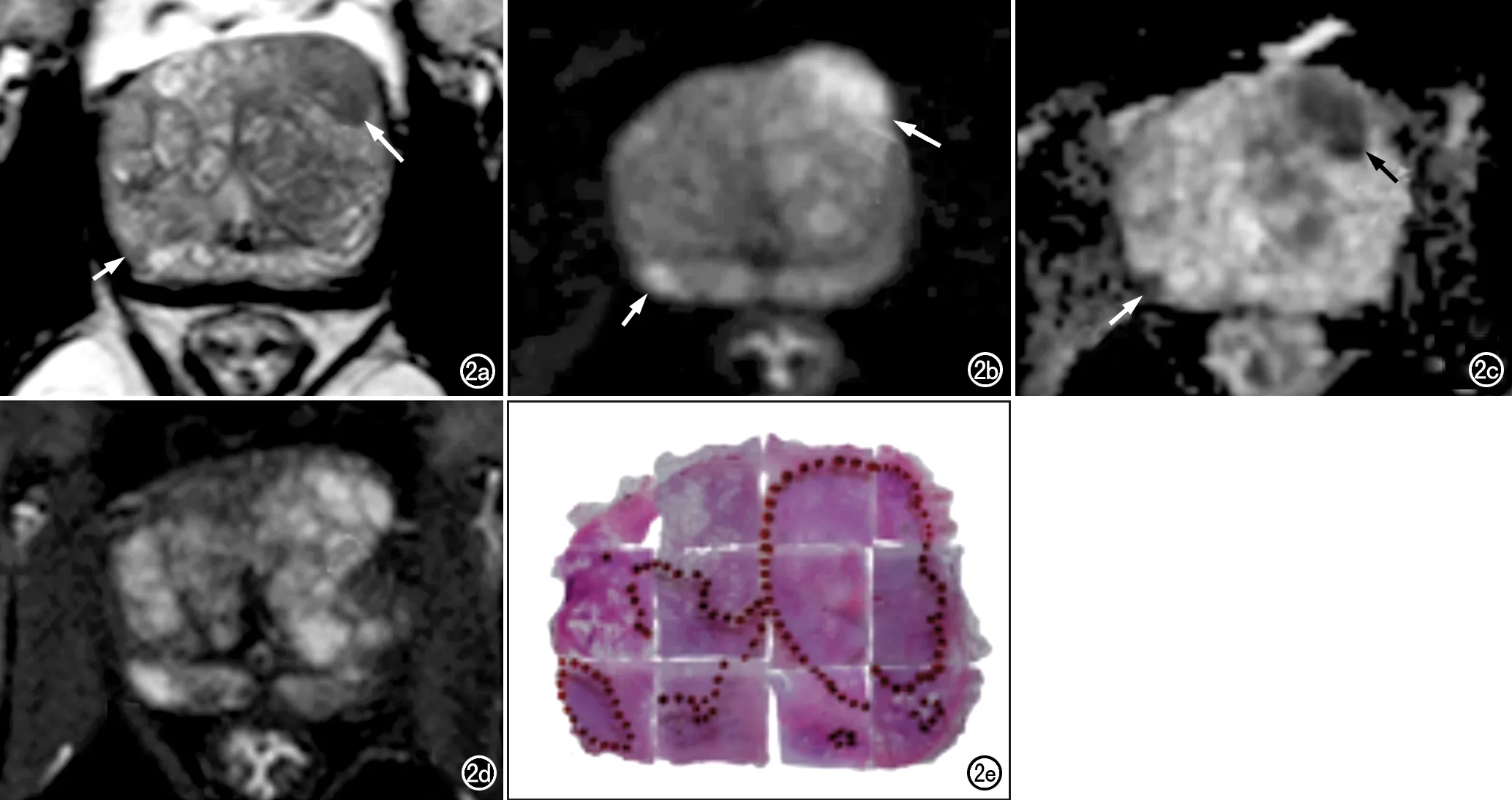
圖2 左側移行帶癌(閱片者A評分PIRADS 5分,閱片者B評分PIRADS 2分)和右側外周帶癌(閱片者A漏診,閱片者B評分PIRADS 4分)。a) T2WI示左側移行帶混雜信號結節(長箭),右側外周帶有小的癌灶(短箭); b) DWI示左側病灶呈輕度~中度高信號(長箭),右側病灶呈稍高信號(短箭); c) ADC圖示病灶均呈明顯低信號(箭); d) DCE顯示病灶強化且移行帶病灶呈明顯多發結節狀; e) 病理證實左側移行帶癌的Gleason評分3+4,病理體積8.17cm3,右側外周帶癌灶的Gleason評分3+4,病理體積0.47cm3。
本研究結果顯示,PI-RADS v2對病理體積≥0.5cm3的前列腺癌具有極高的檢出率,可以發現100%(26/26)的外周帶癌灶和86.4%~100%(19/22~22/22)的移行帶癌灶,而且閱片者間的評分一致性為中等,這些結果與上述文獻報道的結果基本一致。對于病理體積≥0.5cm3的前列腺癌,盡管閱片者的經驗不同,但均可以根據PI-RADS v2做出正確診斷,甚至臨床經驗尚淺的閱片者可以發現更多的移行帶癌灶。如本研究中有3例移行帶癌被閱片者A檢出、但未被閱片者B識別,其中1例癌灶(圖2)的病理體積為8.17cm3,Gleason評分3+4,T2WI上評分為5分(閱片者A)和2分(閱片者B),DWI上評分為3分(閱片者A和B),DCE表現為陰性(閱片者A和B)。兩位閱片者診斷出現差異的原因主要是對病灶T2WI上的表現存在不同的判斷,閱片者B認為此病灶在T2WI上信號混雜,DCE早期可見明顯的多發結節狀強化,雖然病灶在ADC圖上呈明顯低信號,但PI-RADS v2標準中認為對于移行帶病灶應以T2WI上的評分為主,所以對此病灶的最終評分為PI-RADS 2分。另外2例癌灶為Gleason評分3+3,病理體積分別為0.50cm3和0.54cm3,PI-RADS評分分別為3分(閱片者A)和2分(閱片者B):閱片者B分析此2例病灶僅在T2WI上信號改變比較明顯、且形態不規則、混雜分布在增生腺體中不易識別,但是在告知病理結果后,閱片者B表示對PI-RADS v2認識不足,需要進一步增加經驗。綜上所述,閱片者B單獨漏診的這3例移行帶癌灶,在ADC圖上均呈局限性低信號,信號改變比T2WI上更為明顯,因此結合ADC圖能更容易發現病灶。而實際臨床工作中,影像科醫師也需要綜合病灶在所有序列上的表現進行判斷,很難僅憑單一序列就做出診斷,因此多數學者仍認為PI-RADS v2目前并不完善,尚存在很多缺陷和不足。而針對這一方面,Andrew等[13]建議將ADC圖和DWI評分的作用在評估移行帶病灶中的作用加強,即對在T2WI上評分為3分且在DWI上評分為4分的移行帶病灶,將其PI-RADS最終評分改為4分。
對于病理體積<0.5cm3且Gleason評分≥3+4的癌灶,PI-RADS v2僅可以發現36%~52%(9/25~13/25)的外周帶癌,對移行帶癌的檢出率更低,僅為9.1%(1/11)。本組1例患者同時存在外周帶癌和移行帶癌,外周帶癌的Gleason評分3+4、病理體積0.47cm3,閱片者A沒有發現而閱片者B評分為PIRADS 4分。雖然閱片者A只發現移行帶癌灶,而閱片者B只發現外周帶癌灶,兩位閱片者發現的癌灶位置及PIRADS評分均不一致,但對患者本身來說采取的臨床處理方式及最終的臨床結局是一致的。雖然PI-RADS v2的臨床目的是發現臨床顯著癌,包括癌灶病理體積<0.5cm3且Gleason評分≥3+4的病灶,但目前mpMRI對前列腺癌的診斷仍具有一定局限性,檢出前列腺癌的能力依賴于癌灶的體積[14],所以認識到體積小的前列腺癌不能被mpMRI識別也是非常重要的。
本研究存在一定的局限性。首先由于只有根治術后行逐層病理切片的患者入組,導致納入分析的癌灶數量有限且均為較早期病變。其次,由于閱片者已知所有入組病例均行前列腺根治術,在PI-RADS評分時可能存在偏倚。最后,為了保證閱片狀態與常規臨床工作流程一致,設計了兩位閱片者分別進行盲法閱片,沒有在閱片前設計感興趣區而是單獨記錄識別的病灶部位及評分,不能計算診斷特異性,也不能對所有感興趣區的評分進行一致性評價。
參考文獻:
[1] 高歌,王成彥,趙凱,等.前列腺癌多參數MRI計算機輔助診斷系統的構建[J].腫瘤影像學,2016,25(2):117-122.
[2] 王慧慧,李瑋,王蕊,等.基于第二版前列腺影響報告和數據系統的前列腺多參數MRI技術要求[J].腫瘤影像學,2016,25(2):106-110.
[3] 佟艷軍,王霄英,李飛宇,等.MR對前列腺癌的定性診斷價值分析[J].中國醫學影像技術,2006,22(7):1061-1063.
[4] 李拔森,王良,閔祥德,等.第二版前列腺影像報告和數據系統對前列腺癌的診斷價值[J].放射學實踐,2016,31(12):1138-1142.
[5] Weinreb JC,Barentsz JO,Choyke PL,et al.PI-RADS Prostate Imaging Reporting and Data System:2015 Version 2[J].Eur Urol,2016,69(1):16-40.
[6] Wang R,Wang H,Zhao C,et al.Evaluation of multiparametric magnetic resonance imaging in detection and prediction of prostate cancer[J/OL].PLoS One,2015,10(6):e0130207.DOI: 10.1371/journal.pone.0130207
[7] Zhao C,Gao G,Fang D,et al.The efficiency of multiparametric magnetic resonance imaging (mpMRI) using PI-RADS Version 2 in the diagnosis of clinically significant prostate cancer[J].Clin Imaging,2016,40(5):885-888.
[8] 劉汀,王霄英,郭雪梅,等.MRI對前列腺癌診斷準確性的系統評估[J].中國醫學影像技術,2011,27(7):1481-1484.
[9] Kasel-Seibert M,Lehmann T,Aschenbach R,et al.Assessment of PI-RADS v2 for the detection of prostate cancer[J].Eur J Radiol,2016,85(4):726-731.
[10] Baldisserotto M,Neto EJ,Carvalhal G,et al.Validation of PI-RADS v2 for prostate cancer diagnosis with MRI at 3T using an external phased-array coil[J].J Magn Reson Imaging,2016,44(5):1354-1359.
[11] Greer MD,Brown AM,Shih JH,et al.Accuracy and agreement of PIRADSv2 for prostate cancer mpMRI:a multireader study[J].J Magn Reson Imaging,2017,45(2):579-585.
[12] Vargas HA,H?tker AM,Goldman DA,et al.Updated prostate imaging reporting and data system (PIRADS v2) recommendations for the detection of clinically significant prostate cancer using multiparametric MRI:critical evaluation using whole-mount pathology as standard of reference[J].Eur Radiol,2016,26(6):1606-1612.
[13] Rosenkrantz AB,Babb JS,Taneja SS,et al.Proposed adjustments to PI-RADS Version 2 decision rules:impact on prostate cancer detection[J].Radiology,2017,283(1):119-129.
[14] Vargas HA,Akin O,Shukla-Dave A,et al.Performance characteristics of MR imaging in the evaluation of clinically low-risk prostate cancer:a prospective study[J].Radiology,2012,265(2): 478-487.

