常規MRI和DKI技術診斷肝豆狀核變性疾病的對比研究
盧琦, 王安琴, 張春蕓, 武紅利, 徐春生
肝豆狀核變性(hepatolenticular degeneration,HLD)又稱Wilson病,是一種常染色體隱性遺傳病,系銅轉運蛋白障礙而導致過量銅在體內聚集,繼而導致大腦和肝臟等組織損傷,患者的主要臨床表現為神經精神癥狀[1-2]。擴散峰度成像(diffusion kurtosis imaging,DKI)是一種新的磁共振成像技術,其采用非高斯擴散模型的方法來觀察大腦組織中微觀結構的變化,尤其適合于對灰質微觀結構的觀察[3]。本研究中利用DKI技術來分析肝豆狀核變性患者大腦微觀結構的變化情況,旨在提高對肝豆狀核變性的影像診斷水平。
材料與方法
1.研究對象
搜集本院35例WD患者的病例資料,其中男21例,女14例,年齡18~45歲,平均(26.9±7.0)歲;無其它神經精神系統疾病。此外,選取性別和年齡與患者組相匹配的健康志愿者30例作為對照組,其中男15例,女15例,年齡19~48歲,平均(26.2±5.6)歲。所有受試者簽署了知情同意書。
2.數據采集
使用GE Discovery MR750 3.0T超導型磁共振成像儀及8通道相控陣標準頭顱線圈。掃描范圍自顱頂至枕骨大孔水平,檢查序列包括常規T2WI和DKI序列。常規T2WI參數:TR 9000 ms,TE 124 ms,翻轉角111°,矩陣256×256,視野250 mm×250 mm,層厚5 mm,無層間距,掃描20層;DKI序列參數:SS-EPI序列,TR 4800 ms,TE Minimum,翻轉角12°,矩陣128×128,視野240 mm×240 mm,層厚3 mm,無層間距,掃描45層,采用3個b值(0、1000 和2000 s/mm2),其中b=0 s/mm2時采集6幀圖像、共15個方向。
3.數據分析
將受試者DKI序列的圖像傳輸至GE ADW4.6工作站,利用Functool軟件包里的DKI軟件對數據進行處理,計算DKI參數值:平均擴散峰度(mean kurtosis,MK)、徑向擴散峰度(radial kurtosis,RK)、軸向擴散峰度(axial kurtosis,AK)。在雙側豆狀核(bilateral lenticular nucleus,LN)和雙側尾狀核頭(bilateral head of caudate nucleus,HCN)的最大截面上勾畫感興趣區(圖1、2),測量各參數值,每個部位測量3次、取平均值。再以同樣的方法測量常規T2WI上雙側LN、HCN和側腦室的T2信號值,以側腦室為基準計算LN和HCN的T2信號變化率。測量時盡量避開血管、腦脊液等結構以降低誤差。
使用SPSS 19.0軟件包進行統計學分析。采用校正t檢驗比較雙側豆狀核、雙側尾狀核頭部的DKI參數值和T2信號變化率在WD組與對照組之間的差異,以P<0.05為差異有統計學意義。再繪制受試者工作特征(receiver operating characteristic curve,ROC)曲線,計算約登指數,判定各個參數值的診斷敏感性和特異性,并計算ROC曲線下面積(area under ROC curve,AUC)。
結 果
在經過圖像偽影及頭動等因素的篩選后,最終有26例WD患者及25例健康志愿者納入本研究。所有受試者的基本臨床資料見表1。WD組與健康對照組間性別和年齡的差異均無統計學意義(P>0.05)。
兩組患者尾狀核和豆狀核的DKI參數和T2信號變化率見表2~3。與健康對照組相比,WD組雙側豆狀核的MK值及T2信號變化率升高且差異具有統計學意義(P<0.05),KA值及KR值的差異無統計學意義(P>0.05);ROC曲線分析結果見表4和圖3,其中MK值及T2信號變化率的ROC曲線下面積分別為0.825、0.708,95%置信區間分別為0.710~0.939、0.551~0.864。雙側尾狀核頭的MK、KA和KR值及T2信號變化率均升高,差異均有統計學意義(P<0.05);ROC曲線分析結果見表5、圖4,其中MK值、KA值、KR值及T2信號變化率的ROC曲線下面積分別為0.814、0.822、0.670和0.686,95%置信區間分別為0.684~0.943、0.700~0.944、0.515~0.825和0.533~0.839。
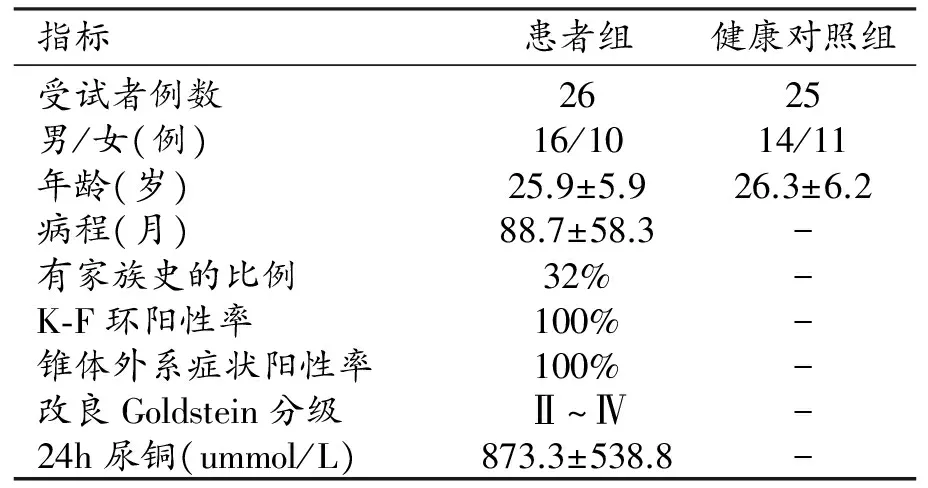
表1 兩組的基本臨床資料
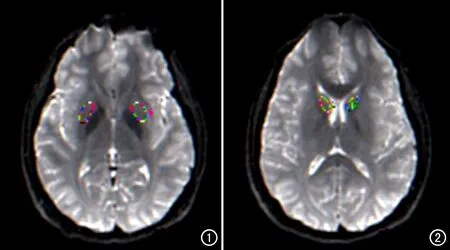
圖1 在T2WI上在雙側豆狀核勾選感興趣區,以確定DKI參數測量的ROI。 圖2 在T2WI上于雙側尾狀核頭部選感興趣區,以確定DKI參數測量的ROI。
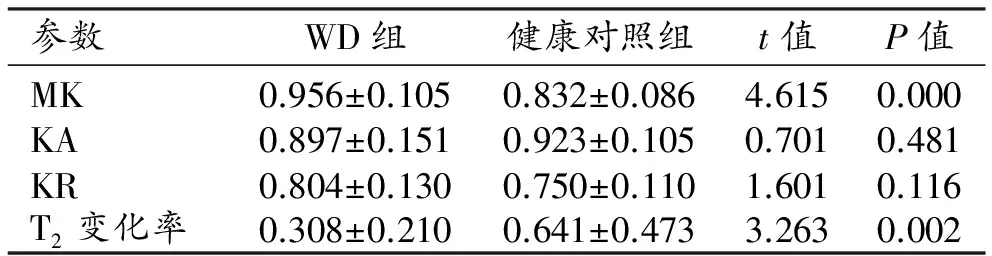
表2 兩組中雙側豆狀核部位ROI各參數值及比較
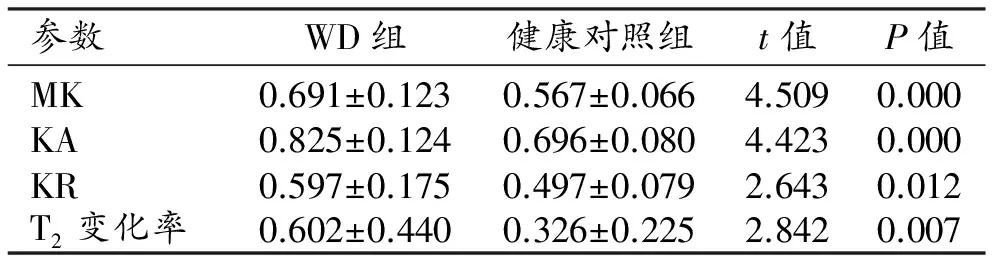
表3 兩組中雙側尾狀核頭部各參數值及比較
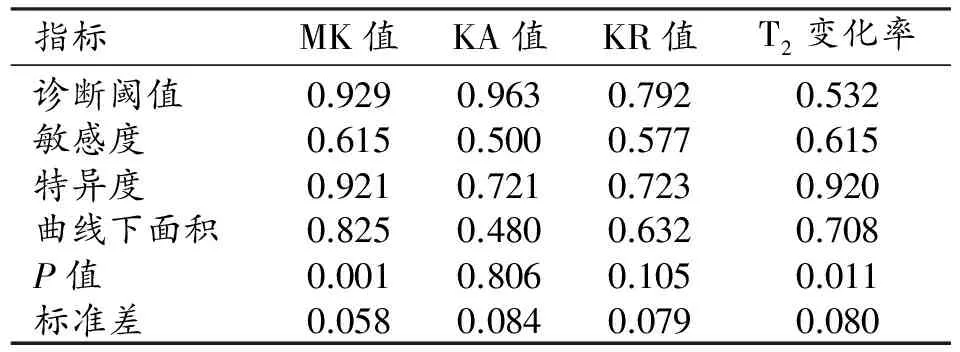
表4 雙側豆狀核各參數的診斷效能
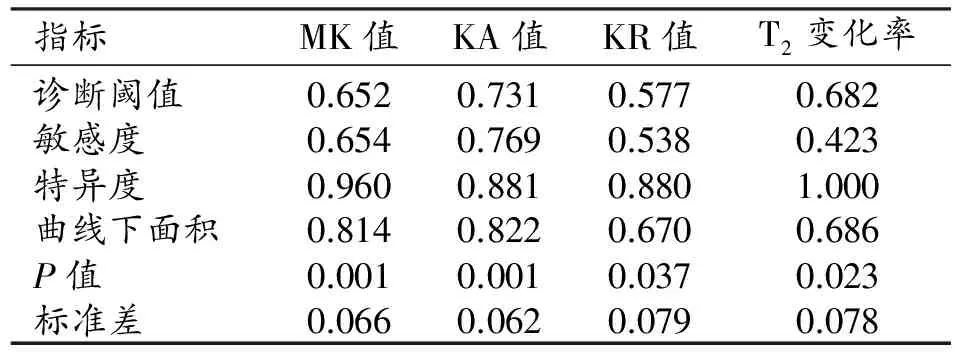
表5 雙側尾狀核頭部的診斷效能
討 論
1.肝豆狀核變性及其常規影像學表現
WD是一種常染色體隱形遺傳性疾病,銅藍蛋白合成障礙是本病的主要病理機制,肝臟銅藍蛋白合成減少,排泄減少,腸道對銅吸收增加,導致過量的銅析出并沉積在肝臟、腦組織及角膜等部位而引起損傷。有研究表明WD患者中樞神經系統的損傷主要累及豆狀核、尾狀核、丘腦及小腦齒狀核。因此,本研究中選取雙側豆狀核及尾狀核頭部作為感興趣區,分析其DKI信號及微觀結構的變化[1]。目前,對WD的診斷主要依靠臨床表現、銅生化檢測、角膜色素環和影像學等輔助檢查手段。本項研究中的WD患者主要根據其臨床表現及生化檢驗結果而明確診斷,35例患者均有神經系統癥狀,包括震顫、肌張力增高、吞咽困難及口齒不清,24h尿銅及銅藍蛋白檢測異常。
WD在常規MRI上的主要表現為雙側基底節區豆狀核對稱性長T1、長T2信號,俗稱“熊貓眼征”[4-5],可能與銅沉積在基底節區導致細胞水腫和壞死、脫髓鞘改變和膠質增生等有關[1]。顏立群等[6]對16例WD患者進行回訪性分析,10例患者表現為明顯的雙側基底節區長T1長T2信號影,其中3例呈現典型的“熊貓眼”征。劉勇等[7]對52例WD患者進行回顧性分析,發現38例患者表現基底節區不同程度的信號異常,可見常規MRI對WD具有良好的診斷價值。在本項研究中,WD患者出現不同程度的雙側豆狀核、丘腦及腦干的信號異常,部分患者有腦萎縮改變。
2.DKI技術的基本原理
DKI技術是在DTI技術基礎上發展而來的[8],與其不同的是采集的方向更多、b值更高和更多。DTI技術采用二階擴散張量模型,而DKI技術將二階張量轉換為四階張量,能夠更好地顯示扇形纖維及交叉纖維。另外,DTI技術是假定水分子在人體內的擴散信號呈線性衰減,即呈高斯分布模型。在對人體大腦組織進行成像和分析時,通常將b值設定為1000s/mm2,當b值高于1000s/mm2時,水分子擴散信號的衰減偏離線性,并且在復雜組織中因細胞器、細胞膜及間隔等諸多因素的影響,使得水分子擴散不呈高斯分布,此時采用DTI技術的水分子擴散模型來描述水分子的擴散衰減時將存在較大的誤差。在這種情況下,研究水分子擴散不均質性的DKI技術能夠更加有效地探測組織微觀結構的變化[9]。已有較多學者將DKI技術應用于臨床,如腫瘤的良惡性及惡性程度的鑒別診斷[10-11]。
由于采用的水分子擴散模型與DTI不同,DKI技術的評價指標也有所不同。平均峰度值(MK)是最常用的評價指標,通過探測水分子在組織內擴散受限的程度,來衡量感興趣區組織的復雜程度,組織結構越復雜,水分子在組織內的擴散越偏離高斯分布,MK值越大。MK的絕對值在0~3的范圍內,具有正負之分,由于MK值是各b值在各擴散梯度場施加方向上的平均值,當施加的擴散梯度場方向與水分子擴散方向的夾角在90°之內時,MK值為正值,反之,為負值。徑向峰度(KR)和軸向峰度(KA)分別反映垂直于軸突方向及平行于軸突方向的水分子擴散信息。在本研究中,雙側豆狀核的MK值與對照組間的差異有統計學意義,雙側尾狀核頭部的MK、KA及KR值與對照組間的差異均有統計學意義。有研究表明這些值的改變能夠更敏感地反映細胞骨架崩解、線粒體腫脹所導致的細胞粘度及曲度的改變,可能反映了更加顯著的組織結構改變[8,12]。
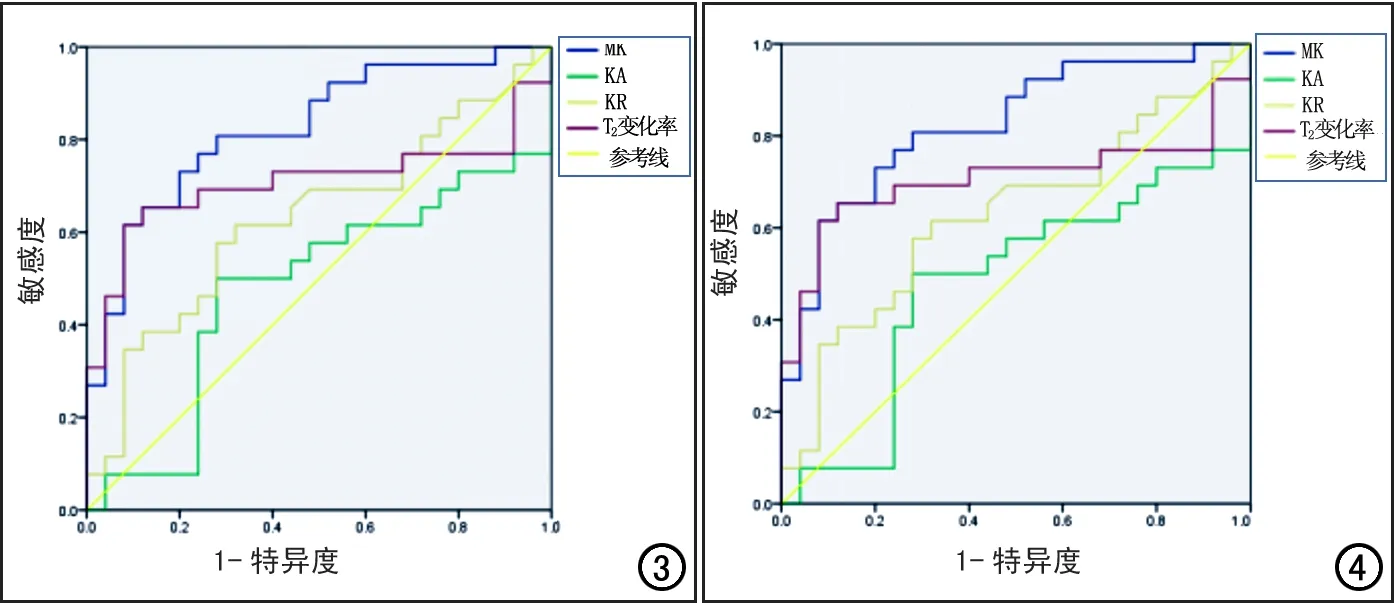
圖3 雙側豆狀核MK、KA、KR及T2變化率的ROC曲線。 圖4 雙側尾狀核頭MK、KA、KR及T2變化率ROC曲線。
3.常規磁共振與DKI技術的對比分析
有學者曾利用常規MRI技術和DTI技術對WD疾病進行對照研究,如Lawrence等[13]和Jadav等[14]分別采用基于白質骨架的擴散統計分析(Tract-Based Spatial Statistics,TBSS)方法及手工勾畫感興趣區的方法進行分析,Lawrence等發現雙側額枕葉白質、內囊及腦橋FA降低,而這些區域在常規影像學上無明顯變化;Jadav等發現部分患者在常規T2加權像上腦白質信號增高,而FA值和MD值的異常不僅出現在腦白質,在雙側內囊及腦橋等部位也可見。
肝豆狀核變性是一種可治療的遺傳性疾病,因此早診斷早治療對疾病的預后具有重要意義。本研究中通過ROC曲線分析發現,雙側豆狀核的MK值的曲線下面積明顯大于T2信號變化率,雙側尾狀核頭部的MK值和KA值的曲線下面積均大于T2信號變化率。說明DKI技術在檢測肝豆狀核變性患者大腦結構變化方面較常規MRI序列具有更高的敏感性及特異性,量化參數值能夠更敏感地反映肝豆狀核變性患者大腦組織微觀結構的改變,為進一步探討肝豆狀核變性疾病腦組織結構的異常提供影像學依據。
本研究存在很多不足:首先,納入研究的患者病程較長且均出現錐體外系的癥狀,分級在Ⅱ級以上,未能對疾病早期的大腦改變進行研究;另外,本組WD患者的病情嚴重程度差異較大、年齡和病程的跨度較大,因此研究結果的可重復性和穩定性尚需進一步研究和驗證。在以后的研究中,我們將擴大樣本量及搜集更多處于病程早期的患者進行更深入地研究,旨在對本病的診斷提供更加可靠的依據。
參考文獻:
[1] Meenakshi-Sundaram S,Mahadevan A,Taly AB,et al.Wilson's disease:a clinico-neuropathological autopsy study[J].J Clin Neurosci,2008,15(4):409-417.
[2] Ala A,Walker AP,Ashkan K,et al.Wilson's disease[J].Lancet,2007,369(9559):397-408.
[3] Yoshida S,Oishi K,Faria AV,et al.Diffusion tensor imaging of normal brain development[J].Pediatr Radiol,2013,43(1):15-27.
[4] 黎規典,徐萍,周香雪,等.肝豆狀核變性頭部MRI表現及其與臨床癥狀相關性分析[J].中風與神經疾病雜志,2013,30(8):731-733.
[5] Brito JC,Coutinho MA,Almeida HJ,et al.Wilson's disease:clinical diagnosis and "faces of panda" signs in magnetic resonance imaging:case report[J].Arq Neuropsiquiatr,2005,63(1):728-729.
[6] 顏立群,侯亞平,耿左軍,等.Wilson病的腦部MRI表現及MRS變化[J].臨床放射學雜志,2011,30(06):785-788.
[7] 劉勇,薛鵬,馬秀華,等.腦型肝豆狀核變性MRI診斷價值[J].中國實用神經疾病雜志,2014,8(1):94-95.
[8] Jensen JH,Helpern JA,Ramani A,et al.Diffusional kurtosis imaging:the quantification of non-gausian water diffusion by means of magnetic resonance imaging[J].Magn Reson Med,2005,53(6):1432-1440.
[9] Wu EX,Cheung MM.MR diffusion kurtosis imaging for neural tissue characterization[J].NMR Biomed,2010,23(7):36-48.
[10] 王瑩瑩,張焱,程敬亮,等.磁共振擴散峰度成像在乳腺良惡性病變鑒別診斷中的價值[J].放射學實踐,2017,31(2):135-138.
[11] 譚朝元,楊晶,嚴開心,等.擴散峰度成像對高級別膠質瘤及單發腦轉移瘤的鑒別診斷價值[J].放射學實踐,2017,31(3):218-222.
[12] Jensen JH,Falangola MF,Hu C,et al.Preliminary observations of increased diffusional kurtosis in human brain following recent cerebral infarction[J].NMR Biomed,2011,24(5):452-457.
[13] Lawrence A,J Saini,Sinha S,et al.Improvement of diffusion tensor imaging (DTI) parameters with decoppering treatment in Wilson's disease[J].JIMD Rep,2015,21(1):1-7.
[14] Jadav R,Saini J,Sinha S,et al.Diffusion tensor imaging (DTI) and its clinical correlates in drug naive Wilson's disease[J].Metab Brain Dis,2013,28(3):455-462.

