侗族傳統腌魚中乳酸菌的分離鑒定與生物學特性
杜 斌, 吳文能, 王繼玥, 周笑犁, 余 旭
(貴陽學院食品與制藥工程學院,貴州貴陽 550005)
貴州黔東南苗族、侗族自治州的傳統民族食品腌魚,主要是以稻田養殖的鯉魚為原料,將鯉魚由背部剖開并除去內臟,鹽腌16~24 h后,拌入糯米飯、辣椒粉及其他輔助香料入壇(桶),放置于避光陰涼的地方自然發酵而成。腌魚集甜、酸、辣、麻、咸于一體,口感軟嫩,味道鮮美,可生吃,亦可煎、炸、烤、蒸,是當地民眾招待客人的上乘佳肴[1-2]。但是由于傳統手工工藝制作過程復雜,發酵時間較長,目前腌魚還沒有大規模生產和上市流通。乳酸菌作為傳統發酵肉制品中的優勢菌群,對產品風味的形成和營養品質變化起著至關重要的作用。目前對于少數民族傳統發酵肉制品中乳酸菌的研究還比較缺乏,為此,本研究以侗族傳統民族食品腌魚為材料,對成品中的乳酸菌進行分離鑒定,并利用16S rRNA序列分析方法進行菌種鑒定,以期發現腌魚中特有的菌種資源,為改進其傳統工藝,進而發掘有益乳酸菌打下基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 試驗材料 本試驗用稻田鯉魚捕捉于貴州省黔東南州黎平縣,采用當地農戶傳統腌制方法腌制60d制成成品,另外收集當地農戶的腌魚成品,共3份樣品。采樣時嚴格按照GB/T4789.1—2010《食品安全國家標準 食品微生物學檢驗總則》操作。腌魚樣品分別編號為ZZY、CJY-1、CJY-2(ZZY為自制腌魚,CJY-1、CJY-2為采集樣品)。
1.1.2 培養基及主要試劑 MRS肉湯培養基,購自北京奧博星生物技術有限公司;PCR相關試劑,均購自北京全式金生物技術有限公司;微量生化鑒定管,購自青島海博生物技術有限公司。
1.2 儀器與設備
立式電熱壓力蒸汽滅菌鍋,上海申安醫療器械廠;電熱恒溫培養箱,上海一恒科技有限公司;2720 Thermal Cycler PCR儀,Applied Biosystems;DYY-5型電泳儀,北京市六一儀器廠;FR980凝膠成像儀,上海復日科技儀器有限公司;SanPrep柱式DNA膠回收試劑盒,生工生物工程(上海)股份有限公司。
1.3 試驗方法
1.3.1 菌株分離純化 取3 g樣品,剪碎后放入MRS液體培養基中,37 ℃恒溫厭氧培養48 h后,對培養液進行10倍梯度稀釋,取200 μL 104~107倍稀釋液于含有2% CaCO3的MRS固體培養基中,37 ℃培養48 h,挑取有溶鈣圈的單菌落接種于MRS固體培養基中,進行多次劃線分離,挑選革蘭氏陽性(G+)、過氧化氫酶陰性(H2O2-)的單菌落并進行保藏。
1.3.2 生理生化鑒定 參考《一般細菌常用鑒定方法》[3],對分離純化的乳酸菌進行生理生化鑒定。
1.3.3 16S rDNA分析
1.3.3.1 16S rDNA基因序列PCR擴增 取單菌落置于離心管中,加入20 μL無菌蒸餾水重懸,沸水浴10 min,12 000 r/min 離心5 min。上清中即含16S rDNA基因。采用細菌通用引物16S rDNA-F:5′-CAGAGTTTGATCCTGGCT-3′,16S rDNA-R:5′-AGGAGGTGATCCAGCCG CA-3′,以基因組DNA為模板PCR擴增16S rDNA基因。
25 μL反應體系:1 μL模板DNA,各2.5 μL引物(1 μmol/L),12.5 μL 2×EasyTaqPCR SuperMix,6.5 μL去離子水。反應程序:94 ℃ 5 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 2 min,25個循環;72 ℃ 2 min。用1.0%瓊脂糖凝膠進行電泳檢測。
1.3.3.2 菌株同源性分析及系統發育樹的構建 將菌株序列在GenBank數據庫中進行Blast同源性比對分析,運用MEGA 7.0軟件的相鄰計算法構建系統發育樹,判斷目的菌株的分類地位。
1.3.4 菌株生長能力和產酸能力測定 將待測菌株接種于MRS液體培養基中,37 ℃培養24 h,以未接種菌液的MRS培養基作為空白對照,每隔2 h取200 μL培養液,采用酶標儀測定其D600 nm及培養液pH值。每個樣平行測定3次。
1.3.5 溫度對菌株生長的影響 將分離菌株接種于MRS液體培養基中,分別于15、20、30、37、45、50 ℃條件下培養24 h,以未接種菌液的培養基作為空白對照,D600 nm的測定方法同“1.3.4”節,研究溫度對待測菌株生長代謝的影響。
1.3.6 NaCl濃度對分離菌株生長代謝的影響 將分離菌株接種于含鹽量分別為0%、2%、4%、6%、8%、10%的MRS液體培養基中,37 ℃培養24 h,以未接種菌液的培養基作為空白對照,D600 nm測定方法同“1.3.4”節。
1.3.7 蛋白酶活性的測定 參照文獻[4]進行,略有改動,分別以添加15%脫脂牛乳的MRS和營養瓊脂固體培養基作為測定蛋白酶活性的專用培養基。將待測菌接種于MRS液體培養基中,于37 ℃培養24 h后,無菌吸取100 μL培養液,接種于蛋白酶檢測專用培養基中,涂布均勻,于37 ℃培養 24 h,若菌落周圍有透明環,則為陽性。
1.3.8 脂肪酶活性的測定 參照文獻[5]進行,略有改動,分別以添加15%牛油、0.5%中性紅指示劑的MRS和營養瓊脂固體培養基作為測定脂肪酶活性的專用培養基。將待測菌株接種于MRS液體培養基中,于37 ℃培養24 h后,無菌吸取 100 μL 培養液,接種于脂肪酶檢測專用培養基中,涂布均勻,于37 ℃培養24 h,若培養基上出現紅色斑點,則為陽性。
2 結果與分析
2.1 菌株的分離
本試驗采用MRS選擇性培養基,對3個樣品中的優勢乳酸菌群進行分離及純化。經顯微觀察菌落形態、革蘭氏染色、過氧化氫酶試驗,得到G+和H2O2-菌株共16株,初步鑒定均為乳酸菌。其中從樣品ZZY中分離得到7株,從CJY-1中分離得到6株,從CJY-2中分離得到3株。所獲菌株的菌落形態多為邊緣整齊、表面光滑或稍粗糙,MRS培養基中的菌落呈乳白色或淺黃色凸起的圓形。鏡檢觀察全部為桿狀或短桿狀,成單、對或堆排列。
2.2 生理生化鑒定
對上述16株乳酸菌進一步進行生理生化鑒定試驗,結果見表1。可以看出,所有乳酸菌產酸,不可水解明膠和淀粉;查閱《一般細菌常用鑒定方法》《乳酸細菌分類鑒定及實驗方法》[3,6],初步確定乳酸菌主要為消化乳桿菌(8株)、植物乳桿菌(4株)、草乳桿菌(2株)和發酵乳桿菌(2株)。可以看出,消化乳桿菌為侗族傳統腌魚產品中的優勢乳酸菌之一,從菌株數量來看較多。該結果與鹽干帶魚微生物區系研究較為相似[7],但與其他傳統肉制品的微生物區系研究具有較大的差異,如干腌牛肉(Cecina de Leon)以及云南干腌火腿中乳酸菌屬細菌以植物乳桿菌、發酵乳桿菌為優勢菌[8],這可能是由加工原料及加工工藝的不同造成的。
2.3 16S rDNA分析
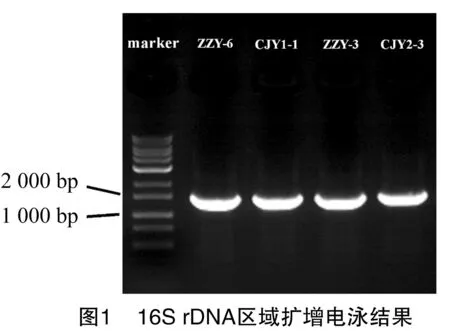
根據生化鑒定結果,分別對菌株ZZY-6、CJY1-1、ZZY-3 和CJY2-3進行16S rDNA分子生物學鑒定,將PCR擴增產物用瓊脂糖凝膠電泳進行分析,如圖1所示,4株待測菌條帶明亮清晰,且無明顯拖尾,均在1 500 bp附近,可以進行序列檢測。
2.4 測序結果分析
將PCR產物送生工生物工程(上海)股份有限公司進行測序分析,通過BLAST,將所測定的菌株序列結果與GenBank數據庫中已知菌株序列進行比對,尋找與目的基因序列同源性最高的已分類的菌種,然后用軟件MEGA 6進行序列分析,構建系統發育樹。如圖2所示,所分離菌株ZZY-6、CJY1-1、ZZY-3和CJY2-3的遺傳進化分別與已知消化乳桿菌(LactobacillusalimentariusW369、L.alimentariusIMAU80036)、已知植物乳桿菌(L.plantarumNi344、L.plantarumWCFS1)、已知草乳桿菌(L.graminisLMG 9825)和已知發酵乳桿菌(L.fermentumKFC、L.fermentumM17-1)同處于一個分支,同源性高達99%。這一結果與生化鑒定結果完全一致。
2.5 菌株生長特性
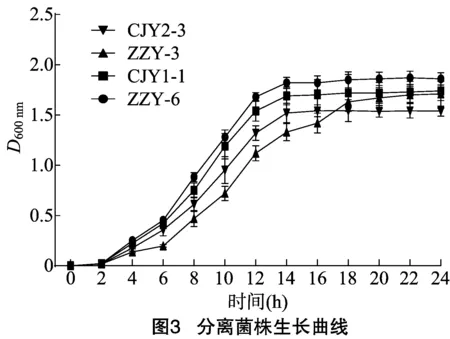
2.5.1 生長曲線的測定 對菌株ZZY-6、CJY1-1、ZZY-3和CJY2-3進行生長曲線研究。由圖3可知,4株乳酸菌中只有草乳桿菌ZZY-3在培養6 h后進入生長對數期,18 h后才趨于平緩生長,而其他4株菌均表現出相似的生長特性,在4 h 后進入對數生長期,14 h后達到穩定生長期,比較D600 nm可知,消化乳桿菌ZZY-6、植物乳桿菌CJY1-1和發酵乳桿菌CJY2-3的生長速率要高于草乳桿菌ZZY-3,更早到達平臺期。

表1分離菌株的生理生化鑒定
注:“+”表示陽性,“-”表示陰性,“±”表示11%~89%的菌株為陽性。表2同。
2.5.2 產酸性能的測定 圖4表明,ZZY-6、CJY1-1、ZZY-3 和CJY2-3等4株待測菌株均有較好的產酸能力,培養 4 h 后,菌株ZZY-6、CJY1-1和CJY2-3發酵液的pH值均快速下降。培養14 h后,這3株菌培養pH值均下降到4.0左右。而菌株ZZY-3培養16 h后發酵液pH值才降到4.0,這與菌株生長情況基本是對應的。結果表明,分離菌株符合發酵肉制品發酵劑的要求,可快速使環境 pH值下降,因此能抑制腐敗菌的生長[9],提高產品的安全性。

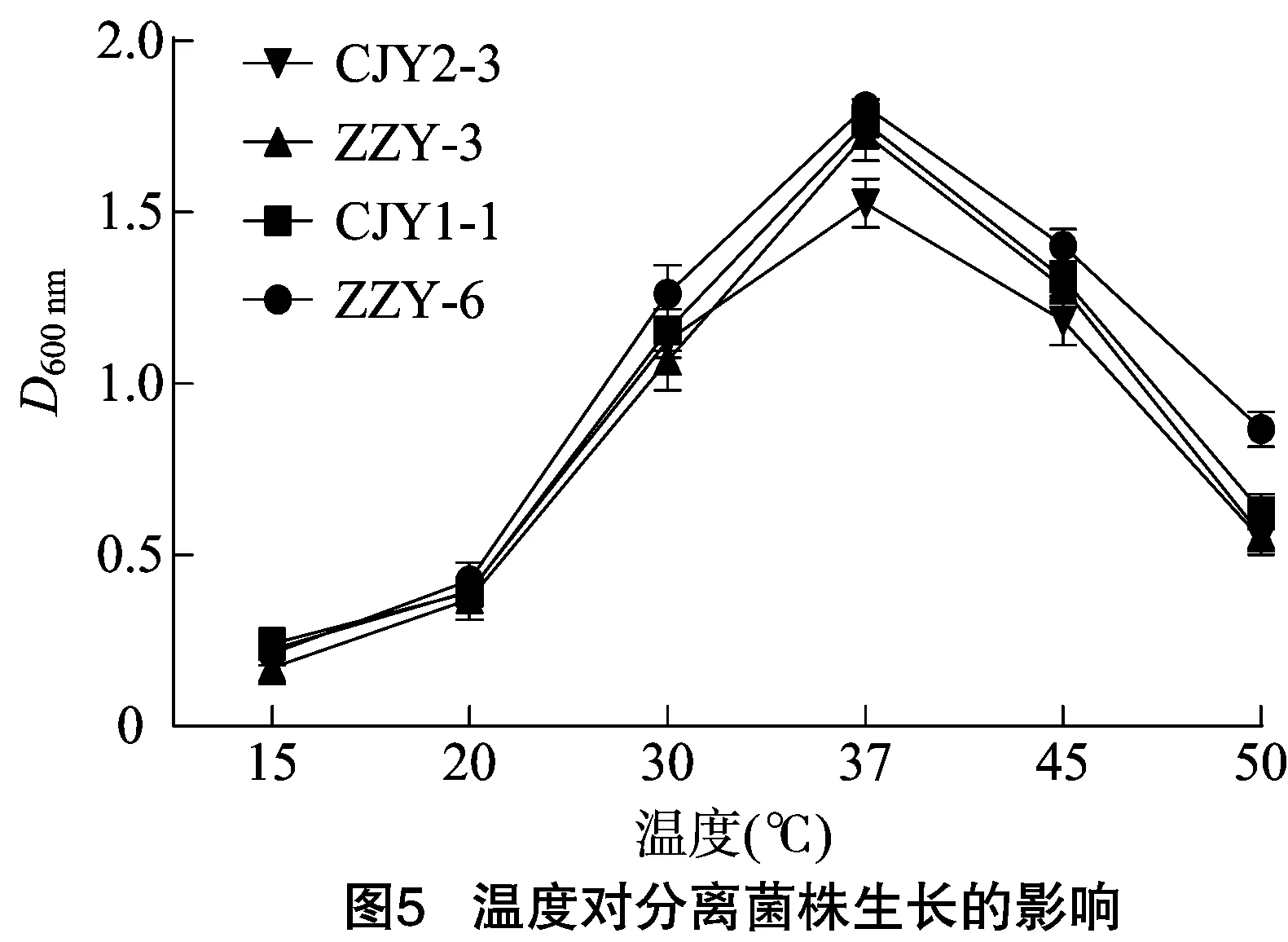
2.5.3 發酵溫度對分離菌株生長代謝的影響 溫度對于菌株生長及產酸影響較大,由圖5可知,環境溫度在15~37 ℃范圍內時,分離菌株的D600 nm逐漸升高,當溫度高于40 ℃時,其D600 nm開始下降;當溫度繼續升高,菌株的生長受到極大抑制,因此分離菌株最適發酵溫度為37 ℃。
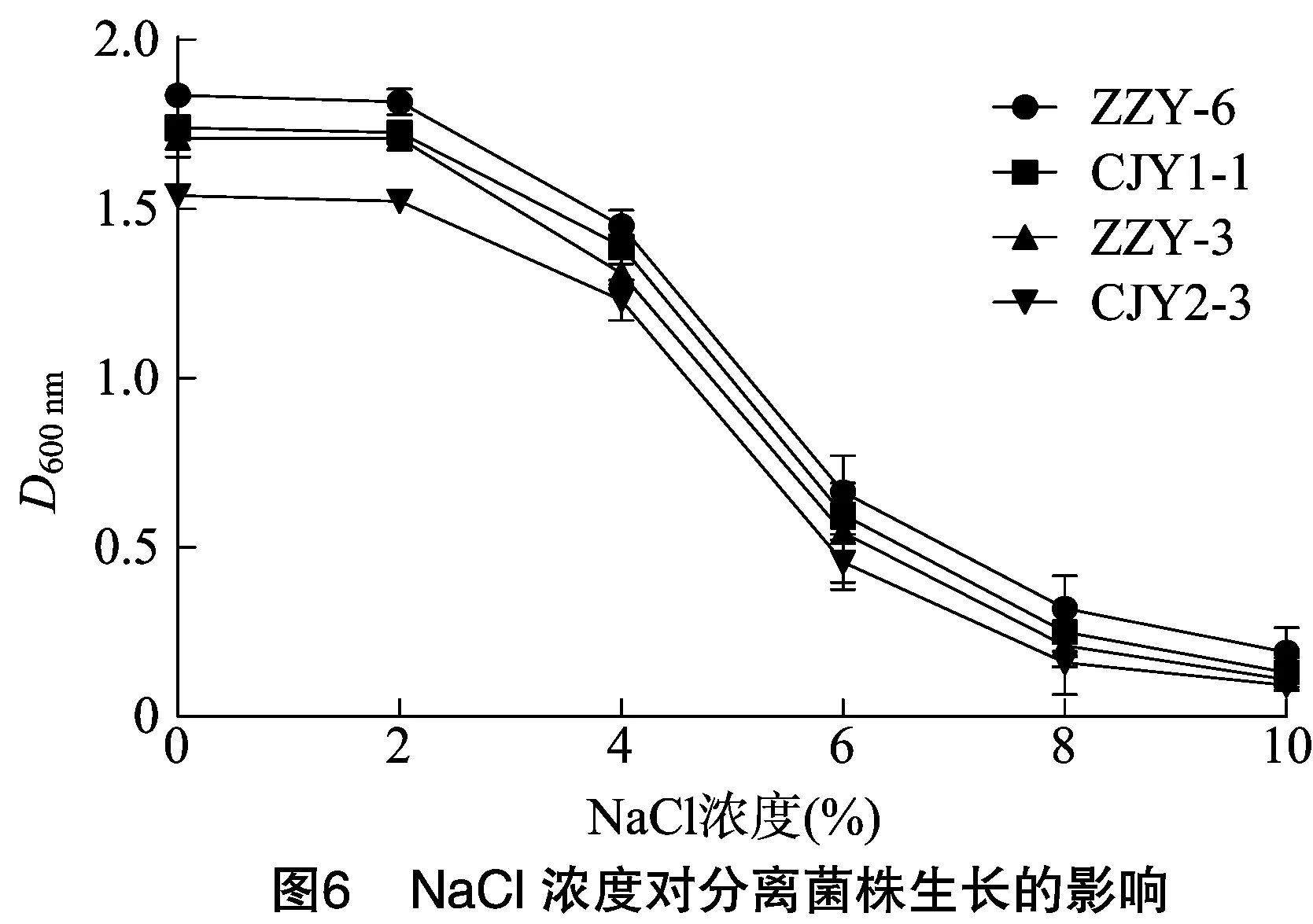
2.5.4 NaCl濃度對生長的影響 傳統腌魚腌制時通常要加入一定量的NaCl,魚體內NaCl含量較高,而對NaCl的耐受能力是選擇發酵肉制品發酵劑的一個重要因素, 篩選出的菌株通常要求至少能夠在6%的NaCl濃度下正常生長[10]。本試驗考察了NaCl濃度對4株菌株生長的影響,如圖6所示,隨著NaCl濃度的升高,4株菌株的生長均受到不同程度的抑制,隨著NaCl濃度增大,抑制作用越強;當NaCl濃度在0~4%時,菌株受到的抑制作用較小;當NaCl濃度達到6%時,菌株生長力均有所下降但仍能生長,表明這4株菌對NaCl具有一定的耐受能力,該分離菌株在腌魚發酵過程中有較強競爭力,可作為相關肉制品的備選發酵劑。

2.5.5 蛋白酶活性與脂肪酶活性測定 乳酸菌蛋白酶活性與脂肪酶活性,是篩選性質優良、穩定性強的工業生產菌株的主要指標[11-13]。本研究初步分析了4個菌株的相應酶活性。由表2可知,只有植物乳桿菌CJY1-1具有蛋白酶活性,而其余3株菌株均未檢測到蛋白酶活性;這4株菌株脂肪酶的檢測結果均為陰性,表明分離得到的菌株均不具有脂肪酶活性。
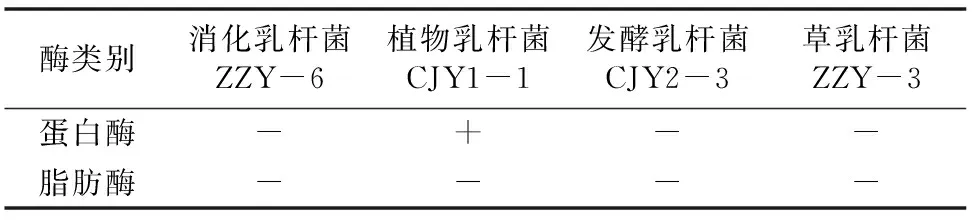
表2分離菌株的蛋白酶活性和脂肪酶活性
3 結論
由于地域不同以及制作工藝的差異,侗族傳統腌魚中優勢乳酸菌群也略有不同。本研究從3份樣品中共分離出16株乳酸菌。經生理生化鑒定,初步確定乳酸菌主要為消化乳桿菌(8株)、植物乳桿菌(4株)、草乳桿菌(2株)和發酵乳桿菌(2株),分別選取1株菌株,通過16S rDNA測序分析進行進一步確認。對分離菌株的生長特性進行研究發現,所得菌株均具有較好的生長能力和產酸性能,并且表現出較高的耐鹽能力,而且檢測到植物乳桿菌CJY1-1具有一定的蛋白酶活性,這些研究數據為了解侗族傳統腌魚中的乳酸菌群、揭示其發酵機制,以及工業化實行純菌種生產的腌魚產品提供了菌種支持,并為發掘侗族傳統腌魚中的益生乳酸菌打下了基礎。
參考文獻:
[1]陳禮強. 侗鄉腌魚的加工方法[J]. 科學養魚,2004(11):64-65.
[2]石 敏,張文學. 淺談侗族傳統食品“腌魚”的開發價值[J]. 水產科學,2005,24(11):29-30.
[3]中國科學院微生物研究所細菌分類組.一般細菌常用鑒定方法[M]. 北京:科學出版社,1978.
[4]Papamanoli E,Tzanetakis N,Litopoulou-Tzanetaki E,et al. Characterization of lactic acid bacteria isolated from a Greek dry-fermented sausage in respect of their technological and probiotic properties[J]. Meat Science,2003,65(2):859-867.
[5]Buffa M,Morais J,Jiménez-Belenguer A,et al. Technological characterisation of lactic acid bacteria isolated from raw ewes’ milk for cheese making[J]. Milchwissenschaft-Milk Science International,2006,61(4):404-407.
[6]凌代文,東秀珠. 乳酸細菌分類鑒定及實驗方法[J]. 微生物學通報,1999(1):6-15.
[7]陳學云,侯魯娜,丁玉庭,等. 鹽干帶魚中乳酸菌的分離鑒定及其生物學特性研究[J]. 食品工業科技,2010,31(11):165-167.
[8]黃艾祥. 云南干腌火腿品質特征形成與微生物作用研究[D]. 重慶:西南大學,2006.
[9]邵淑娟. 產凝乳酶霉菌菌種的誘變選育及其酶學性質研究[D]. 長春:吉林大學,2011.
[10]馬德功. 發酵香腸中乳酸菌的分離、篩選及其應用[D]. 濟南:山東輕工業學院,2008.
[11]張光偉,王宇建,錢 萍,等. 酸性蛋白酶高產菌選育的研究[J]. 江蘇食品與發酵,2005(3):8-13.
[12]趙 霞,馬儷珍. 微生物及其酶制劑在肉類工業中的應用[J]. 肉類工業,2003(8):37-40.
[13]Liepe H U. Starter cultures in meat production[J]. Biotechnology,1984(5):400-424.

