番茄遺傳轉化與篩選鑒定的改進研究
祁春芳,王 婷,劉霞宇,石曉雯,于治芹,劉世芳,梁建萍,賈小云
(1. 山西省桑干河楊樹豐產林實驗局,山西大同 037006; 2. 山西農業大學 生命科學學院,山西太谷 030801)
番茄(Lycopersiconesculentum)是世界上最重要的果蔬作物之一[1],具有基因組數目較小(950 Mb)、自花授粉、產量高、生長期短等特點,是生產轉基因產品的模式植物之一[2-3]。番茄轉基因技術經過30多年的研究,尤其是番茄全基因組測序的完成[4],加快高產和高營養番茄品種的培育,目前已獲得抗寒性強[5]、抗病蟲害[1]、耐貯藏、口感好和高花青素含量[6]的番茄,為田間生產提供一些新的優勢種。
植物遺傳轉化是指用離體培養的植物組織、細胞或原生質體作為受體,通過遺傳轉化方法向受體內轉入外源基因,獲得穩定表達的轉基因植物體[7]。常用植物遺傳轉化方法有基因槍法、電擊法、顯微鏡注射法、農桿菌介導法、花粉管通道法等。在番茄中,農桿菌介導的遺傳轉化法應用較廣泛[8-9],但轉化率不穩定和轉化效率低是番茄遺傳工程改良的主要問題。影響番茄遺傳轉化率的因素包括:外植體、農桿菌類型、外源基因的選擇、菌液OD值、侵染、預培養和共培養時間等。已有的番茄轉化相關研究表明,當外植體為子葉[10-15]、菌株為GV3101[16]、OD600值為0.2~0.6、農桿菌侵染時間為5~20 min[8,11]、預培養時間為2 d[11-12]、共培養時間為48~72 h時轉化率較高[8,11]。
為方便篩選和鑒定轉基因植株,大多數用于遺傳轉化的載體中通常含有選擇標記基因。新霉素磷酸轉移酶基因 nptⅡ可使卡那霉素(Kan)發生磷酸化而失活,進而導致植物產生卡那霉素抗性。pC2300-pOT2植物表達載體中含有Kan抗性基因,因此含此載體的轉基因植株在含Kan的環境中能夠繼續生長,而非轉基因植株則不能存活[17]。雖在小麥、棉花、大豆、水稻、玉米中已使用Kan研究過作物轉基因后代的篩選,但是不同物種、同一物種的不同品種、甚至不同外植體對卡那霉素的抗性都不同,因而有必要對篩選轉基因植株所用的卡那霉素濃度進行研究,以建立篩選轉基因番茄Kan抗性株系的有效方法。
花青素是一種水溶性的天然色素,具有抵御疾病、抗炎癥和改善視力等作用。黑莓、藍莓和枸杞等漿果中含有較高的花青素,但此類漿果生產季節性強且不耐貯藏。因此通過植物遺傳轉化法,對常食用果蔬作物中某些與花青素合成、調控相關基因進行過表達或降低表達,能夠提高花青素的含量。微小(RNA MicroRNA,miRNA)是一類內源性的單鏈非編碼小分子RNA。研究發現miR828能夠負調控蔗糖誘導下擬南芥中花青素的合成。本試驗前期已經從模式植物擬南芥中分離到 pri-miR828基因,并構建 miR828過表達載體pC2300-pOT2-At-pri-miR828[18-21]。本研究將以此載體的番茄轉化為例,從番茄種子消毒處理方法、無菌苗培養方法、轉基因陽性植株Kan篩選濃度、方式和PCR檢測等方法來對番茄的遺傳轉化過程進行研究,旨在探索一套快速高效的番茄遺傳轉化和鑒定方法,為通過轉基因技術改良番茄新品種奠定基礎。
1 材料與方法
1.1 材 料
野生型番茄種子‘Ailsa Craig’和農桿菌GV3101為山西農業大學生命科學學院賈小云教授課題組保存。番茄遺傳轉化重組載體pC2300-pOT2-pri-miR828由該課題組前期構建,載體攜帶CaMV35S啟動子和 nptⅡ植物選擇標記基因。
Marker DL1000、TaqDNA聚合酶購自TaKaRa公司,PCR引物和其他藥品試劑由生工生物工程(上海)有限公司合成或購買該公司BBI系列產品。
1.2 方 法
1.2.1 番茄種子的消毒和無菌苗的培養 取適量番茄種子于50 mL離心管中,用φ=75% C2H5OH浸種5 min,無菌水沖洗1次;飽和Na3PO3浸泡20 min(每2 min振蕩1次),無菌水沖洗3次;φ=1% NaClO水溶液浸泡10 min,無菌水沖洗4~6次,至純凈無泡沫。將消毒處理后的種子放入裝有約25 mL無菌水的50 mL離心管中,置于恒溫振蕩搖床于180 r·min-1、25 ℃黑暗下震蕩培養7 d,每天更換1次無菌水。
震蕩培養結束后將種子播種于MS培養基上(培養基組分詳見表1),置于人工氣候培養箱(1 800 lx、26 ℃、16 h光照/8 h黑暗)培養7 d。
1.2.2 番茄遺傳轉化 預培養:切取8~10 d苗齡的番茄子葉,去除尖端,放入盛有M17的培養皿中浸泡12 h后置于M1預培養基中培養2 d。
搖菌:將500 μL含 miR828過表達載體的農桿菌接種到裝有5 mL液體LB培養基的50 mL三角瓶中,于28 ℃、200 r·min-1條件下震蕩培養12 h;然后于4 200 r·min-1下低溫離心5 min,將沉淀用等體積的APM培養基重懸,再次于4 200 r·min-1下離心5 min;最后用約50 mL 液體MS培養基重懸振蕩培養至OD600值為 0.2~0.3。
侵染與共培養:將預培養的子葉放入上述用MS重懸的農桿菌中培養15 min,然后用M17沖洗殘留農桿菌,濾紙吸去多余的菌液,侵染后的子葉放入鋪有新濾紙的預培養基M1上,弱光下共培養2 d。
選擇培養:子葉轉移到M13篩選培養基中,弱光培養7 d后更換培養基為正常光照培養,2周更換新的M13培養基。
芽誘導及伸長培養:待外植體長成直徑1~2 cm 愈傷組織時,切去死去的部位,用滅菌濾紙吸干其上的水份,轉移到M4中,使愈傷繼續生長變大、長芽。
根誘導培養:待長成3~5 cm的小苗時,從芽與愈傷接觸的最底部切下插入M16培養基上誘導生根。
移苗:番茄苗長至8 cm時(基本與組培瓶口相平),將整棵植株移植到放置于溫室中的花盆內,上面鋪塑料膜,在幼苗恢復期逐漸揭開塑料膜,待繼續生長到10~15 cm后從溫室移植到大田中直至開花結果收獲種子。
1.2.3 轉基因番茄Kan最適質量濃度的篩選 向直徑90 mm的培養皿中平鋪2層濾紙,加入約15 mL 質量濃度分別為0、50、75、100 mg·L-1的Kan溶液,每皿中擺放20粒已消毒的野生型番茄種子,培養5~7 d后比較種子發芽和生長情況,確定轉基因番茄的最適Kan篩選質量濃度。每個質量濃度設置2組重復。
1.2.4 轉基因番茄Kan抗性篩選方式的確定 土壤澆灌Kan溶液篩選法:將經震蕩培養后的野生型番茄種子種植到土壤中,待種子露白并長出1~2片子葉時分別澆灌無菌水和100 mg·L-1的Kan溶液,培養6~8 d觀察幼苗的伸長情況。每處理35株幼苗。
MS培養基中添加Kan篩選法: 取已消毒的野生型和轉基因番茄種子分別播種于含Kan質量濃度為100 mg·L-1和不含Kan的MS培養基上,培養10 d后觀察種子在培養基的發芽生長情況。
蛭石澆灌Kan溶液篩選法:取2個直徑120 mm培養皿,蒸餾水沖洗后表面鋪一層蛭石,分別用無菌水和100 mg·L-1的Kan溶液將蛭石潤濕,然后將震蕩培養后的野生型和轉基因番茄種子分別種植于蛭石中,觀察、記錄種子的變化情況。
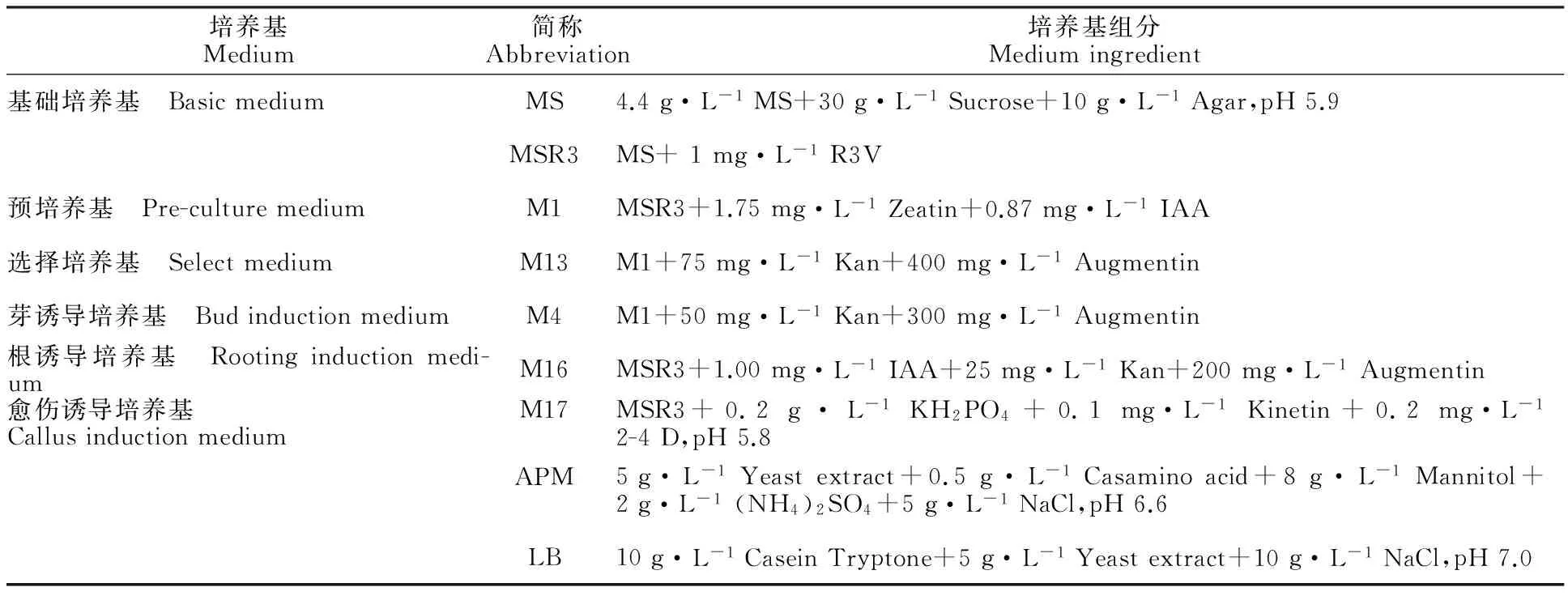
表1 番茄遺傳轉化培養基配方Table 1 The media of tomato genetic transformation
注Note:R3V(R3 vitamins):1 g·L-1VB1,0.5 g·L-1VB3,0.5 g·L-1VB6.
1.2.5 PCR鑒定法 參照 CTAB 法從幼嫩的番茄葉片中提取 DNA[22]。然后以番茄葉片基因組DNA為模板,野生番茄為陰性對照,pC2300-pOT2-pri-miR828載體為陽性對照,分別擴增 At-pri-miR828目的基因,進行陽性轉基因植株的鑒定。
根據載體上 At-pri-miR828序列設計1對能擴增出182 bp的特異引物mir828-PF:5′-TCATCATCTCTCTTACTCTCATGGTG-3′和mir828- PR:5′-TCCCACTTCCAAACATTGCT-3′。反應程序為:94 ℃ 2 min;94 ℃ 30 s, 58 ℃ 30 s,72 ℃ 30 s, 34個循環; 72 ℃ 終延伸10 min。 PCR反應體系(20 μL):模板2.0 μL,10× Buffer 2 μL,2.5 mmol·L-1dNTPs 0.4 μL,10 μmol·L-1正反向引物各0.8 μL,5 μmol·L-1TaqE 0.4 μL,ddH2O 13.6 μL。PCR產物用10 g·L-1瓊脂糖凝膠電泳檢測。
2 結果與分析
2.1 種子消毒處理對發芽率的影響
種子消毒采用C2H5OH、Na3PO3及NaClO分別浸泡及無菌水反復沖洗的方法,能使污染率減少到5%以下。
2.2 震蕩培養對番茄種子發芽和生長的影響
野生型番茄種子的發芽結果見圖1。圖1-A顯示直接將經過消毒的種子接于培養基15 d后發芽率僅為約50%且生長勢不一致。圖1-B為消毒的種子經7 d震蕩培養露白后再接種于培養基繼續培養7 d后的生長情況。全部種子基本都發芽且生長勢一致。

圖1 震蕩培養對番茄種子發芽和生長的影響Fig.1 Effect of shock culturing on germination and growth of tomato seeds
2.3 番茄的遺傳轉化
番茄遺傳轉化過程如圖2所示。用OD600值為0.2~0.3的農桿菌侵染番茄幼苗子葉15 min,然后置于含有濾紙的M1預培養基上2 d(圖2-A),再置于M13選擇培養基上待愈傷組織逐漸分化并增大(圖2-B和2-C)。
當愈傷組織長至1~2 cm時,切割叢生芽并轉移到M4芽誘導培養基。當叢生芽長至3~5 cm時(圖2-D)轉移到根誘導培養基中,使植株長出茂盛的叢生根(圖2-E)。當植株繼續長至10 cm 左右時(圖2-F),打開瓶口煉苗生長3~5 d,然后將植株移植到裝有營養土的花盆中。移植后先用透明的塑料膜蓋住上部以保持濕度,再循序漸進地揭開膜,待番茄幼苗健壯成活后轉移到大田中,開花結果后收獲果實,獲得種子(圖2-G、2-H、2-I)。本試驗共轉化子葉200個,獲得65個Kan抗性株系,轉化效率為32.5%。
A.共培養 Co-culture;B.選擇再生 Selective regeneration;C.抗性愈傷分化 Resistance callus differentiation;D.抗性芽生長 Resistance shoot growth;E.根生長 Root growth;F.煉苗生長 Seedling growth;G.花盆移栽 Flowerpot transplanting;H.溫室培養 Greenhouse culture;I.田間收獲 Field harvesting
圖2番茄遺傳轉化過程
Fig.2Genetictransformationoftomato
2.4 轉基因番茄Kan耐受最適質量濃度的篩選
由圖3可見,無菌水處理的野生型番茄種子作為對照(0 mg·L-1Kan),其種子能夠萌發、健壯生長、根系繁茂。經不同質量濃度 Kan 處理后,野生型番茄種子萌發均受到一定程度的抑制,隨著Kan質量濃度的增加,生長緩慢、根系疏短、抑制作用逐漸加強。當Kan質量濃度為100 mg·L-1時,抑制作用較強,僅有不到30%的種子有萌發跡象,其余幾乎不萌發,而且全部種子不能分化出根。后續試驗證明,進一步增加Kan質量濃度不僅影響野生型番茄種子的萌發,具有Kan抗性基因的轉基因種子的萌發也會受到抑制。因此,本試驗得出篩選轉基因番茄種子的最佳Kan質量濃度為100 mg·L-1。
2.5 Kan溶液澆灌土壤篩選法
如圖4所示,種植于土壤中的野生型番茄幼苗分別用無菌水(A)和100 mg·L-1Kan溶液(B)澆灌后,雖然經Kan溶液澆灌后的幼苗生長較緩慢而且部分有點黃化,但是幼苗的整體生長情況和野生型差異不大,不太容易辨認,說明如果用100 mg·L-1Kan溶液澆灌土培番茄幼苗來篩選轉基因植株可能會增加假陽性單株的數量,影響選擇效果。

A.無菌水澆灌 Sterile water irrigation;B.100 mg·L-1的Kan澆灌 100 mg·L-1 Kan solution irrigation
2.6 MS培養基中添加Kan篩選法
如圖5所示:野生型種子在MS培養基中正常萌發,生長健壯(5-A),但在含Kan質量濃度為100 mg·L-1的培養基中基本不萌發生長(5-B),而轉基因番茄種子在含有Kan的培養基中仍生長健壯且生長勢一致,根系發達(5-C)。因此,在培養基中添加質量濃度為100 mg·L-1Kan的方法可用來篩選轉基因番茄種子。
2.7 Kan溶液澆灌蛭石篩選法
如圖6所示:種植于用無菌水澆灌的蛭石中的野生型番茄種子7 d后可正常萌發、生長健壯,而用100 mg·L-1Kan溶液澆灌后的蛭石中的野生型番茄種子不萌發,但轉基因番茄種子仍可萌發并長勢整齊,說明用100 mg·L-1Kan澆灌蛭石培養番茄種子的方法可以用來篩選轉基因番茄種子。
A. 野生型番茄MS培養基 Wild-type tomato on MS medium;B. 野生型番茄含Kan培養基 Wild-type tomato MS medium with Kan;C. 轉基因番茄含Kan培養基 Transgenic tomato on MS medium with Kan
圖5含Kan培養基篩選轉基因番茄種子
Fig.5ScreeningoftransgenictomatobyMSmediumwithKan

A. 野生型番茄無菌水浸泡 Wild-type tomato sterile water soaking;B. 野生型番茄Kan浸泡 Wild-type tomato with Kan soaking;C. 轉基因番茄Kan浸泡 Transgenic tomato with Kan soaking
圖6Kan澆灌蛭石法篩選轉基因番茄種子
Fig.6ScreeningoftransgenictomatobyseedsoakingwithKan
2.8 轉基因番茄PCR鑒定法
選取12株經100 mg·L-1Kan篩選的抗性轉基因番茄植株的葉片提取DNA,分別標為miR828-1、miR828-2、miR828-3、miR828-4、miR828-5、miR828-6、miR828-7、miR828-8、miR828-9、miR828-10、miR828-11和miR828-12。
以野生型番茄植株DNA為陰性對照,以pC2300-pOT2-pri-miR828載體質粒 DNA為陽性對照,分別進行 At-pri-miR828 PCR擴增。如圖7 所示,所檢測的12株番茄植株中除miR828-7、miR828-11以外,其余7株都擴增出與陽性對照大小相同的約182 bp的清晰條帶,表明目的基因 At-pri-miR828已經成功整合到番茄基因組中。
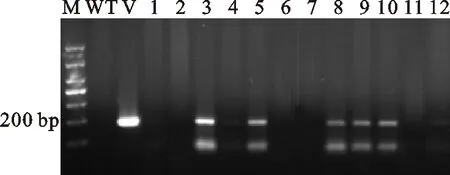
M.Marker DL 1000; WT.野生型番茄 Wild type tomato;V.載體pC2300-pOT2-pri-miR828 pC2300-pOT2-pri-miR828 plasmid; 1~12.轉基因番茄miR828-1~miR828-12 Transgenic tomatoes miR828-1-miR828-12
圖7轉基因番茄的PCR檢測
Fig.7ThePCRidentificationoftransgenictomatoes
3 結論與討論
植物外植體消毒效率的提高是遺傳轉化的基礎。本研究先用φ=75% C2H5OH浸泡5 min,然后再用飽和Na3PO3浸泡20 min,最后用φ=1% NaClO水溶液浸泡10 min后能夠使番茄種子的污染率控制在5%以下,達到很好的消毒效果。并且飽和Na3PO3能夠殺滅深層霉菌和病毒,與強消毒效果的HgCl2相比,對環境和種子都沒有傷害。震蕩培養番茄種子露白后再接種于培養基可以使種子發芽后生長勢一致,從而縮短轉基因無菌苗的獲得時間。
不同目標基因番茄的轉化效率不同。本試驗中,用含有 pri-miR828過表達載體的農桿菌共侵染番茄幼苗子葉,當預培養時間為2 d、菌液濃度為OD600=0.2~0.3和侵染時間為15 min時轉化效率較高。本試驗轉化共使用200個子葉進行研究,最終統計獲得65個轉基因株系,轉化效率為32.5%。在含有抗生素的M13培養基中,轉基因后的子葉愈傷組織飽滿,芽點嫩綠生長出很多叢生芽并正常分化(圖2-B和2-C)。在含1.0 mg·L-1IAA的M16培養基中叢生芽生根效果好,最短5 d可生根,但不同個體的生根數量、時間及粗細存在差異。另外,子葉在選擇培養基中容易向上卷曲,使部分子葉因營養缺乏而死亡,或者子葉的上翹可能使部分非轉化細胞逃過抗生素的篩選而產生假陽性植株,所以要將子葉斜插入培養基中。在轉換培養基時,注意要將外植體攜帶的原有培養基和水珠用濾紙吸干凈,以防雜菌污染。
Kan是轉基因篩選中常用的抗生素。本研究以番茄‘Ailsa Craig’為研究材料發現,當 Kan質量濃度為100 mg·L-1時,幾乎全部種子不能正常生長和分化出根,說明100 mg·L-1是遺傳轉化時篩選抗性轉基因番茄的最佳Kan質量濃度,與曹慧穎等[17]的研究結果相似。
除了在組織培養過程中向培養基中添加Kan可以篩選轉基因植株外,通過Kan溶液澆灌蛭石、土壤等方法也可以對轉基因后代進行篩選。本研究發現:用質量濃度為100 mg·L-1的Kan溶液澆灌蛭石和在MS培養基中添加Kan的方法都可以用來篩選轉基因番茄,但用100 mg·L-1Kan溶液澆灌土培番茄幼苗時篩選效果不理想。100 mg·L-1Kan溶液澆灌土壤后,番茄幼苗的整體生長情況和野生型差異不大,不太容易辨認,影響選擇效果。
PCR鑒定法是檢測外源基因是否插入植物基因組的直觀有效的手段。本研究對經100 mg·L-1Kan篩選的12株抗性轉基因番茄植株進行外源基因 At-pri-miR828的PCR檢測發現,10株可檢測到目的基因。由此也表明,利用100 mg·L-1Kan溶液澆灌蛭石和在MS培養基中添加Kan的方法可快速、準確地篩選轉基因番茄植株。
本研究在組織培養的過程中也出現畸形芽、盲芽問題。有的只是長出一片或多片肥厚的葉片、甚至是叢生雜亂的葉片而沒有生長點,有的雖有頂芽,但頂芽矮壯且肥厚,葉片較頂芽大且卷曲。這些畸形芽和盲芽都不能長成健康的植株,具體原因還在研究中。
參考文獻Reference:
[1] ARSHAD W,HAQ I U,WAHEED M T,etal.Agrobacterium-mediated transformation of tomato with rolB gene results in enhancement of fruit quality and foliar resistance against fungal pathogens [J].PlosOne,2014,9(5):e96979
[2] SUN Y D,LUO W R,SUN S Y,etal.Agrobacterium-mediated transformation of tomato(SolanumlycopersicumL.) using the expansin 10( CsEXP10) gene [J].GeneticsandMolecularResearch,2015,14(4):16215.
[3] SOLTANMOHAMMADI B,JALALI-JAVARAN M,RAJABI-MEMARI H,etal.Cloning,transformation and expression of proinsulin gene in tomato(LycopersicumesculentumMill.) [J].JundishapurJournalofNaturalPharmaceuticalProducts,2014,9(1):9.
[4] SATO S,TABATA S,HIRAKAWA H,etal.The tomato genome sequence provides insight into fleshy fruit evolution [J].Nature,2012,485:635-641.
[5] JUAN J X,YU X H,JIANG X M,etal.Agrobacterium-mediated transformation of tomato with the ICE1 transcription factor gene [J].GeneticsandMolecularResearch,2015,14(1):597-608.
[6] 趙 岑,呂立堂,趙德剛.花青素調節基因 VlmybA2對番茄遺傳轉化[J].基因組學與應用生物學,2012,31(3):270-275.
ZHAO C,Lü L T,ZHAO D G.Studies on tomato transformation with VlmybA2 regulator[J].ChineseJournalofGeneGenomicsandAppliedBiology,2012,31(3):270-275.
[7] SUN S,KANG X P,XING X J,etal.Agrobacterium-mediated transformation of tomato(LycopersiconesculentumL.cv.‘Hezuo 908’) with improved efficiency [J].BiotechnologyandBiotechnologicalEquipment,2015,29(5):1-8.
[8] 孫華軍,李國瑞,陳永勝,等.農桿菌介導的植物遺傳轉化影響因素研究進展[J].安徽農業科學,2015(24):26-27.
SUN H J,LI G R,CHEN Y SH,etal.Advances inAgrobacterium-mediated factors affecting plant genetic transformation[J].ChineseJournalofAnhuiAgriculturalSciences,2015(24):26-27 .
[9] VINOTH,GURUSARAVANAN,JAYABALAN.Optimization of factors influencing microinjection method forAgrobacteriumtumefaciens-mediated transformation of tomato [J].AppliedBiochemistryandBiotechnology,2013,169(4):1173-1187.
[10] 馬 杰,邱棟梁.番茄組培再生體系優化研究[J].中國農學通報,2011,27(8):185-189.
MA J,QIU D L.Study on tissue culture and regenerative system of tomato[J].ChineseAgriculturalScienceBulletin,2011,27(8):185-189.
[11] 付 超,王婷婷,銀利輝,等.農桿菌介導番茄遺傳轉化的相關因素優化[J].分子植物育種,2013(5):592-599.
FU CH,WANG T T,YIN L H,etal.Optimization of the factors related to the efficiency ofAgrobacterium-mediated transformation of tomato[J].ChineseJournalofMolecularPlantBreeding,2013(5):592-599.
[12] 王 玲,孫 亮,冷 平,等.番茄果實ABA合成酶NCED基因的克隆及其RNAi遺傳轉化體系的建立[J].中國農業大學學報,2009,14(5):54-60.
WANG L,SUN L,LENG P,etal.Cloning of ABA biosynthesis key enzymeNCEDgene from tomato fruit and its RNA interference genetic transformation[J].ChineseJournalofAgriculturalUniversity,2009,14(5):54-60.
[13] 高 佩,尹 銳,林彥萍,等.農桿菌介導的番茄遺傳轉化研究進展[J].北方園藝,2016(14):192-197.
GAO P,YIN R,LIN Y P,etal.Research progresses ofAgrobacterium-mediated transformation on tomato[J].ChineseJournalofNorthernHorticulture,2016(14):192-197.
[14] VIKRAM G,MADHUSUDHAN K,SRIKANTH K,etal.Effect of plant growth regulators on in vitro organogenesis in cultivated tomato(SolanumlycopersicumL.) [J].JournalofResearchinBiology,2011,1(4):263-268.
[15] AJENIFUJAHSOLEBO S O A,INGELBRECHT I,ISU N R,etal.ReproducibleAgrobacterium-mediated transformation of Nigerian cultivars of tomato(SolanumlycopersicumL.) [J].AmericanJournalofExperimentalAgriculture,2014,4(7):797-808.
[16] CHETTY V J,CEBALLOS N,GARCIA D,etal.Evaluation of fourAgrobacteriumtumefaciens strains for the genetic transformation of tomato(SolanumlycopersicumL.) cultivar Micro-Tom [J].PlantCellReports,2013,32(2):239-247.
[17] 曹慧穎,夏潤璽,方 方,等.卡那霉素在篩選轉基因番茄后代中的應用[J].江蘇農業科學,2007(6):125-127.
CAO H Y,XIA R X,F F,etal.Application of kanamycin in screening transgenic tomato[J].ChineseJournalofJiangsuAgriculturalSciences,2007(6):125-127.
[18] YANG F,CAI J,YANG Y,etal.Overexperssion of microRNA828 reduces anthocyanin accumulation inArabidopsis[J].PlantCellTissueandOrganCulture,2013,115(2):159-167.
[19] GOU J Y,FELIPPES F F,LIU C J,etal.Negative regulation of anthocyanin biosynthesis in arabidopsis by a miR156-targeted SPL transcription factor [J].PlantCell,2011,23(4):1512-1522.
[20] 賈小云,于治芹,梁建萍,等.擬南芥 At-pri-miR828基因的克隆及其對番茄的遺傳轉化[J].園藝學報,2013,40(12):2419-2428.
JIA X Y,YU ZH Q,LIANG J P,etal.Cloning ofArabidopsisAt-pri-miR828 gene and its genetic transformation into tomato [J].ChineseJournalofActaHorticulturaeSinica,2013,40(12):2419-2428.
[21] 劉 慧. miR828對番茄花青素生物合成調控的研究[D].山西:山西農業大學,2015.
LIU H.Regulation of anthocyanin biosynthesis in tomato by miR828[D].Shanxi:Shanxi Agricultural University,2015.
[22] FULTON T M,CHUNWONGSE J,TANKSLEY S D.Microprep protocol for extraction of DNA from tomato and other herbaceous plants[J].PlantMolecularBiologyReports,1995,13(3):207-209.

