西黃丸調節腫瘤微環境中Treg細胞PI3K/AKT通路的抗腫瘤作用機制研究*
李新葉,蘇 亮,徐 鈺,江一鳴,宋 捷,翁文采,梁文波**
(1.大連大學醫學院 大連 116622;2.大連大學新華臨床學院 大連 116000)
西黃丸由牛黃、麝香、乳香、沒藥四味中藥配伍而成,是抗癌中藥的經典名方,現代臨床廣泛應用于腫瘤的治療,其中在乳腺癌、肺癌、肝癌、白血病和大腸癌等治療中單用或配合放化療可以提高腫瘤患者的存活率及晚期癌癥患者的生活質量,改善臨床癥狀[1]。王洪緒所著《外科證治·全生集卷四》提到西黃丸具有清熱解毒、活血化瘀等作用,為外科治療“乳巖”(中醫將乳腺癌稱為“乳巖”)而設[2]。故本實驗選取乳腺癌為模型,進行了動物實驗。
乳腺癌是導致女性死亡的最常見的惡性腫瘤之一[3]。乳腺癌是高度異質性的疾病,其與免疫系統的關系越來越受到人們的關注[4]。近年來腫瘤微環境的改善被認為是治療此類腫瘤的方向及靶點[5]。腫瘤微環境即腫瘤生長的內部環境,由腫瘤細胞、基質外細胞以及免疫細胞等組成[6]。“種子(腫瘤細胞)與土壤(腫瘤微環境)”假說的提出,為腫瘤的生長不僅取決于其自身的發展,也離不開適合其生長的土壤這一理論提供依據[7,8]。腫瘤微環境中細胞與分子處于動態變化過程,其變化的結果是大量免疫抑制性細胞(如Treg細胞)在腫瘤微環境中大量聚集[9]。調節性T細胞(Treg)是一種具有免疫抑制功能的T細胞,在形成腫瘤免疫抑制微環境過程中發揮著重要作用,Treg細胞數量的增高與腫瘤的發生、發展與轉移密切相關[10-12],在腫瘤免疫中起著負調控作用[13]。
本課題組前期通過高通量篩查發現,西黃丸對腫瘤微環境中Treg細胞PI3K/Akt信號通路有調節作用,本研究通過4T1乳腺癌荷瘤小鼠模型,驗證了西黃丸調節腫瘤微環境中Treg細胞PI3K/AKT信號通路對Treg細胞增殖的影響,探討了其抗腫瘤作用機制。
1 實驗材料
1.1 動物與細胞
雌性BALB/c小鼠,體重20±2 g,購自大連醫科大學動物實驗中心,許可證號SCXK(遼)2013-0003。4T1小鼠乳腺癌細胞,購自中國科學院細胞庫。
1.2 藥品與試劑
西黃丸,20粒×g-1,每瓶3 g,由北京同仁堂科技發展股份有限公司制藥廠生產,批號15042128。EasySepTMMouse CD25Regulatory T cell Postive Selection Kit(STEMCELL,加拿大);胎牛血清(FBS)(天津灝洋,中國);含雙抗的RPMI 1640培養基、胰蛋白酶、BCA含量檢測試劑盒、RIPA裂解液(強)、蛋白酶抑制劑、磷酸酶抑制劑、SDS-PAGE凝膠配制試劑盒、4%多聚甲醛(凱基公司,中國);Triton-X-100、TUNEL染色試劑盒(Sigma,德國);TBST、TBS、蛋白 Marker、脫脂奶粉(CST,美國);一抗:兔抗小鼠β-actin抗體(CST,美國)、小鼠抗小鼠AKT、兔抗小鼠PI3K(Abcam,美國),山羊抗小鼠 Foxp3(Novus,美國);二抗:驢抗兔抗體(Alexafluor680)、驢抗小鼠抗體(Alexafluor790)(Abcam,美國),驢抗山羊(Alexafluor488)(Jackson,美國);Prolong diamond antifade mountant with dapi(Thermo,美國);流式檢測試劑盒(affymetrix eBioscience,美國);小鼠腫瘤浸潤組織淋巴細胞分離液(天津灝洋,中國)。
1.3 主要儀器
EasySep?磁極(18001,STEMCELL,加拿大);多功能酶標儀(SpectraMax Plus384,Bio-tek,美國);Odyssey雙色紅外激光發光儀(S/N CLX-0926,LICOR,美國);流式細胞儀(FACSCalibur,BD,美國);CO2培養箱(NU-5820E,NAURE,美國);Dounce(WHEATON,美國);Western Blot及轉膜設備(DYY-6C,北京六一,中國);正置熒光顯微鏡BX51、倒置顯微鏡IX73(Olympus,日本);低溫高速離心機(CT15RE,Hitachi,日本)。
2 實驗方法
2.1 細胞培養與動物模型的建立
用含15%FBS的1640培養基將4T1小鼠乳腺癌細胞株置于37℃,5%CO2培養箱中培養,胰蛋白酶將細胞消化下來并收集,用預熱的PBS將細胞濃度調整為1×106個×mL-1待用。分別抽取上述濃度細胞0.2 mL(2×105個)接種于SPF級BABL/c小鼠右側腋下,建立荷瘤小鼠模型,并隨機分為4組,每組10只。根據小鼠與人的臨床用藥劑量換算公式計算給藥劑量,西黃丸三個劑量組分別為 0.39 g×kg-1(Low)、0.78 g×kg-1(Mid)、1.95 g×kg-1(High);陰性對照組(Naive)給予等體積的蒸餾水。自造模后的第二天開始ig給藥(2次×d-1),每次0.2 mL,連續給藥14天,末次給藥當晚禁食。第15天脫頸處死小鼠,無菌剝離腫瘤并置于含有20%胎牛血清的勻漿液的培養皿中,冰上保存備用。
2.2 抑瘤率的計算
脫頸處死小鼠,冰上無菌條件剝離腫瘤組織,稱重并計算抑瘤率。

2.3 單細胞懸液的制備
無菌條件下剝離腫瘤組織,剪碎,于玻璃勻漿器中冰上研磨至單細胞懸液。200目尼龍篩網過濾,500 g離心15 min。反復洗滌,收集細胞。
2.4 淋巴細胞分選
用樣本稀釋液調整細胞濃度為(2-10)×108個×mL-1,緩慢轉移至含有等體積淋巴細胞分離液的離心管中,于水平垂直離心機500 g離心25 min取白環層,加10倍體積清洗液,250 g離心10 min洗滌兩次。
2.5 流式細胞術檢測腫瘤微環境中Treg細胞的含量
用PBS調整各組細胞濃度為2×106個×mL-1,取50μL單細胞懸液于EP管中,加入1 μL Anti-Mouse CD16/CD32 室溫避光孵育 15 min,加入 50 μL Anti-Mouse CD4+FITC和Anti-Mouse CD25+APC抗體混合物,4℃避光孵育30 min。加入1.5 mL Flow Cytometry Staining Buffer 600 g離心5 min洗滌兩次。加入1 mL Fixation/permeabilization工作液混勻,室溫避光孵育60 min。加入1 mL 1×permeabilization buffer,600 g離心5 min洗滌兩次。加入100 μL 1×permeabilization buffer重懸細胞,加入2.5 μL Anti-Mouse mouse/rat Foxp3 PE,室溫條件下避光孵育30 min,加入1 mL 1×permeabilization buffer,600 g離心5 min洗滌兩次。加入300 μL Flow Cytometry staining buffer重懸細胞上機檢測;應用流式細胞儀數據分析軟件分析各組間CD4+CD25+Foxp3+Treg細胞比例。
2.6 免疫磁珠分選Treg細胞
用推薦培養基調整細胞濃度為1×108個×mL-1,按50 μL×mL-1加入 FcR阻攔劑,混勻并室溫孵育5 min。按50 μL×mL-1加入Positive Selectiom Cocktail混勻并室溫孵育10 min。按20 μL×mL-1加入PE Selectiom Cocktail混勻并室溫孵育5 min,按20 μL×mL-1加入RapidSphersTM混勻并室溫孵育5 min。加入推薦培養基混勻并定容至5 mL,放入磁極中室溫孵育5 min,顛倒磁極,倒掉推薦培養基,此步驟重復4次,管壁中即含有被收集的Treg細胞,用PBS沖洗管壁,收集細胞,冰上備用。
2.7 TUNEL染色檢測腫瘤微環境中Treg細胞凋亡
用PBS調整Treg細胞濃度為1×107個×mL-1,取適量細胞滴于多聚賴氨酸處理的粘附載玻片上。滴加適量4%多聚甲醛,固定1 h,漂洗并晾干。滴加適量0.1%TritonX-100冰上破膜2 min,漂洗。滴加適量TUNEL混合溶液,37℃避光孵育1 h,PBS漂洗。加入免疫染色封閉液,室溫封閉30 min,PBS洗滌。加入山羊抗小鼠Foxp3一抗(1:200稀釋),4℃過夜孵育,PBS洗滌,加入驢抗山羊(Alexafluor488)二抗(1:200稀釋),室溫避光孵育1 h,PBS洗滌。滴加適量DAPI,室溫避光孵育10 min,PBS漂洗,晾干。加入抗熒光猝滅劑并蓋上蓋玻片,熒光顯微鏡檢測結果。
2.8 Western Blot檢測小鼠腫瘤微環境中Treg細胞中的PI3K、AKT蛋白表達
收集Treg細胞,預冷PBS洗滌2次后,RIPA裂解液重懸細胞,劇烈震蕩30 S,冰上靜置4 min,循環5次,4℃10 000 g離心5 min,取上清進行BCA蛋白定量。蛋白變性煮沸,各組取50 μg蛋白,于8%SDS-PAGE分離后,濕轉至PVDF膜上,室溫封閉1 h,與一抗(1:1000稀釋)結合,4℃搖床過夜。TBST清洗3次(避光),加入二抗(1:10 000稀釋)室溫避光孵育60 min。TBST清洗4次(避光)。Odyssey CLX紅外線發光儀中成像,Image J軟件對圖像進行灰度分析。
2.9 統計分析
采用SPSS17.0統計軟件進行統計學分析,實驗結果計量資料均采用(±SD)表示,判斷標準以P<0.05為差異有統計學意義。
3 結果
3.1 對小鼠腫瘤生長的影響
與陰性對照組比較,實驗結果顯示西黃丸中、高劑量組瘤重明顯下降,差異具有統計學意義(*P<0.05),見表1。
3.2 對小鼠腫瘤微環境中Treg細胞數量的影響
與陰性對照組比較,FACS實驗結果顯示腫瘤微環境中Treg細胞數量隨西黃丸劑量的升高而降低(西黃丸低劑量組、西黃丸中劑量組、西黃丸高劑量組VS.陰性對照組:0.160±0.023、0.113±0.036、0.055±0.019 VS.0.197±0.033),差異具有統計學意義(*P<0.05)(n=6),見圖1。
表1 西黃丸對荷瘤小鼠腫瘤生長的影響(±SD,n=10)
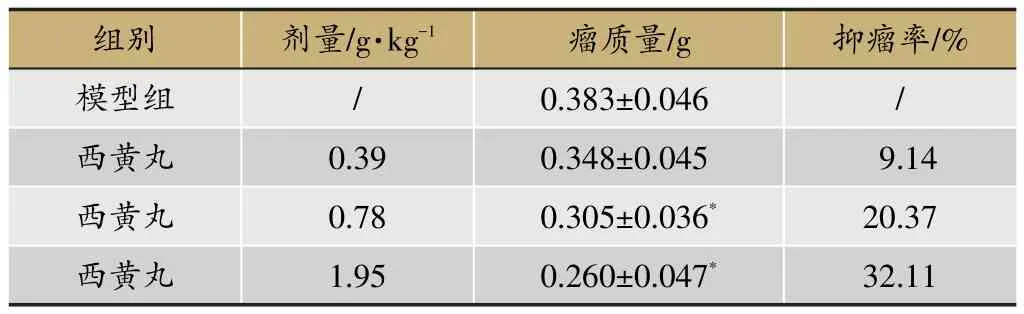
表1 西黃丸對荷瘤小鼠腫瘤生長的影響(±SD,n=10)
注:與模型組比較*P<0.05(下同)。
3.3 Treg細胞鑒定
我們通過磁珠分選得到Treg細胞,且因Foxp3是特異性表達在Treg細胞上的一類轉錄因子,所以Foxp3抗體免疫熒光染色陽性可進一步鑒定磁珠分選出的細胞為Treg細胞。DAPI染色細胞核,Foxp3+特異性染色Treg細胞,通過Merge發現磁珠分選后Treg細胞染色陽性率為可用于后續實驗,詳見圖2。
3.4 對腫瘤微環境中Treg細胞凋亡的影響
與陰性對照組比較,TUNEL結果顯示腫瘤微環境中Treg細胞凋亡量隨西黃丸劑量的增加而增加(西黃丸低劑量組、西黃丸中劑量組、西黃丸高劑量組VS.陰性對照組:699.667±66.464、985.167±126.804、1 609.333±144.882 VS.336.667±34.436),差異具有統計學意義(*P<0.05)(n=6),詳見圖3。
3.5 對腫瘤微環境中Treg細胞PI3K、AKT蛋白表達的影響
與陰性對照組比較,Western Blot結果顯示腫瘤微環境中Treg細胞PI3K、AKT蛋白表達隨西黃丸劑量的增加而降低(PI3K:西黃丸低劑量組、西黃丸中劑量組、西黃丸高劑量組VS.陰性對照組:0.669±0.086、0.492±0.072、0.276±0.061 VS.0.760±0.073;AKT:西黃丸低劑量組、西黃丸中劑量組、西黃丸高劑量組VS.陰性對照組:0.707±0.069、0.495±0.077、0.345±0.058 VS.0.924±0.082),差異具有統計學意義(*P<0.05)(n=6),詳見圖4。
4 討論

圖1 FACS檢測西黃丸對腫瘤微環境中Treg細胞的影響
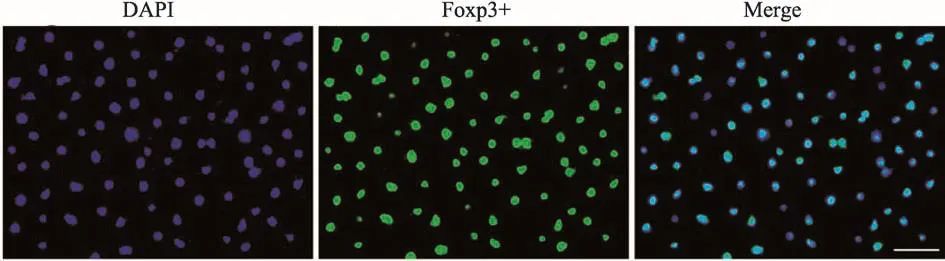
圖2 藍色:DAPI為細胞核;綠色:Foxp3+細胞;藍綠色:Merge標尺:20 μm
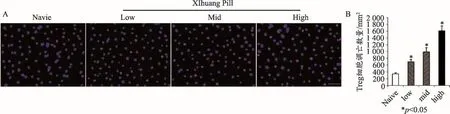
圖3 TUNEL檢測腫瘤微環境中Treg細胞凋亡標尺:20 μm
有研究表明,Treg細胞數量的增多可促進腫瘤免疫抑制微環境的形成,從而促進腫瘤的生長[14-16]。本課題組前期實驗已證實,西黃丸可抑制小鼠乳腺癌腫瘤生長,且能降低脾臟中Treg細胞水平,提高機體免疫功能[7]。本實驗結果顯示,4T1荷瘤小鼠經西黃丸治療后腫瘤生長被抑制,且抑瘤率與藥物劑量呈正相關;隨后進一步通過流式細胞術檢測,結果顯示腫瘤微環境中Treg細胞隨藥量的增加而減少;此外TUNEL實驗結果顯示腫瘤微環境中Treg細胞凋亡數量隨藥量增加而增加。上述結果說明西黃丸抑制了腫瘤微環境中Treg細胞增殖,促進其凋亡,改善腫瘤微環境免疫抑制狀態,逆轉免疫逃逸,從而抑制了腫瘤生長。
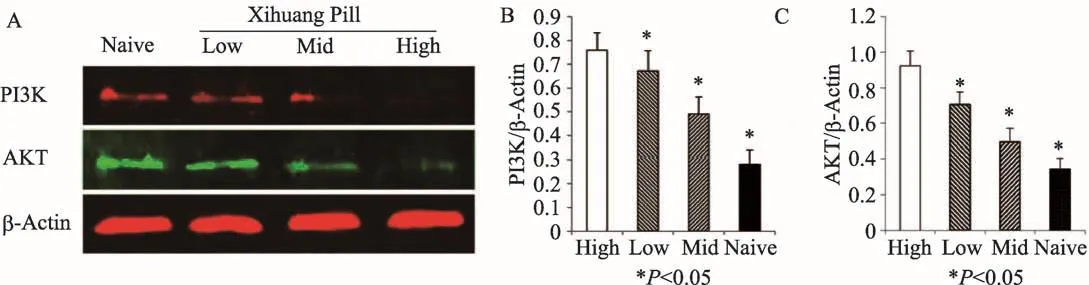
圖4 Western Blot檢測腫瘤微環境中Treg細胞中的PI3K、AKT蛋白表達
細胞凋亡的產生受相關信號通路的影響,有研究表明,抑制PI3K/AKT信號通路的表達可抑制腫瘤細胞增殖,促進其凋亡[17,18]。PI3K/Akt通路廣泛存在于細胞中[19],PI3K被激活后可使下游蛋白AKT活化,活化后的AKT移動到細胞質與細胞核上,作用于不同的靶蛋白,從而促進細胞的存活、生長與繁殖[20]。有研究表明,乳腺癌細胞凋亡量的增加與PI3K、AKT表達降低有關[21]。為了闡明藥物是通過調節相關信號通路來減少腫瘤微環境中Treg細胞的數量,在前期,本實驗室通過基因高通量篩查發現PI3K/AKT通路在藥物干預后顯著下調,因此本實驗檢測了腫瘤微環境中Treg細胞PI3K、AKT蛋白表達情況。結果顯示,西黃丸治療后使其腫瘤微環境中Treg細胞PI3K、AKT蛋白表達降低,這說明腫瘤微環境中Treg細胞減少的機制與Treg細胞PI3K、AKT蛋白表達降低有關,進而闡明了西黃丸這一經典名方的抗腫瘤作用機制。
1 關碩,楊偉,胡俊霞,等.西黃丸氯仿提取物對荷瘤大鼠免疫清除功能的影響.中國現代應用藥學,2014,31(2):144-148.
2 徐秋萍,胡文靜,劉寶瑞.西黃丸抗腫瘤作用的研究現狀.癌癥進展,2016,14(01):32-35.
3 D'Egidio V,Sestili C,Mancino M,et al.Counseling interventions delivered in women with breast cancer to improve health-related quality of life:a systematic review.Quality of Life Research,2017(2):1-20.
4 劉濤,張清媛.乳腺癌免疫治療研究進展.中國普通外科雜志,2013,20(11):259-260.
5 陳雪曼,宋爾衛.腫瘤微環境與免疫治療研究進展.生物化學與生物物理進展,2017,44(08):641-648.
6 Spano D,Zollo M.Tumor microenvironment:a main actor in the metastasis process.Clinical&Experimental Metastasis,2012,29(4):381-395.
7 王一堯,任征遠,焦戰,等.西黃丸對腫瘤遷移微環境的影響.中藥藥理與臨床,2014(4):11-13.
8 郜明,吳家明,陸茵.腫瘤微環境與腫瘤的惡變.癌變.畸變.突變,2008,20(5):412-414.
9 黃波.腫瘤微環境中免疫與炎癥的調節.中國腫瘤生物治療雜志,2012,19(2):111-115.
10徐林,蔣正剛,李寶華,等.小鼠乳腺癌實驗動物模型中CD4+CD25+調節性T細胞的變化及意義.復旦學報(醫學版),2006,33(6):736-740.
11 Wolf A M,Wolf D,Steurer M,et al.Increase of regulatory T cells in the peripheral blood of cancer patients.Clinical Cancer Research An Official Journal of the American Association for Cancer Research,2003,9(2):606.
12王俊,羅英,顏秉菊.CD4+CD25+調節性T細胞在不同肝臟腫瘤中的表達及意義.天津醫藥,2012,40(4):337-339.
13蔡雙龍,陳曉耕.Treg細胞與乳腺癌的研究進展.現代腫瘤醫學,2014,22(4):924-928.
14 Whiteside T L.What are regulatory T cells(Treg)regulating in cancer and why?.Seminars in Cancer Biology,2012,22(4):327.
15 Whiteside T L.Clinical Impact of Regulatory T cells(Treg)in Cancer and HIV.Cancer Microenvironment Official Journal of the International Cancer Microenvironment Society,2015,8(3):201.
16 Whiteside T L.Regulatory T cell subsets in human cancer:are they regulating for or against tumor progression?.Cancer Immunol Immunother,2014,63(1):67-72.
17 Fresno Vara J A,Casado E,De C J,et al.PI3K/Akt signalling pathway and cancer.Cancer Treatment Reviews,2004,30(2):193-204.
18 Nicholson K M,Anderson N G.The protein kinase B/Akt signalling pathway in human malignancy.Cellular Signalling,2002,14(5):381-395.
19趙璐,冮巖,林勝國,等.土槿皮乙酸通過PI3K/Akt信號通路誘導人腎癌細胞A498凋亡.生物技術通訊,2016,27(4):512-515.
20閻婷婷,李里,姜秋穎.PI3K-Akt信號通路與乳腺癌關系的研究進展.癌癥進展,2012,10(1):41-46.
21王建杰,董航,王茉琳,等.丹皮酚對人MCF-7乳腺癌細胞PI3K/Akt mRNA表達的影響.中國老年學,2014,34(20):5809-5811.

