基于中醫理論及臨床驗證基礎上的射干作用機制研究*
王光函,孫小玲,鄒桂欣,尤獻民,辛旭陽,劉 晶,李國信**
(1.遼寧省中醫藥研究院 沈陽 110034;2.遼寧省藥品檢驗檢測院 沈陽 110023)
射干,始載于《神農本草經》[1],其味苦、辛,性寒,微毒,歸肺、肝經。具有祛痰利咽、消癖散結、清熱解毒、消腫止痛的功效,臨床常用于治療感受風熱或痰熱壅盛引起的咽喉腫痛、痰涎壅盛,及咳嗽氣喘等癥,是中醫治療喉痹咽痛之要藥。綜合分析古典醫籍及現代文獻[2-6],確定射干臨床上用于治療發熱、惡寒、咳嗽、咯痰、口渴、胸痛或悶、氣短等癥狀,癥常見于急性氣管-支氣管炎、感染后咳嗽(PIC)、慢性阻塞性肺疾病急性加重、支氣管哮喘合并感染等氣道感染性疾病。
呼吸道合胞病毒(RSV)屬副粘液病毒科,肺炎病毒屬,是PIC發病及感染的重要感染病原之一,也是醫院交叉感染的主要病原。現代醫學[7]認為病毒感染導致了氣道變應性炎癥、氣道上皮損傷、氣道高反應等。本研究基于射干臨床病種篩選試驗結果,確定了感染后咳嗽為射干臨床治療病種后,擬采用RSV感染豚鼠咳嗽模型[8],通過對感染后豚鼠肺組織形態學影響,肺泡灌洗液中白細胞總數及分類計數變化,細胞因子白介素-4(IL-4)、干擾素-γ(IFN-γ)、白三烯-4(LTC4)表達影響,來研究射干提取物對RSV感染后咳嗽模型抗炎作用。
1 材料
1.1 動物與細胞
雄性純白SPF級豚鼠30只,250-300 g(北京實驗動物中心);呼吸道合胞病毒(武漢病毒研究所贈予);Hep-2細胞(江蘇齊氏生物科技有限公司)。
1.2 藥物與儀器
射干提取物(實驗室自制);DMEM高糖培養基、胎牛血清(CORNING);胰酶(碧云天生物技術有限公司);枸櫞酸(沈陽市試劑一廠);IFN-γ、IL-4、LTC4 ELISA試劑盒(南京建成生物工程研究所有限公司);ELX800型酶標儀(BioTek,美國);石蠟切片機(萊卡);BX53顯微鏡(奧林巴斯)。
2 方法
2.1 射干提取物的制備
射干藥材1 kg,加70%乙醇提取2次,合并提取液,濃縮至無醇味,用乙醇調整至含醇量為30%,上于D101大孔吸附柱上,用3倍量30%乙醇除雜,繼用80%乙醇洗脫,收集洗脫液,干燥至干,即得(每1 g提取物含20.7 g射干藥材)。
2.2 Hep-2細胞培養、RSV擴增及組織培養半數感染量(TCID50)的測定
Hep-2細胞使用DMEM培養液(含有10%胎牛血清,100 U·mL-1青霉素,100 g·L-1鏈霉素),37℃,5%CO2培養箱中常規培養。生長狀態良好的細胞每2-3天傳代。
Hep-2細胞在培養瓶中長至70-80%融合,吸出培養液,PBS洗2次,加入1 mL無血清培養液,取病毒懸液100μL接種于細胞上,每15 min搖動1次,吸附2 h后倒出病毒液,加入含5%胎牛血清培養液,于第2-3天開始出現細胞病變(CPE),待病變達60-70%時收獲病毒,將細胞反復凍融2-3次后,1 000 r·min-1,離心5 min,去除細胞碎片,收集上清分裝后,-80℃保存。
取對數生長期Hep-2細胞接種96孔板(1×104cells/well),5%CO2、37℃培養箱培養24 h,細胞貼壁并形成均勻單層時吸棄培養液。梯度稀釋病毒至10-3-10-(8病毒液用維持液10倍系列稀釋)6個梯度,每孔加100 μL,每列一個稀釋度,共6列。其余6列加入培養液,作空白對照。37℃、5%CO2吸附2 h,吸棄病毒液,每孔加維持液100 μL,置培養箱中繼續培養,逐日觀察病變程度并記錄。以最高稀釋度不再出現新病變時為終點,結果只記錄最后一天病變情況即可。用Reed-Muench公式計算病毒半數細胞感染量(TCID50)。本次實驗病毒半數細胞感染量(TCID50)為7×105TCID50。
2.3 RSV感染豚鼠模型的制備及分組
健康豚鼠,常規飼養,一周后開始正式試驗。試驗分空白組,RSV感染模型組、射干提取物給藥組(600 mg·kg-1·日-1),每組10只。
RSV感染模型制備:除空白組外,將其余各組豚鼠放入自制450 mm×450 mm×900 mm熏籠中,每5只一籠,以鋸末50 g+10支香煙點燃煙熏,每次30 min,每日1次,連續10天,自由進食吸水,從第5天開始將豚鼠乙醚淺麻后鼻腔滴注100TCID50的RSV懸液100μL(每天滴鼻2次,早晚各1次,空白組給予相同劑量的5%DMEM培養液),連續給藥1周。滴入量以體重1μL·g-1計算。給藥組自第5天開始給藥。
2.4 射干提取物對實驗動物鎮咳作用的觀察
于末次給藥45 min時,將動物置于5 L大燒杯中,底部加少量墊料,燒杯口用保鮮膜封,以4.5 mol·L-1枸櫞酸溶液霧化吸入激發,每次30 s,觀察5 min內豚鼠咳嗽次數。
2.5 肺泡灌洗收集
將豚鼠用2%戊巴比妥(25 mg·kg-1)麻醉后仰臥固定于操作臺,打開胸腔,暴露氣管和雙肺,結扎右主支氣管,在隆突上用套管針穿刺至左肺,氣管上段剪開插入灌流管,將預溫至37℃的生理鹽水經氣管插管注入肺內,每次灌入2-3 mL,停留30 s,回吸液體,反復3次,灌洗液回收率為70-85%。2 000 r·min-1,4℃離心10 min,上清液分裝保存于-20℃冰箱,備用。細胞沉淀用磷酸鹽緩沖液(PBS)溶解,在全自動模塊式血液體液分析儀上測定白細胞總數、淋巴細胞計數、單核細胞計數及中性粒細胞計數。
2.6 ELISA法測定肺泡灌洗液中IL-4、IFN-γ、LTC4的含量
按照試劑盒要求測定各組豚鼠支氣管肺泡灌洗液中IL-4、IFN-γ、LTC4的含量。
2.7 對肺組織形態學影響
結扎右主支氣管,采用4%多聚甲醛固定右肺中葉,常規蘇木素-伊紅(HE)染色,光鏡觀察肺組織形態結構。
2.8 統計學處理
數據處理采用SPSS18.0統計軟件,結果Xˉ±S表示,采用單因素方差分析,P<0.05表示有顯著性差異,P<0.01有極顯著差異。
3 結果
3.1 射干提取物對實驗動物鎮咳作用的觀察
模型組5 min內咳嗽次數顯著高于空白組,提示造模成功;而咳嗽潛伏期無顯著差異。給藥組中,射干提取物對模型動物5 min內咳嗽有顯著抑制作用。結果見表1。
表1 射干提取物對枸櫞酸引起咳嗽的影響結果(ˉ±S,n=10)
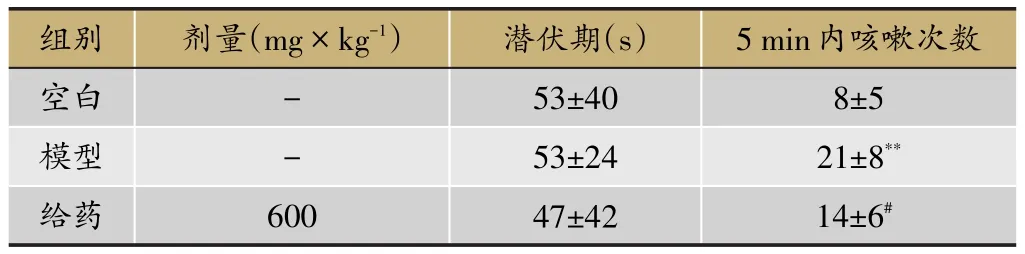
表1 射干提取物對枸櫞酸引起咳嗽的影響結果(ˉ±S,n=10)
注:與空白組比較,**P<0.01;與模型組比較,#P<0.05。
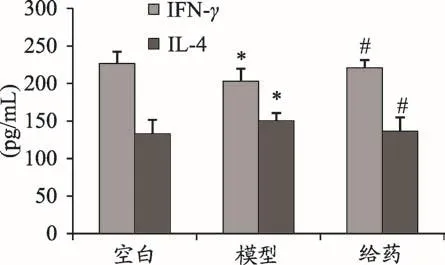
圖1 射干提取物對RSV感染豚鼠BALF中IL-4、IFN-γ表達的影響
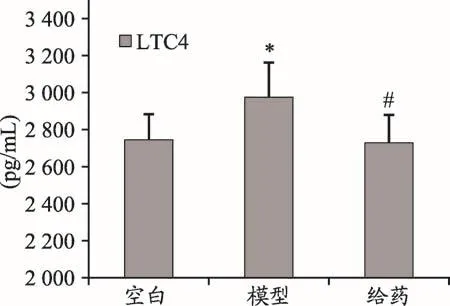
圖2 射干提取物對RSV感染豚鼠肺泡灌洗液中LTC4表達的影響
3.2 射干提取物對RSV感染豚鼠BALF中細胞學的改變
模型BALF中白細胞總數、淋巴細胞、單核細胞和中性粒細胞明顯高于空白組(P<0.05),說明模型建立成功。給藥組與模型組相比,BALF中白細胞總數、淋巴細胞、單核細胞和中性粒細胞顯著降低(P<0.05)。見表2。
3.3 射干提取物對RSV感染豚鼠BALF中IL-4、IFN-γ含量及比例的變化
RSV感染豚鼠后,模型組中IL-4水平明顯高于空白組(P<0.05),而IFN-γ水平明顯低于空白組(P<0.05)。給藥后,豚鼠BALF中IL-4水平明顯降低(P<0.05),IFN-γ水平明顯增高(P<0.05)結果見圖1、表3。
3.4 射干提取物對RSV感染豚鼠BALF中LTC4表達的影響
RSV感染豚鼠后,模型組中LTC4水平明顯高于空白組(P<0.05),給藥后LTC4水平明顯低于模型組(P<0.05)。結果見圖2、表3。
3.5 射干提取物對RSV感染豚鼠肺組織形態的影響
RSV感染豚鼠后,模型組與空白組相比,可見肺泡壁增厚,有炎性細胞出現,形態變形,并有充血。給藥組所有癥狀均有減輕。
4 討論
《普濟方》數據庫管理系統[9]可以對任何一味中藥進行跨病種檢索,檢索結果可得此藥復方配伍用于所有病證的構成、各病證配伍此藥頻數。基于《普濟方》數據庫古方配伍應用考證結果表明,含射干復方所治疾病以喉痹咽痛、咳嗽、咳喘、咽干、痰熱壅盛諸病與2015年版《藥典》[10]一部所記功能主治完全吻合。現代文獻學研究表明,射干具有抗炎、抗病毒、抗菌、抗氧化等藥理作用。結合傳統中醫藥理論研究結果,考慮急性氣管-支氣管炎(風邪犯肺證)及感染后咳嗽(余熱未清證)在炎性表現方面一急一慢,發病方面風熱犯肺表現在前期,后期入里化熱、余熱未清,頗具代表性,故選擇此二證為射干臨床應用試驗病征。前期臨床研究結果表明:射干清咳片組與對照組(肺寧片組)治療后比較雖然沒有統計學意義,但從日間、夜間咳嗽、咯痰、痰量評分數值變化可看出,射干清咳片改善明顯,證明其治療感染后咳嗽及急性氣管-支氣管炎臨床療效確切。
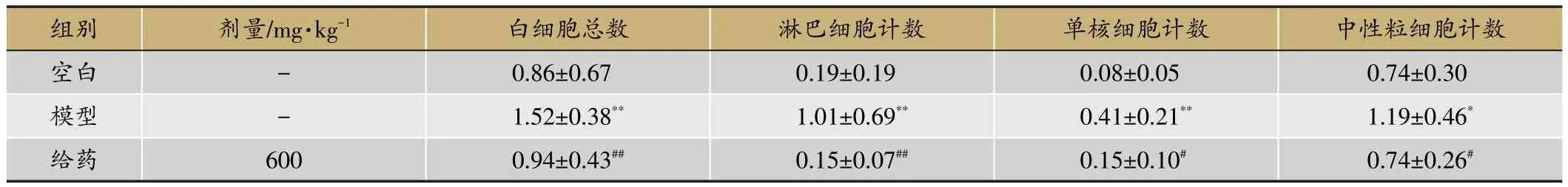
表2 射干提取物對RSV感染豚鼠肺泡灌洗液中細胞學的影響
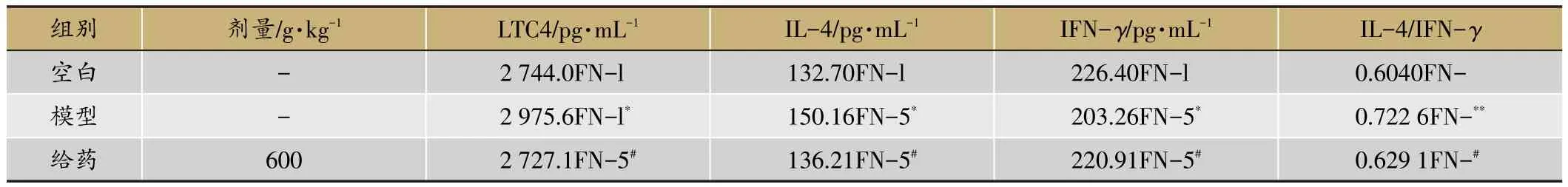
表3 射干提取物對RSV感染豚鼠BALF中LTC4、IL-4、IFN-γ表達的影響
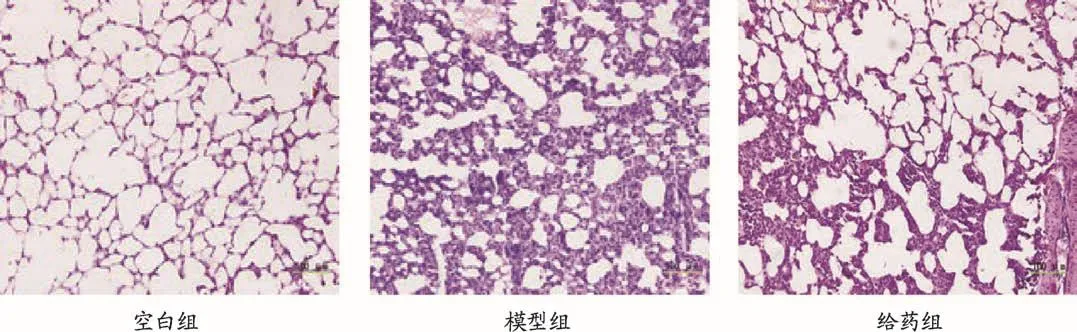
圖3 射干提取物對RSV感染豚鼠肺組織病理切片圖
根據臨床兩個證型的試驗結論,結合感染后咳嗽在患病人群中更為常見,患者量較大,患者長期咳嗽不愈,易給患者造成很大心理負擔,精神上形成緊張,嚴重影響患者生活質量,反復檢查易造成醫療成本過大,且從疾病角度出發感染后咳嗽在臨床上沒有更為有效的治療手段,而急性氣管-支氣管炎目前臨床治療藥品頗為豐富如:抗感解毒沖劑、止咳平喘的川貝批把膏等,所以我們首先選擇了感染后咳嗽作為射干作用機制研究的動物模型。
感冒后咳嗽絕大部分由呼吸道病毒感染后引起,又稱為感染后咳嗽,目前有關感染后咳嗽的機制知之甚少,缺乏滿意的治療[11]。感染后咳嗽雖然最終大多可以自愈,但過程中可能會嚴重影響患者的工作和生活,因此,進行病毒感染引起的咳嗽,尤其是感染后咳嗽發病機制的探討將具有重要的意義。現代醫學認為感冒后咳嗽的發病與病毒感染后所產生的變應性炎癥、氣道上皮損傷、氣道神經末梢暴露、神經源性炎癥反應及其導致的氣道高反應有關[12,13]。
呼吸道變應性炎癥產生與Th1/Th2類細胞因子失衡有關,Th1/Th2比例降低是呼吸道變應性炎癥發生主要因素,且Th2類細胞因子優勢表達是其形成及進展的關鍵機制[14]。Th1細胞分泌的細胞因子IFN-γ及Th2細胞分泌的細胞因子IL-4與呼吸道變應性炎性反應關系密切,IFN-γ能促進細胞表達MHC-Ⅰ類和MHC-Ⅱ類分子,并抑制Th2細胞的增殖;直接通過氣道給予IFN-γ,可抑制抗原激發小鼠特應性氣道炎癥。白三烯(LTS)是花生四稀酸(Aracliidonic Acid,AA)經5-脂氧酶途徑合成代謝產生并具有多種生物活性的脂肪酸,包括LTB4和LTC4等,LTS是引起和加重氣道炎癥的重要炎癥介質,從而導致氣道上皮損傷,使咳嗽感受器暴露過多,引起咳嗽敏感性增高[15]。因此對肺泡灌洗液中的IL-4、IFN-γ及LTC4進行測定。
實驗結果表明,采用RSV感染豚鼠模型,BALF細胞學及肺組織病理學檢查支持氣道炎癥改變,表明感染后咳嗽模型成功。射干提取物給藥組能減少豚鼠咳嗽次數,降低BALF中IL-4含量,升高IFN-γ含量,使IL-4/IFN-γ的比值降低,調節Th1/Th2免疫失衡;并且射干提取物能降低BALF中LTC4水平,顯著減少炎性細胞數量,抑制炎性細胞浸潤,說明射干提取物可能通過調節Th1/Th2平衡、抑制LTC4表達而抑制炎性介質的釋放和聚集,從而減輕氣道炎癥。
1 王子壽,薛紅.神農本草經.成都:四川科學技術出版社,2008:143.
2 李時珍.本草綱目.北京:人民衛生出版社,2004:127-128.
3 蘭茂.滇南本草.昆明:云南科技出版社,2004:79.
4 劉艷偉.臨床應用射干麻黃湯治療支氣管哮喘效果的隨機平行對照研究.中國醫藥指南,2016,14(7):217-218.
5 何雯,李檬,張瑛.中西醫結合治療小兒急性化膿性扁桃體炎38例.中醫兒科雜志,2009,5(1):29-30.
6 石磊,姬志強,康文藝.射干抗病毒注射液的臨床應用.中國藥房,2012,23(35):3359-3360.
7 You D,Marr N,Saravia J,et al.IL-4Rαon CD4+T cells plays a pathogenic role in respiratory syncytial virus reinfection in mice infected initially as neonates.J Leukoc Biol,2013,93(6):933-942.
8 葉新民,鐘南山,劉春麗,等.呼吸道合胞病毒感染對豚鼠咳嗽相關氣道功能及其神經遞質的影響.中華哮喘雜志,2011,5(3):182-187.
9 梁茂新,黃會生.《普濟方》數據庫管理系統(軟著登字第0002781號).北京:中華人民共和國版權局,1998.
10國家藥典委員會.中華人民共和國藥典.北京:中國醫藥科技出版社,2015:285.
11 Yang M,Kumar R K,Foster P S.Interferon-gamma and pulmonary macrophages contribute to the mechanisms underlying prolonged airway hyperresponsiveness.Clin Exp Allergy,2010,40(1):163-173.
12 Estripeaut D,Torres J P,Somers C S,et al.Respiratory syncytial virus persistence in the lungs correlates with airway hyperreactivity in the mouse model.J Infect Dis,2008,198(10):1435-1443.
13 Dicpinigaitis P V,Gayle Y E,Solomon G,et al.Inhibition of coughreflex sensitivity by benzonatate and guaifenesin in acute viral cough.Resp Med,2009,103(6):902-906.
14 Dicpinigaitis PV,Spinner L,Santhyadka G,et al.Effect of tiotropium on cough reflex sensitivity in acute viral cough.Lung,2008,186(6):369-374.
15葉新民,鐘南山,劉春麗,等.副流感病毒感染豚鼠咳嗽反射敏感性變化及其神經源性炎癥機制探討.中國病理生理雜志,2011,27(1):1-8.

