富氫鹽水對腎臟缺血再灌注損傷的保護作用機制
部 璇,王建軍,白 靜,程愛斌
(河北理工大學附屬醫院重癥醫學科,河北唐山 063000)
腎臟缺血再灌注損傷(ischemia-reperfusion,IR)是腎移植后較為嚴重的不可避免的并發癥,對移植后的腎臟是否能夠存活起到重要作用。引起腎臟IR的機制較為復雜,已有研究顯示,活性氧(reactive oxygen species,ROS)的生成及炎癥介質的釋放在腎臟IR中發揮重要作用[1-2]。增多的氧自由基可以進一步引起細胞內的損傷,包括DNA損傷、蛋白質氧化和硝基化、脂質過氧化及細胞凋亡等[3]。氫氣是一種惰性氣體,具有明確的抗氧化和清除自由基的作用。研究顯示,富氫溶液能夠有效減輕經冷凍保存后進行移植腎臟的IR損傷。但是,相應的作用機制尚不完全明確。因此,本研究利用小鼠模型,探討富氫鹽水(hydrogen-rich water,HRS)對小鼠腎臟IR損傷中氧化及細胞凋亡相關蛋白的影響,闡明HRS減輕腎臟IR損傷機制。
1 材料與方法
1.1實驗動物 雄性ICR小鼠80只,SPF級,體質量25~30 g,合格證號SCXK(京)2012-0001,購自北京華阜康實驗動物有限公司。
1.2儀器與試劑 生理鹽水購自華潤雙鶴藥業股份有限公司;血生化檢測試劑盒購自成都斯瑪特科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)測定試劑盒、丙二醛(malondialdehyde,MDA)檢測試劑盒購自南京建成生物工程研究所;二辛可寧酸(Bicinchoninic,BCA)蛋白濃度檢測試劑盒購自碧云天生物技術有限公司;哺乳動物組織總蛋白提取試劑購自武漢博士德生物工程有限公司;Bcl2,Bcl-xl,Bax,Bak,Cleaved Caspase-3抗體購自美國Cell Signaling Technology(CST)公司;β-actin、抗兔辣根過氧化物酶抗體、抗鼠辣根過氧化物酶抗體購自美國Abcam公司。富氫水杯購自廣州康旺電子科技有限公司;便攜式獸用生化檢測儀購自普朗醫療設備有限公司;可見光分光光度計購自上海精密科學儀器有限公司;凝膠成像系統購自美國BioRad公司。
1.3方法
1.3.1HRS制備 向富氫水杯內加入200 mL生理鹽水,按照廠家的操作步驟進行HRS的制備,每次使用時制備新的HRS。
1.3.2實驗分組及模型制備 實驗分為3組:對照(假手術)組,IR組,IR+HRS組,每組6只小鼠。IR+HRS組小鼠于手術前3 d及再灌注前1 min尾靜脈注射0.2 mL HRS,再灌注后的2 h內每隔0.5 h注射1次HRS。對照組和IR組小鼠尾靜脈注射相同體積的生理鹽水。小鼠用3.5%水合氯醛溶液進行麻醉,腹部備皮仰臥于手術臺上,對照組小鼠暴露腎臟并游離雙側腎蒂,但是不夾閉腎蒂。IR組和IR+HRS組用無損傷血管夾夾閉,45 min后松開恢復腎臟血流,肉眼觀察腎臟顏色確認腎臟再灌注是否成功,逐層關閉小鼠腹腔。
1.3.3血清肌酐(SCr)和尿素氮(BUN)檢測 IR后24 h摘小鼠眼球取血,3 000 r/min離心10 min后取上清液即為小鼠血清。取100 μL血清加入血生化檢測試劑盤內,生化分析儀檢測SCr和BUN水平。
1.3.4腎組織SOD和MDA檢測 IR后24 h獲取小鼠腎臟,稱取1 g腎組織剪碎后放到玻璃勻漿器內,按照組織質量(g)∶體積(mL)=1∶10的比例加入預冷的生理鹽水,使用玻璃勻漿器勻漿,勻漿后的組織懸液以3 000 r/min離心10 min后取上清液,BCA蛋白檢測試劑盒檢測蛋白濃度,按照試劑盒的操作步驟進行SOD及MDA檢測。
1.3.5腎組織凋亡相關蛋白檢測 IR后24 h獲取小鼠腎臟,稱取1 g腎組織剪碎后放到玻璃勻漿器內,加入預冷的含1%蛋白酶抑制劑的哺乳動物組織總蛋白提取液,研磨組織后冰上裂解1.5 h,以12 000 r/min離心10 min后取上清液即為蛋白提取物。BCA法檢測蛋白濃度,加入上樣緩沖液后沸水煮蛋白8 min使蛋白變性。使用聚丙烯酰胺凝膠電泳,每孔上樣量為20 μg,電壓150 V,時間1.5 h。使用聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜轉膜。轉膜完成后使用5% BSA室溫封閉1 h,將膜放入兔抗Bcl2(1∶1 000)抗體,兔抗Bcl-xl(1∶1 000) 抗體,兔抗Bax(1∶1 000) 抗體,兔抗Bak(1∶1 000) 抗體,兔抗Cleaved Caspase-3(1∶1 000) 抗體,鼠抗β-actin(1∶10 000)抗體液中進行孵育,孵育條件為4 ℃過夜。用TBST沖洗3次后,加入辣根過氧化物酶標記的抗鼠和抗兔抗體,室溫孵育1 h后,使用凝膠成像系統對蛋白條帶進行分析。統計結果以目的蛋白的灰度值與β-actin蛋白的灰度值的比值代表相對蛋白表達水平。
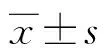
2 結 果
2.1HRS處理降低小鼠血清SCr和BUN水平的影響 與對照組比較,IR后24 h小鼠血清SCr和BUN顯著升高,HRS處理后IR小鼠血清SCr和BUN明顯下降,差異具有統計學意義(P<0.05),見表1。
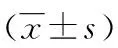
表1 HRS對小鼠血清SCr、BUN水平的影響
△:P<0.01,與對照組比較;*:P<0.01,與IR組比較
2.2HRS處理提高腎組織SOD酶活性同時降低MDA水平影響 與對照組比較,IR后24 h小鼠腎組織SOD酶活性顯著下降,MDA水平明顯增加,HRS預處理能夠提高IR小鼠腎組織SOD活性并降低腎組織內的MDA水平,差異具有統計學意義(P<0.05),見表2。
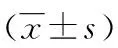
表2 HRS對小鼠腎臟SOD及MDA水平的影響
△:P<0.01,與對照組比較;*:P<0.01,與IR組比較
2.3HRS處理改變凋亡相關蛋白的表達 與對照組比較,I/R組抗凋亡蛋白Bcl2和Bcl-xl在IR后24 h表達下調,促凋亡蛋白Bax,Bak,Cleaved Caspase-3表達上調,HRS預處理能夠上調IR后小鼠腎組織抗凋亡蛋白表達,下調促凋亡蛋白表達,結果差異具有統計學意義(P<0.05),見圖1。

##:P<0.01,與對照組比較;*:P<0.05,**:P<0.01,與IR組比較
圖1 HRS對凋亡相關蛋白表達的影響
3 討 論
2007年日本OHSAWA等[4]報道氫氣能夠通過選擇性清除羥自由基降低腦組織的IR,直接證實氫氣作為抗氧化劑具有治療作用[4]。隨后,關于氫氣治療組織IR的研究越來越多,研究顯示,吸入氫氣或飲用富氫水能夠減輕大鼠或小鼠大腦、肝臟、腎臟、卵巢、肌肉、小腸等組織器官的IR[3,4-9]。據報道,將待移植的大鼠腎臟放入預冷的富氫溶液中保存24~48 h后,移植腎臟的功能和移植受體存活率得到極大的提高,其作用機制主要是減少腎小管上皮細胞的炎性反應和凋亡[1,8],但是相關的信號通路變化并沒有得到深入研究。曾葵等[9]研究顯示,對大鼠IR模型在再灌注前10 min和再灌注后120 min持續進行吸入氫氣處理,能夠有效減輕大鼠腎臟損傷,但是作用機制也沒有深入研究[9]。因此,本研究以小鼠腎臟IR模型為研究對象,觀察靜脈注射HRS對小鼠IR后腎臟功能、腎臟SOD、MDA水平以及凋亡相關的信號通路影響,闡明HRS減輕腎臟IR損傷的作用機制。
CUI等[5]研究顯示,靜脈注射HRS 1 min后,腎臟氫氣濃度達到峰值,因此本研究選擇在腎臟IR前1 min靜脈注射HRS,IR后的2 h內每0.5小時注射1次HRS。結果顯示,HRS預處理能夠有效降低血清SCr和BUN水平,減輕腎功能損傷,這項結果與之前研究一致[9]。MDA是脂質過氧化反應中的中間產物,反映組織受氧自由基損傷的程度;SOD是體內超氧自由基的清除因子,SOD水平的高低決定組織清除自由基的能力[10]。本結果顯示,HRS處理能夠有效減輕MDA的產生,提高SOD酶活性,進而提高IR后腎組織抗氧化能力。
在細胞凋亡的過程中,Bcl2家族成員發揮著重要的作用。Bcl2家族可以分為兩大類,一類為抗凋亡蛋白包括Bcl2,Bcl-xl等蛋白,一類為促凋亡蛋白包括Bak,Bax等蛋白。而Caspase-3是凋亡級聯反應中最關鍵的凋亡蛋白酶,當收到上游凋亡信號后,Caspase-3被活化變成Cleaved Caspase-3,啟動凋亡的發生過程[11-12]。本研究結果顯示,腎臟IR后24 h Bcl2,Bcl-xl蛋白表達水平下調,Bak,Bax和Cleaved Caspase-3蛋白表達上調。HRS處理后能明顯上調Bcl2,Bcl-xl蛋白表達,下調Bak,Bax和Cleaved Caspase-3蛋白表達。
綜上所述,本研究結果顯示,靜脈注射HRS能夠減輕小鼠腎臟IR損傷,其作用機制可能是通過降低組織內的ROS水平,增加組織抗氧化能力,并且通過調節Bcl2家族成員蛋白及Caspase-3蛋白降低腎臟組織細胞凋亡。氫氣作為一種無毒無害的具有抗氧化能力的氣體,在臨床上有巨大的應用前景。關于氫氣對腎臟IR后炎癥細胞因子的影響在本研究中并沒有闡明,這項研究值得在以后的工作中深入開展。
[1]ESPOSITO E,MONDELLO S,DI PAOLA R A,et al.Glutamine contributes to ameliorate inflammation after renal ischemia/reperfusion injury in rats[J].Naunyn Schmiedebergs Arch Pharmacol,2011,383(5):493-508.
[2]LIU D,SHANG H,LIU Y.Stanniocalcin-1 protects a mouse model from renal ischemia-reperfusion injury by affecting ROS-mediated multiple signaling pathways[J].2016,17(7):1051-1060.
[3]HAN L,TIAN R,YAN H,et al.Hydrogen-rich water protects against ischemic brain injury in rats by regulating calcium buffering proteins[J].Brain Res,2015,1615(7):129-138.
[4]OHSAWA I,ISHIKAWA M,TAKAHASHI K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J].Nat Med,2007,13(6):688-694.
[5]CUI J,CHEN X,ZHAI X,et al.Inhalation of water electrolysis-derived hydrogen ameliorates cerebral ischemia-reperfusion injury in rats - a possible new hydrogen resource for clinical use[J].Neuroscience,2016,335(5):232-241.
[6]HUANG T L,WANG W C,TU C,et al.Hydrogen-rich saline attenuates ischemia-reperfusion injury in skeletal muscle[J].J Surg Res,2015,194(2):471-480.
[7]SHIGETA T,SAKAMOTO S,LI X K,et al.Luminal injection of hydrogen-rich solution attenuates intestinal ischemia-reperfusion injury in rats[J].Transplantation,2015 99(3):500-507.
[8]ABE T,LI X K,YAZAWA K,et al.Hydrogen-rich University of Wisconsin solution attenuates renal cold ischemia-reperfusion injury[J].Transplantation,2012,94(1):14-21.
[9]曾葵,黃瀚,江曉琴,等.氫氣對大鼠腎臟缺血再灌注損傷的保護作用[J].四川大學學報(醫學版),2014,45(1):39-42.
[10]GHASEMI M,NEMATBAKHSH M,DANESHMAND F,et al.Role of nitric oxide in kidney and liver(as distance organ)function in bilateral renal ischemia-reperfusion:effect of L-Arginine and NG-nitro-L-Arginine methyl ester[J].Adv Biomed Res,2015,5(4):233.
[11]LIU X J,HE Y J,LI F,et al.Caspase-3 promotes genetic instability and carcinogenesis[J].Mol Cell,2015,58(2):284-296.
[12]DAI Y,JIN S G,LI X E,et al.The involvement of Bcl-2 family proteins in AKT-regulated cell survival in cisplatin resistant epithelial ovarian cancer[J].Oncotarget,2017,8(1):1354-1368.

