3種手術方式治療脾功能亢進癥的臨床對比分析
朱 婧,朱 輝,杜慧敏,陳曉品,張 濤△
(1.重慶醫科大學附屬第一醫院腫瘤科 400016;2.重慶醫科大學附屬第二醫院海扶腫瘤中心 400014)
脾功能亢進癥(簡稱脾亢)是臨床上常見的綜合征,以門靜脈高壓引起的脾亢最為常見。主要表現為脾臟腫大、一種或多種血細胞減少,并常出現皮膚黏膜出血、左上腹脹痛、乏力以及反復的感染等[1]。脾亢的傳統治療主要是對癥治療和脾切除術,但對癥治療療效有限,外科脾切除術可以消除脾亢引起的血細胞的破壞,然而,脾切除術往往伴有機體免疫功能的下降,易并發感染,并易引起原有側支循環再出血以及脾靜脈栓塞等并發癥。另外,目前的研究認為,脾臟具有抗感染與抗腫瘤的重要免疫功能。因此,保留部分脾臟成為脾亢治療的一種趨勢,微創及無創技術迅速興起。
隨著介入影像學的發展,部分性脾動脈栓塞術(partial splenic embolization,PSE)逐漸成為治療脾亢較為成熟的方式。PSE術后機體仍然維持正常的免疫和破血功能,避免了脾切除后潛在感染和高黏滯血癥的危險。此外,PSE也能夠提高患者的肝功能及預后,擴大脾亢治療的適應證,因其獨特而良好的療效,已經成為治療各種原因所致脾亢的主要方法之一[2]。但PSE并發癥較多,如繼發感染、脾膿腫、脾囊腫、發燒、疼痛等,因此,局部消融治療如射頻消融術、冷凍、微波、高強度聚焦超聲(high intensity focused ultrasound,HIFU)等用于治療脾亢越來越廣泛[3-14]。其中,最受關注的是射頻消融術,但由于脾臟組織本身的脆弱性以及肝硬化后脾臟高動力的血流學特點,在穿刺過程中和穿刺后很容易出現脾破裂出血的風險。與射頻消融相比,近年來興起的體外HIFU用于治療脾亢理論上具有更好的優勢。HIFU的治療原理是利用超聲波具有生物組織內可穿透性及能量沉積性的特點,通過超聲聚焦換能器將超聲能量聚焦于靶組織,通過超聲的熱效應使該處組織的溫度瞬間(0.5~1 s)上升至60~100 ℃,從而導致蛋白變性及組織凝固性壞死;同時通過空化、機械作用等生物學效應,殺死靶區內的腫瘤細胞。HIFU技術目前已廣泛應用肝癌、乳腺癌、子宮腫瘤等良惡性腫瘤,隨著HIFU適應證的擴大,HIFU的非腫瘤適應證得到了逐步的拓寬,如脾亢[12-14]。 因此,脾臟切除術、 PSE和HIFU分別代表著治療脾亢的傳統、成熟和最新的治療方式,本研究對比分析脾切除術、PSE和HIFU治療脾亢患者的臨床資料,現報道如下。
1 資料與方法
1.1一般資料 隨機選擇重慶醫科大學附屬第一醫院、重慶醫科大學附屬第二醫院2006年1月至2016年1月進行了外科脾臟手術切除、PSE以及HIFU治療脾亢的患者,每組20例。其中,脾臟手術切除組男13例,女7例,中位年齡49歲,患者入院時肝功能分級(Child-Pugh)A級18例,B級2例,C級0例;PSE組男14例,女6例,中位年齡52歲,患者入院時肝功能分級為A級17例,B級3例,C級0例;HIFU組男12例,女8例,中位年齡54歲,患者肝功能分級為A級11例,B級8例,C級1例。
術前均經B超和MRI證實為肝硬化引起不同程度的門靜脈高壓,合并重度脾亢并導致外周血象明顯下降[血紅蛋白(Hb)<8 g/dL,白細胞(WBC)<3.5×109/L,血小板(PLT)<1.5×109/L],且有不同程度的貧血、乏力、反復牙齦出血、皮下淤血、腹脹等臨床表現。脾臟切除術的適應證包括:(1)門靜脈高壓伴隨嚴重的脾腫大或脾功能亢進;(2)肝功能良好,持續、穩定高于Chid-Pugh B級;(3)胰腺門脈高壓;(4)無或只有輕微的重要器官損傷。PSE的適應證包括:(1)由各種原因引起的脾功能亢進;(2)門脈高壓合并食管胃底靜脈曲張;(3)沒有嚴重的腹部臟器損害或腹腔感染。HIFU治療脾亢的適應證更為廣泛,Chid-Pugh C級的患者仍可謹慎考慮。治療方式的選擇主要基于臨床判斷、醫療條件和患者的意愿。
1.2治療方法
1.2.1脾臟切除術 取左肋緣下切口進腹,結扎脾動脈主干,離斷脾胃、脾腎和脾膈韌帶,取出脾臟予以切除。手術要點包括切斷和結扎脾周圍的血管和韌帶、注意保護相鄰器官和組織避免損傷和出血、妥善處理副脾以及精細的術后治療、護理等。
1.2.2PSE 在嚴格的無菌條件下,采用Seldinger法經皮穿刺右股動脈,置入5F導管鞘,經導管鞘引入5F的脾動脈導管至脾動脈主干,進一步超選插管至脾動脈主干遠端,以避開胰背動脈和胃短動脈防止誤栓胰腺。然后進行脾動脈造影(DSA)顯示脾臟動脈期、毛細血管期和靜脈期。經導管注入混有造影劑和適當抗生素的1~2 mm3明膠海綿顆粒進行栓塞治療,緩慢栓塞避免回流。治療終點是至少達到50%的脾栓塞面積。
1.2.3HIUF 采用JC型聚焦超聲腫瘤治療系統(重慶海扶技術有限公司),所有患者全身麻醉后,對治療區皮膚脫脂、脫氣,固定患者體位,主要以左側后傾臥位為主。以機載診斷超聲確定脾臟的位置、大小、形態、與鄰近器官的關系,治療計劃區域主要是脾門及脾臟中下方區域,依據治療計劃確定治療靶區,在診斷超聲實時引導、監測下,通過超聲引導的HIFU由點到線到面到體、由深到淺消融靶區內的各個層面,脾臟治療靶組織回聲明顯增強后停止治療,消融至整個計劃治療靶區被覆蓋,脾臟HIFU治療參數:治療頻率0.85 MHz,焦距140 mm,曲面直徑200 mm,治療功率300~400 W,治療時間1 000~7 000 s。
2 結 果
2.1手術時間、住院時間及術中出血量 3個治療組均成功完成治療,脾切除術組和HIFU組的手術時間分別為(119.7±49.89)min和(131.1±30.48)min,差異無統計學意義(P>0.05),脾切除術組和HIFU組的手術時間均超過PSE組(30.2±8.26,P<0.01)。3組治療過程中,僅脾切除術組會發生術中出血,出血量為(482.6±348.5)mL。經治療后,脾切除術組有7例患者需要輸血,PSE組有2例患者需要輸血,HIFU組無輸血病例。脾切除術組、PSE組與HIFU組的住院時間分別為(10.75±3.81)、(5.57±2.37)d和(8.32±3.54)d。
2.2術后并發癥及隨訪 3個治療組均無死亡病例,具體的術后并發癥見表1。根據文獻[15]將相關的并發癥分為重度并發癥和輕度并發癥。重度并發癥是指需要手術或介入治療或延長術后住院時間(超過30 d)或需要重新住院的并發癥,包括脾膿腫、脾破裂、肺炎、難治性腹腔積液、胸膜腔積液、消化道出血、肝性腦病和血栓形成。輕度并發癥是指患者能夠忍受或者僅需保守治療的并發癥,包括腹痛、發燒和打嗝等,輕度的并發癥為暫時的,保守治療后消失。本研究表明,與脾切除術組(n=5, 25%)和HIFU組(n=3,15%) 相比,PSE組更易發生重度并發癥(n=7,35%)。

表1 3組患者的并發癥發生情況(n)
2.3影像學檢查 為了觀察HIFU組與PSE組患者的脾臟消融或栓塞的效果,患者在術后2周進行腹部增強MRI或腹部CT掃描或腹部超聲檢查,PSE組患者脾臟栓塞信號在T1WI減少并在T2WI增加。而經HIFU治療后的患者腹部增強MRI顯示消融后的脾臟靶區組織在T1WI上無特異性,高、等、低信號區均代表凝固性壞死;在T2WI上,凝固性壞死則表現為低信號;增強掃描后靶區無強化,顯示的病灶范圍較T1WI和T2WI更為廣泛。
2.4外周血細胞的變化 與治療前相比,3組患者術后的WBC計數無明顯改變(P>0.05),而在術后第1天、第1個月以及第6個月時,3組患者的WBC和PLT計數明顯高于術前(P<0.01),脾切除術組和PSE組患者的外周血細胞增加更為明顯,尤其是脾切除術組;HIFU組的外周血細胞增加更為穩定緩慢。3組之間的WBC和PLT計數差異有統計學意義(P<0.05)。
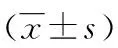
表2 3組手術方式患者的外周血細胞的變化
3 討 論
在本研究中,沒有患者出現治療后死亡或脾切除術后暴發性感染(overwhelming postsplenectomy infection,OPSI)。結果表明,脾切除術和PSE患者外周血細胞的增加更為明顯,尤其是脾切除術患者。然而,脾切除術組和PSE組患者更易發生并發癥,在脾切除術組,并發癥主要表現為腹痛、腹脹和傷口疼痛。1例患者發生了肝性腦病,經過治療和監測后患者逐漸好轉并痊愈。2例患者發生了血栓,血栓形成可能與異常的血小板及血液黏稠度增加有關,然而,血小板的變化并不能夠預測患者是否會形成血栓,正常數量血小板的患者也可能發生血栓。當血小板上升過快時則有必要進行干預。因此,術后評估是非常重要的,外科脾切除術對于患者的選擇有著更高的標準和要求。PSE的并發癥主要是腹部疼痛和發燒,腹部疼痛主要是腹部左上象限的疼痛,可能是因為脾臟包膜的刺激引起,大多數患者可以忍受。胸腔或腹腔積液可能是由于膈膜的刺激以及脾臟栓塞后左胸及腹腔的炎癥。PSE的并發癥發生率與脾臟栓塞體積和大小有關,雖然目前關于PSE并發癥發生率和栓塞面積之間的關系有部分研究,然而,仍然需要更多大樣本、多中心、長期隨訪的臨床研究,才能為脾亢患者提供最優的治療方案。HIFU組的所有患者均能夠耐受手術,沒有出現死亡病例,未出現胃腸道穿孔、腹膜炎、脾破裂或脾膿腫等嚴重并發癥,HIFU組患者的WBC、PLT緩慢上升,避免了脾靜脈血栓形成和繼發性血小板增多癥等并發癥。其他并發癥包括腹痛、發熱、胸腔或腹腔積液、治療區域的皮膚淤斑。發熱可能是脾臟消融后壞死物質的吸收引起,治療區域的皮膚淤斑考慮與脾亢較為嚴重以及治療時間過長有關。這些并發癥是暫時性的,經保守治療后消除。HIFU的并發癥發生率遠低于脾切除術和PSE。本研究中,甚至有1例Child-Pugh C級患者經HIFU治療后癥狀好轉。
在動物實驗研究中,經HIFU消融的脾臟組織會出現凝固性壞死,血管閉塞,膠原變性以及血栓形成,壞死組織逐漸吸收、纖維化或包裹機化[12]。本研究顯示患者經HIFU治療后,MRI增強掃描顯示消融區域無強化,靶區內血液供應減少或消失,提示局部組織的凝固性壞死和血流灌注障礙,在影像隨訪中,消融靶區逐漸縮小,脾臟體積縮小,壞死的脾臟組織被纖維組織所取代,由于纖維瘢痕收縮,使脾臟局部輪廓凹陷呈現分葉狀。因此,從理論上來講,HIFU可能更不容易出現感染性并發癥。
在長期隨訪中,筆者觀察到PSE組和HIFU組分別有2例和5例患者再次出現血細胞下降,鑒于PSE和HIFU的可重復性,對這類血細胞再次下降的患者可以重復實施PSE或HIFU治療。患者再次出現血細胞下降的原因可能與手術栓塞或消融體積偏小、患者脾亢程度較重有關。在脾切除術組患者,筆者同樣觀察到2 例患者的血細胞再次下降,雖然傳統脾切除術組發生血細胞再次下降的比例低于HIFU和PSE,但一旦發生,處理更為棘手,因此,醫生和患者應該更加謹慎地選擇脾切除術。治療方式的選擇取決于不同治療方式的效果評價和安全性,脾切除術和PSE患者外周血細胞的增加更為明顯,尤其是脾切除術,但是HIFU治療更為安全。因此,對于低風險的脾亢患者,為了達到更好的治療效果,脾切除術和PSE可以優先考慮,然而,對于高風險的脾亢患者可能不適合脾切除術和PSE,尤其是老年患者、嚴重肝硬化患者、較差的Child-Puge分級或有基礎疾病的患者,應當首先考慮HIFU治療。
經過回顧性分析表明,脾切除術、PSE、HIFU都是有效和安全治療脾亢的方式,脾切除術效果最為明顯,但是如果患者術后發生了嚴重的并發癥,其處理更為棘手,尤其是再次復發的患者。PSE減少了手術時間和住院時間,但它具有較高的風險,更易出現并發癥。目前,脾切除術和PSE是治療脾亢和血小板減少更為普遍的選擇,問題在于,他們是否是高風險患者的最佳治療選擇?HIFU有廣泛的臨床適應證,是治療脾亢最新的替代方案,臨床上往往被忽視。然而,HIFU是相對無創的,它對于患者有著更低的標準和要求,并且為脾亢患者提供更為安全的治療。因此,HIFU對于高風險患者是一個不錯的治療選擇。總而言之,脾亢的治療應當遵守“個體化原則”,結合醫療條件和設備,醫生應當進行綜合的評估并作出最佳的治療選擇。在未來的研究中,進一步確定評估風險因素以及治療標準是有必要的。
[1]LV Y,LAU W Y,LI Y,et al.Hypersplenism:History and current status[J].Exp Ther Med,2016,12(4):2377-2382.
[2]PECK M.Hypersplenism[J].Eur J Gastroenterol Hepatol,2001,13(4):317-323.
[3]DUAN Y Q,LIANG P.Thermal ablation for partial splenectomy hemostasis,spleen trauma,splenic metastasis and hypersplenism[J].Hepatogastroenterology,2013,60(123):501-506.
[4]MA K S,WU Q,LIU Q D,et al.Clinical research on radiofrequency ablation for hypersplenism[J].Zhonghua Wai Ke Za Zhi,2004,42:944-946.
[5]LIU Q,MA K,SONG Y,et al.Radiofrequency ablation for hypersplenism due to portal hypertension:clinical study surgery[J].Zhonghua Yi Xue Za Zhi,2008,143(4):509-518.
[6]HU K,LEI P,YAO Z,et al.Laparoscopic RFA with splenectomy for hepatocellular carcinoma[J].World J Surg Oncol,2016,14(1):196.
[7]MARTINS G L,BERNARDES J P,ROVELLA M S,et al.Radiofrequency ablation for treatment of hypersplenism:A feasible therapeutic option[J].World J Gastroenterol,2015,21(20):6391-6397.
[8]DUAN Y Q,GAO Y Y,NI X X,et al.Changes in peripheral lymphocyte subsets in patients after partial microwave ablation of the spleen for secondary splenomegaly and hypersplenism:a preliminary study[J].Int J Hyperthermia,2007(23):467-472.
[9]LIANG P,GAO Y,ZHANG H,et al.Microwave ablation in the spleen for treatment of secondary hypersplenism:a preliminary study[J].AJR Am J Roentgenol,2011(196):692-696.
[10]HA J,HENDRIX M,GUYER A G.Microwave ablation for the treatment of hypersplenism:short waves,low cost,big results[J].Dig Dis Sci,2016,61(1):6-7.
[11]JIANG X,GAO F,MA Y,et al.Percutaneous microwave ablation in the spleen for treatment of hypersplenism in cirrhosis patients[J].Dig Dis Sci,2016,61(1):287-292.
[12]SHI B,ZHU H,LIU Y J,et al.Experimental studies and clinical experiences on treatment of secondary hypersplenism with extracorporeal high-intensity focused ultrasound[J].Ultrasound Med Biol,2012,38(11):1911-1917.
[13]ZHU J,ZHU H,MEI Z,et al.High-intensity focused ultrasound ablation for treatment of hepatocellular carcinoma and hypersplenism:preliminary study[J].J Ultrasound Med,2013,32(10):1855-1862.
[14]ZHU J,ZHU H,MEI Z,et al.High-intensity focused ultrasound ablation:an effective and safe treatment for secondary hypersplenism[J].Br J Radiol,2014(87):20140374.
[15]HE X H,GU X H,GU J J,et al.Comparison of total splenic artery embolization and partial splenic embolization for hypersplenism[J].World J Gastroenterol,2012,18(24):3138-3144.

