煙酰胺磷酸核糖轉移酶在子宮內膜異位癥中的表達及其與新生血管生成的相關性
羅迪 牛剛 梁炎春 吳錦杰 謝鴻玉 李佳穎
1東莞企石醫院婦產科(廣東東莞 523500);2中山大學附屬第一醫院婦產科(廣州 510080);3中山大學中山醫學院臨床醫學八年制2012級(廣州 510080);4中山大學中山醫學院臨床醫學八年制2013級(廣州510080)
子宮內膜異位癥是婦科最常見的良性疾病之一,其發病機制尚未明確。內異癥作為一種慢性炎癥性疾病,其發病機制與新生血管密切相關,而且內異癥病灶的發生發展與腫瘤的發生發展有類似之處,異位內膜組織亦具備類似腫瘤細胞的侵襲、增殖和轉移等惡性生物學行為。煙酰胺磷酸核糖轉移酶(NMAPT)是一種重要的炎癥因子和促血管生成因子。它被證實在多種惡性腫瘤中表達升高,并且與腫瘤的預后相關,是一種重要的促癌因子。因此,NAMPT作為一種促炎癥的致癌因子,也可能促進內異癥新生血管形成參與其發病機制。目前國內外尚無NAMPT在內異癥中的發生發展中的相關研究。本研究擬通過ELISA、免疫組化等方法檢測NAMPT在卵巢子宮內膜異位囊腫中的表達,并分析其與內異癥病灶新生血管生成之間的關系。本研究為內異癥的機制研究提供新的研究思路和潛在治療靶點。
1 資料與方法
1.1 病例資料選擇2016年1月1日至2016年12月31日之間在中山大學附屬第一醫院婦科住院并行腹腔鏡手術治療的單側卵巢子宮內膜異位囊腫病例(實驗組)以及行孕前腹腔鏡下宮頸環扎手術治療的宮頸功能不全病例(對照組)作為研究對象,收集患者基本臨床資料。研究開始前已征得倫理委員會審批通過,并且與每一位患者簽署知情同意書。排除標準:合并盆腔慢性炎癥或其他慢性炎癥性疾病等;同時合并子宮腺肌病者;同時合并免疫性疾病者;同時合并或未排除惡性疾病者;術前3個月應用GnRHa或其他激素類藥物。入選標準如下:
1.1.1 實驗組所有患者術后均經病理證實為子宮內膜異位癥,分為2組:(1)卵巢子宮內膜異位囊腫組(Ovarian Endometrioma,OEM組,n=50);(2)卵巢子宮內膜異位囊腫患者在位內膜組(Endometriosis,EM組,n=30)。
1.1.2 對照組對照組為同期行孕前腹腔鏡下宮頸環扎手術治療的宮頸功能不全患者(Non?Endo?metriosis,NEM組,n=30)。所有患者均經腹腔鏡手術和術后病理排除子宮內膜異位癥。
1.2 研究方法使用ELISA的方法檢測子宮內膜異位癥患者和非子宮內膜異位癥血清中NAMPT和IL?6的水平并進行相互比較。采用免疫組織化學的方法,用CD34對微血管進行標記,在顯微鏡下觀察,對視野中陽性染色的微血管進行計數,再根據視野的面積計算出微血管密度。
采用免疫組化的方法,檢測NAMPT、血管內皮生長因子(VEGF)、血管內皮生長因子受體-2(VEGFR?2)在組織中的表達。免疫組化結果的判定采用HSCORE法:在200倍高倍鏡下,隨機選取5個視野,每個視野下計數50個細胞。陽性染色為細胞漿內出現棕黃色顆粒,以i代表染色深淺,根據細胞著色的強弱分為4個等級:無著色0分,淡黃色1分,棕黃色2分,棕褐色3分。HSCORE=ΣPi(i+1)(i=0,1,2,3;Pi表示評分為 i的細胞比例)。組織切片染色后均由兩位病理學醫師雙盲讀片,取各視野平均值。
1.3 統計學方法使用SPSS 18.0統計版軟件包進行數據分析和處理。各組患者一般資料采用兩組間獨立樣本的t檢驗;蛋白的表達以及微血管密度采用非參數秩和檢驗(Mann?WhitneyU檢驗和Kruskal?Wallis檢驗)。實驗數據以均數±標準差表示;數據的相關性分析采用spearman等級相關分析,相關系數以r表示。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料OEM組、EM組、NEM組之間的年齡、BMI、孕次和產次均無統計學差異(均P>0.05),提示以上研究組的資料具有可比性。
2.2 內異癥患者血清中NAMPT的表達水平OEM組中NAMPT的血清濃度比NEM組顯著升高(P< 0.05)(表1)。

表1 OEM組和NEM組之間NAMPT的血清濃度比較Tab.1 Comparison of serum level of NAMPT between OEM group and NEM group x± s,ng/mL
2.3 異位病灶中NAMPT、VEGF和VEGFR?2的表達OEM組病灶中的NAMPT、VEGF、VEGFR?2的表達均顯著高于EM組以及NEM組中的在位內膜(均P< 0.05)(表2)。
表2 異位病灶中NAMPT、VEGF和VEGFR?2的表達Tab.2 Expression of NAMPT,VEGF and VEGFR?2 in different tissues ±s
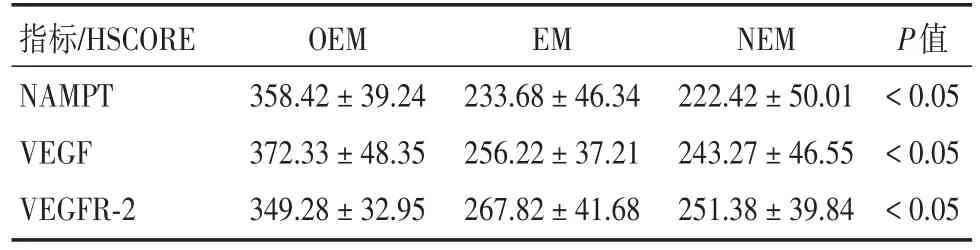
表2 異位病灶中NAMPT、VEGF和VEGFR?2的表達Tab.2 Expression of NAMPT,VEGF and VEGFR?2 in different tissues ±s
指標/HSCORE NAMPT VEGF VEGFR?2 OEM 358.42±39.24 372.33±48.35 349.28±32.95 EM 233.68±46.34 256.22±37.21 267.82±41.68 NEM 222.42±50.01 243.27±46.55 251.38±39.84 P值<0.05<0.05<0.05
2.3 內異癥患者血清NAMPT水平與病灶中微血管密度的關系OEM組病灶中CD34(+)的微血管密度(MVD)明顯高于EM組、NEM組在位內膜(P< 0.05)(圖1)。
為了進一步探討NAMPT可以影響新生血管生成參與內異癥的發病機制,本研究分析了NAMPT血清學水平與MVD之間的關系。結果發現,OEM組患者血清中NAMPT水平與病灶中MVD呈正相關,相關系數r值為0.81(P<0.05)。

圖1 CD34免疫組化染色陽性的微血管密度(MVD)在各組間的比較Fig.1 Comparison of CD34(+)microvessel density(MVD)between different groups
3 討論
子宮內膜異位癥是最常見的婦科疾病之一,有盆腔疼痛等相關癥狀或者合并不孕的育齡期女性中,其發生率可高達60%[1]。特別是近年來子宮內膜異位癥導致的慢性疼痛以及不孕,使得婦科醫師不得不重新思考它在婦科疾病中的重要性。鑒于其臨床處理的復雜性,對于子宮內膜異位癥的機制研究以及潛在的治療靶點的開發變得尤為重要。關于子宮內膜異位癥發病機制的理論很多,但仍存在很多爭議。經血逆流、盆腔微環境的改變、免疫狀態的失調、炎癥反應等,是造成內異癥的重要原因。因此,探尋異位的子宮內膜如何在宮腔外侵襲、增殖和遷移,從而定植和生長,具有非常重要的意義。
3.1 NAMPT與子宮內膜異位癥新生血管生成之間的關系NAMPT是一種公認的促癌因子,它的其中一個重要的促癌機制就是促進腫瘤中的新生血管生成[2]。本研究發現,NAMPT在卵巢巧囊患者的血清學水平較非內異癥患者血清學水平高,而且進一步病理學實驗證實,它在異位病灶中的表達明顯高于在位內膜(EM組或者NEM組),提示NAMPT可能參與內異癥的發病機制。而且,NAMPT的升高伴隨著VEGF以及VEGFR?2水平的升高,也伴隨著病灶中新生微血管密度的升高,進一步提示NAMPT可能通過促進新生血管形成參與內異癥的發生發展。
研究發現,NAMPT可以通過上調CCR?2(che?mokine receptor type 2)、CCL?2[chemokine(C?C motif)ligand 2]、FGF?2(fibroblast growth factor 2)、SIRT1(silent information regulator 1)的表達促進乳腺癌病灶中新生微小血管的形成[3-5]。進一步體外實驗證實,在人臍靜脈血管內皮細胞中加入游離的NAMPT,一方面可以促進血管內皮細胞的遷移能力,另一方面可以激活NF?κB,從而上調內皮細胞VEGF表達,最終增強細胞的增殖能力[6-7]。另外,也有學者發現胞外NAMPT在高糖狀態下可以促進人主動脈血管內皮細胞的存活以及促進新生微小血管的形成[8],該過程也在小鼠動物實驗中得到了進一步的證實。
3.2 NAMPT可能通過調節炎癥反應參與子宮內膜異位癥新生血管生成的過程NAMPT與多種炎癥性疾病密切相關,它已經成為炎性疾病的標記物之一。NAMPT與傳統的細胞因子類似,但它同時起著免疫調節以及自分泌、旁分泌等作用。采用外周血單核細胞進行體外培養實驗,加入游離NAMPT之后,約有50種炎癥基因受到其調節從而釋放大量的炎癥因子[9]。NAMPT的血清學水平與循環中的炎性指標如IL?6、CRP(C反應蛋白)以及MCP?1(monocyte chemoattractant protein 1)成正相關[10-12]。受到炎癥刺激后,NAMPT在多種細胞的表達明顯上調,如LPS活化的單核細胞、TNF?α活化的胎盤上皮細胞、IL?1β活化的心肌細胞以及TLR?4和IL?6共同激活的皮脂腺細胞等[13]。局部微環境所造成的缺血、缺氧狀態,進一步加劇了炎癥反應,形成惡性循環。
內異癥本身是一種慢性炎癥性疾病,NAMPT作為一種重要的炎癥因子,其在患者血清中以及病灶中的異常表達提示NAMPT可能參與內異癥的發生發展。另外,研究結果顯示NAMPT水平與病灶的微血管密度呈正相關。因此,NAMPT極有可能通過誘發和促進炎癥反應而參與子宮內膜異位癥的新生血管形成過程。
細胞外的NAMPT具有抗凋亡的作用,因此子宮內膜異位囊腫患者的血清學NMAPT水平的升高有利于促進巨噬細胞的存活。NAMPT可以促進巨噬細胞分泌IL?6,一方面促進胞內STAT3(sig?nal transducer and activator of transcription 3)的表達,另一方面可以其自身旁分泌、自分泌的過程,促進自身表達水平的提高[14]。
有學者提出,NAMPT可以促進血管內皮細胞和血管平滑肌細胞的炎癥反應,最終誘導新生血管形成。NAMPT直接作用于血管平滑肌細胞,通過ERK?1/2、NF?κB、iNOS信號通路軸誘發血管平滑肌的炎癥反應,并且促進血管平滑肌細胞的增殖[15-16]。炎癥相關性的轉錄因子如NF?κB、細胞粘附因子如ICMA?1(intercellular adhesion molecule 1)、VCAM?1(vascular cell adhesion molecule 1)和 E?selectin受NAMPT上調后可誘導單核細胞的遷移和募集,從而導致病灶中巨噬細胞的增多。另一方面,NAMPT可以促進IL?6的表達上調,促進單核細胞與血管內皮細胞的粘附,并逐漸越過血管屏障到達病灶,受NAMPT誘導更加可以分化成為M2型的巨噬細胞,加重炎癥反應[14]。同樣的,這種由內異癥主導的“NAMPT-炎癥-NAMPT”惡性循環,在病灶中不斷加強,通過促進異位病灶中新生血管形成參與內異癥的發生、發展。內異癥病灶通過自分泌和旁分泌兩條重要通路,上調NAMPT的表達,在炎癥因子IL?6、炎癥細胞巨噬細胞的作用下,通過上述途徑促進病灶中新生毛細血管的生成,從而參與內異癥的發生。
綜上所述,NAMPT參與子宮內膜異位癥新生血管生成過程的其中一個重要機制是激活和加強病灶微環境的炎癥反應。至于NAMPT參與促進炎癥反應的具體分子信號通路機制,NAMPT是否通過其他通路促進內異癥病灶中的新生血管形成等,有待進一步的后續研究。
[1]FASSBENDER A,BURNEY R O,O D F,et al.Update on biomarkers for the detection of endometriosis[J].Biomed Res Int,2015,2015:130854.
[2]WANG W,ELKINS K,OH A,et al.Structural basis for resis?tance to diverse classes of NAMPT inhibitors[J].PLoS One,2014,9(10):e109366.
[3]ADYA R,TAN B K,CHEN J,et al.Pre?B cell colony enhanc?ing factor(PBEF)/visfatin induces secretion of MCP?1 in hu?man endothelial cells:role in visfatin?induced angiogenesis[J].Atherosclerosis,2009,205(1):113?119.
[4]BAE Y H,BAE M K,KIM S R,et al.Upregulation of fibro?blast growth factor?2 by visfatin that promotes endothelial angio?genesis[J].BiochemBiophys Res Commun,2009,379(2):206?211.
[5]BEHROUZFAR K,ALAEE M,NOURBAKHSH M,et al.Ex?tracellular NAMPT/visfatin causes p53 deacetylation via NAD production and SIRT1 activation in breast cancer cells[J].Cell Biochem Funct,2017,35(6):327?333.
[6]LOVREN F,PAN Y,SHUKLA P C,et al.Visfatin activates eNOS via Akt and MAP kinases and improves endothelial cell function and angiogenesis in vitro and in vivo:translational im?plications for atherosclerosis[J].Am J Physiol Endocrinol Metab,2009,296(6):E1440?E1449.
[7]CHEN H,WANG S,ZHANG H,et al.Nicotinamide phospho?ribosyltransferase(Nampt)in carcinogenesis:new clinical op?portunities[J].Expert Rev Anticancer Ther,2016,16(8):827?838.
[8]BORRADAILE N M,PICKERING J G.Nicotinamide phospho?ribosyltransferase imparts human endothelial cells with extend?ed replicative lifespan and enhanced angiogenic capacity in a high glucose environment[J].Aging Cell,2009,8(2):100?112.
[9]DAHL T B,HOLM S,AUKRUST P,et al.Visfatin/NAMPT:a multifaceted molecule with diverse roles in physiology and pathophysiology[J].Annu Rev Nutr,2012,32:229?243.
[10]AUDRITO V,SERRA S,BRUSSA D,et al.Extracellular nico?tinamide phosphoribosyltransferase(NAMPT) promotes M2 macrophage polarization in chronic lymphocytic leukemia[J].Blood,2015,125(1):111?123.
[11]NPKHBEHSAIM M,EICK S,NOGUEIREA A V,et al.Stimu?lation of MMP?1 and CCL2 by NAMPT in PDL cells[J].Media?tors Inflamm,2013,2013:437123.
[12]CHEN C X,HUANG J,TU G Q,et al.NAMPT inhibitor pro?tects ischemic neuronal injury in rat brain via anti?neuroinflam?mation[J].Neuroscience,2017,356:193?206.
[13]GROLLA A A,TRAVELLI C,GENAZZANI A A,et al.Extra?cellular nicotinamide phosphoribosyltransferase,a new cancer metabokine[J].Br J Pharmacol,2016,173(14):2182?2194.
[14]PEIRO C,ROMACHO T,CARRARO R,et al.Visfatin/PBEF/Nampt:A new cardiovascular target?[J].Front Pharmacol,2010,1:135.
[15]VORA M,ANSARI J,SHANTI R M,et al.Increased nicotin?amidephosphoribosyltransferaseinrhabdomyosarcomasand leiomyosarcomas compared to skeletal and smooth muscle tissue[J].Anticancer Res,2016,36(2):503?507.
[16]CHEN J,SYSOL J R,SINGLA S,et al.Nicotinamide phos?phoribosyltransferase promotes pulmonary vascular remodeling and is a therapeutic target in pulmonary arterial hypertension[J].Circulation,2017,135(16):1532?1546.

