紫杉醇聯合洛鉑治療局部晚期宮頸癌患者的療效觀察*
李 娜,熊 嬌,嫣 靜,王瑞雪,付立仙
(遵義醫學院附屬醫院婦科,貴州遵義 563000)
局部晚期宮頸癌(locally advanced cervical cancer,LACC)是婦女常見的惡性腫瘤,其發病率逐年增加,臨床治療主要采用手術和放射措施[1]。LACC是一組具有高危因素的宮頸癌,其廣義的范圍是指ⅠB2~ⅣA期的宮頸癌,狹義的范圍則是指局部腫瘤直徑大于或等于4 cm的ⅡA期以下(ⅠB2~ⅡA2)的早期宮頸癌,此類腫瘤不易控制,手術難度大,術后容易復發和轉移,致使5年生存率明顯下降。對此時的宮頸癌進行術前新輔助化療可提高手術切除率,改善宮頸癌的預后。此化療基于紫杉醇,可以促進癌細胞的凋亡和腫瘤細胞裂解,抑制宮頸癌遠處轉移[1-2]。但近年來,有研究表明,LACC存在基因多樣性,能夠通過影響表達蛋白的性狀,導致癌細胞內紫杉醇藥物濃度降低,影響紫杉醇對LACC的化療效果[2]。
近年來,臨床應用紫杉醇與鉑類進行聯合化療LACC,取得一定的療效,其中以聯合洛鉑化療效果更為顯著[3]。洛鉑可用于治療前列腺癌、卵巢癌和輸卵管癌等。本研究中將洛鉑聯合應用于宮頸癌的化療中,聯合化療的優點是能明顯降低化療藥物不良反應,提高患者化療依從性及耐受性[4]。現將治療效果報道如下。
1 資料與方法
1.1一般資料 選取2013年8月至2016年12月在本院實施新輔助化療的58例LACC患者,其中29例患者(A組)采用紫杉醇聯合洛鉑新輔助化療方案,29例患者(B組)采用紫杉醇聯合順鉑治療。A組年齡27~62歲,平均(48.0±9.1)歲,國際婦產聯盟(FIGO)分期:ⅠB2期10例,ⅡA2期14例,ⅡB1期5例;腫瘤直徑1.9~6.7 cm,平均(4.6±1.3)cm;病理類型:鱗狀細胞癌25例,腺癌3例,腺鱗癌1例。B組年齡33~64歲,平均(50.2±12.4)歲,FIGO分期:ⅠB2期12例,ⅡA2期9例,ⅡB1期8例;腫瘤直徑1.9~6.7 cm,平均(4.6±1.3)cm;病理類型:鱗狀細胞癌25例,腺癌3例,腺鱗癌1例。兩組的年齡、FIGO分期、腫瘤大小、病理類型比較,差異均無統計學意義(P>0.05)。納入標準:(1)宮頸癌的診斷標準參考人民衛生出版社《婦產科學》第8版的標準;(2)年齡小于65歲;(3)經宮頸活檢病理學檢查證實;(4)FIGO分期:ⅠB2期~ⅡA2期;(5)治療前獲得研究對象的知情同意。排除標準:(1)合并嚴重的內科疾病、肝腎功能障礙;(2)伴有其他部位惡性腫瘤;(3)對本研究涉及的藥物過敏;(4)有嚴重的內外科并發癥,存在手術禁忌。
1.2方法
1.2.1新輔助化療方法 兩組患者入院后立即完善相關檢查,排除化療禁忌。A組患者首先給予80 mg/m2的安素泰紫杉醇注射液(澳大利亞Hospira公司,進口藥品注冊證號H20090175)進行靜脈滴注,并給予80 mg/m2的洛鉑(海南長安國際制藥有限公司,國藥準字號H20050309)進行靜脈滴注。B組患者首先也給予80 mg/m2的多西紫杉醇,并給予80 mg/m2的順鉑(貴州漢方制藥有限公司,國藥準字號H20020272)進行靜脈滴注。化療的過程中維持電解質酸堿平衡,注意水化、保肝、解毒等對癥治療,一旦出現嚴重的不良反應時應立即停止化療,總化療周期為3個周期。
1.2.2血清腫瘤標記物檢查方法 取凍存患者血清保存液體,25 000 r/min離心30 min,每3.0毫升需裂解的樣品中加入0.5 mL的氯仿,進行裂解操作,采用無酶的RNA沖洗液進行洗滌,再20 000 r/min離心5 min,得到血清細胞角蛋白19片段抗原21-1(CYFRA21-1)、鱗狀上皮癌抗原(SCCAg),CYFRA21-1采用RNA逆轉錄進行復制后萃取化驗,SCCAg采用抗原-抗體結合法進行檢測。檢測并對比兩組患者化療前、化療結束后2周CYFRA21-1和SCCAg的水平。
1.2.3輔助檢查 對白細胞、血紅蛋白、血小板進行檢測。
1.2.4近期療效評估 近期療效評價標準:參照實體瘤治療反應評價標準(RECIST)分為:完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)、疾病進展(PD)。CR:可見病灶完全消失,未出現新病灶,腫瘤標記物降至正常范圍;PR:腫瘤最大直徑及最大垂直直徑的乘積縮小達到50%以上;SD:腫瘤最大直徑及最大垂直直徑的乘積縮小小于50%,增大小于25%;PD:患者出現1個或多個病灶的腫瘤最大直徑及最大垂直直徑的乘積大于25%;緩解率=(CR+PR)/本組樣本量×100%,總有效率=(CR+PR+SD)/本組樣本量×100%。毒副反應參照WHO毒副反應5級分級標準,0度:無毒副作用;Ⅰ度:輕度反應;Ⅱ度:中度毒副反應;Ⅲ度:重度毒副反應;Ⅳ度:有嚴重的并發癥。
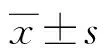
2 結 果
2.1兩組患者的近期療效比較 A組患者的緩解率82.76%、總有效率100.00%;B組患者的緩解率68.97%,總有效率96.55%,兩組間比較差異均無統計學意義(P>0.05),見表1。

表1 兩組患者的近期療效比較
2.2兩組患者的血清腫瘤標記物水平比較 A、B組CYFRA21-1、SCCAg化療后較化療前均明顯降低(P<0.05);但A組患者的血清CYFRA21-1、SCCAg水平與B組患者比較差異均無統計學意義(P>0.05),見表2。

表2 兩組患者的血清腫瘤標記物水平比較
a:P<0.05,與本組化療前比較
2.3兩組患者的毒副作用發生率比較 化療過程中,A組患者的惡心嘔吐、腹瀉發生率分別為17.24%、6.90%,B組患者的惡心嘔吐、腹瀉發生率分別為48.28%、31.03%,兩組比較差異有統計學意義(P<0.05);兩組患者白細胞、血紅蛋白、血小板降低,肝功能損害,腎損傷,周圍神經炎的發生率比較差異均無統計學意義(P>0.05),見表3。

表3 兩組患者的毒副作用發生率比較[n(%)]
2.4兩組患者3年隨訪情況比較 對兩組患者進行為期36個月的隨訪,B組有1例患者失訪;A組總生存率為68.97%(20/29)、B組患者的總生存率為62.07%(18/29),兩組比較差異無統計學意義(χ2=0.305,P=0.581);兩組患者的生存函數曲線分析,生存時間比較差異無統計學意義(Z=0.381,P=0.537),見圖1。

圖1 兩組患者的生存函數曲線
3 討 論
宮頸癌每年新發病例在世界范圍內約為50萬例,病死率達50%。對于女性而言,是最高發及最致命的惡性疾病[5]。宮頸早期巨大癌及局部晚期浸潤癌有一定手術難度,術前進行先期化療可使腫瘤體積縮小或消失,提高手術切除率和徹底切除率,改善預后,延長患者的無瘤間期,使生存率有所提高。其中紫杉聯合鉑類方案是循證醫學研究充分肯定的一線化療方案[6-7]。采用紫杉醇聯合鉑類藥物對宮頸癌患者進行先期化療時,能有效改善腫瘤細胞對紫杉醇的耐藥性,使紫杉醇發揮殺滅腫瘤細胞的功能,維持在癌細胞中的有效血藥濃度[8-9]。
第1代和第2代鉑類易在腎臟積聚,并導致腎臟毒性反應。腎毒性和鉑類藥物的種類密切關系,順鉑是鉑類藥物中能引起較為嚴重腎毒性的一種類型,大量的順鉑在體內積累后會導致腎功能不全[10]。在晚期宮頸癌化療中使用順鉑治療的患者,其腎損傷的發生率超過25%,嚴重影響患者的腎功能。第3代代表藥物洛鉑明顯優于順鉑,對腎臟的損傷性較小[11],其主要藥理作用為:具有對腫瘤細胞烷基化作用,能將腫瘤細胞聚集成團,并能對腫瘤細胞產生收縮作用,直至腫瘤細胞自身裂解死亡,對人類腫瘤細胞系具有一定的細胞毒性作用,類似于順鉑的腫瘤抑制效果但效果更強,且對人體正常細胞具有識別保護作用,不攻擊人體正常組織細胞[12]。洛鉑通常不具腎毒性,一般不需要水化,但對脫水尿少患者應適當補充水分,洛鉑也沒有順鉑常見的神經毒性及耳毒性,惡心嘔吐比順鉑輕。洛鉑的劑量限制性毒性為血小板減少,其發生率與嚴重程度與卡鉑相近,僅適用于基礎血小板在100×109/L以上的患者,使用劑量不得超過50 mg/m2,每3周1次。用藥過程中需嚴密監測血常規及出血癥狀,對原已有出血傾向的患者,包括活動性潰瘍病及癌癥病灶有出血危險者,應慎重考慮或避免使用[11-12]。在靜脈注射后,血液中的藥物濃度維持在基礎水平,血液中幾乎沒有洛鉑的代謝物,不會隨血液循環回流到身體各處組織器官,具有選擇性殺傷作用[13]。在數小時后,體內血液循環和血清蛋白結合的總洛鉑濃度僅為2.5%,這說明洛鉑對血液中白細胞、血小板無毒害作用,血液運輸氧能力仍處于正常水平[14]。當紫杉醇與洛鉑進行聯合時,能干擾宮頸癌細胞進行基因表達和傳代增殖,從而不能完成癌細胞基因傳遞,導致癌細胞發生異常生理改變,而發生裂解死亡[15]。
本研究結果顯示,紫杉醇聯合該兩種藥物對LACC患者行先期化療3個療程,患者的緩解率、總有效率及血清中相關腫瘤標記物水平化療前后比較差異無統計學意義,說明應用紫杉醇聯合該兩種藥物均能殺滅腫瘤細胞,可抑制癌細胞增殖、生長和表達,說明應用紫杉醇聯合洛鉑或順鉑對患者治療效果相當。本研究結果還顯示,紫杉醇聯合洛鉑治療中,患者出現胃腸道反應如惡心嘔吐及腹瀉的發生率較B組明顯降低,而血液系統、肝腎功能的影響及周圍神經炎等化療不良反應的發生接近順鉑使用后所產生的藥物毒副反應情況。因此A組中胃腸道發生的毒副作用較低,不良反應小,能更好地提高患者化療的依從性及耐受性。本研究還對兩組患者生存率進行評價,兩組患者均能達到較高的生存率,能對LACC宮頸癌患者起到較好的治療效果。
綜上所述,紫杉醇聯合洛鉑在LACC患者術前新輔助化療中與紫杉醇聯合順鉑的治療效果相當,但是相對毒副反應發生率更低,有利于提高患者的治療依從性。洛鉑作為第3代鉑類抗腫瘤藥物,具有水溶性好,抗瘤譜廣,抗腫瘤性強,與其他鉑類藥物無交叉耐藥及毒副作用輕的特點,已經顯示出明顯優勢。由于目前僅在中國市場上市,尤其對婦科腫瘤新的適應證研究才剛剛起步,其遠期療效還需要進一步大樣本臨床隨機研究證實。
參考文獻
[1]ANGIOLI R,PLOTTI F,MONTERA R,et al.Neoadjuvant chemotherapy plus radical surgery followed by chemotherapy in locally advanced cervical cancer[J].Gynecol Oncol,2012,127(2):290-296.
[2]WIEBE E,DENNY L,THOMAS G.Cancer of the cervix uteri[J].Int J Gynecol Obste,2012,119(S2):S100-109.
[3]ADACHI S,OGASAWARA T,WAKIMOTO E,et al.Phase Ⅰ/Ⅱ study of intravenous nedaplatin and intraarterial cisplatin with transcatheter arterial embolization for patients with locally advanced uterine cervical carcinoma[J].Cancer,2001,91(1):74-79.
[4]FERLAY J,SHIN H R,BRAY F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2894.
[5]喬友林.適宜發展中國家與地區的宮頸癌快速篩查技術的研究及意義[J].中華預防醫學雜志,2015,49(2):110-111.
[6]GREEN J A,KIRMAN J M,TIERNEY J F,et al.Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix:a systematic review and meta-analysis[J].Lancet,2001,358(9284):781-786.
[7]鄧凱賢,李維麗,陳春林,等.ⅠA2~ⅡA2期宮頸癌主韌帶浸潤情況調查及危險因素分析[J].重慶醫學,2016,45(12):1641-1644.
[8]劉紅,張國楠.宮頸癌化療耐藥相關問題[J].中國實用婦科與產科雜志,2015,31(3):198-201.
[9]劉少曉,程曉燕,鄭紅楓,等.紫杉醇聯合順鉑新輔助治療局部晚期宮頸癌的臨床療效及安全性評價[J].中國臨床藥理學雜志,2015,31(6):432-434.
[10]SCHMELAR K M,FRUMORIT M,RAMIREZ P T.Conservative management of early stage cerviacal cancer:is there a role for less radical surgery?[J].Gynecolog Oncol,2011,120(3):321-325.
[11]MCKEAGE M J.Lobaplatin:a new antitumour platinum drug[J].Expert Opin Investig Drugs,2001,10(1):119-128.
[12]ENGLE J B ,MARTENS B E,HAHNE J C,et al.Effects of lobaplatin as a single agent and in combination with TRAIL on the growth of triple-negative p53-mutated breast cancers in vitro[J].Anticancer Drugs,2012,23(4):426-436.
[13]HOU Y I,YIM M,SUN F,et al.A metabolomics approach for prediciting the response to the neoadjuvant chemotherapy in cervical cancer patients[J].Mol Biosyst,2014,10(8):2126-2133.
[14]WANG H,ZHU L,LU W,et al.Clinicopathological risk factors for prediciting the response to the neoadjuvant chemotherapy and radical hysterectomy in cervical cancer [J].World J Surg Oncol,2013,11(1):301.
[15]ZHANG H,PENG W,ZHANG Y.Detection of cell apoptosis in pelvic lymphnodes of patients with cervical cancer after neoadjuvant chemotheray[J].J lnt Med Res,2014,42(3):641-650.

