白細胞介素35在腎癌中的表達水平及其與臨床病理特征的相關性研究
王 靜,楊立宏
(內蒙古自治區赤峰市醫院腎內科 024000)
近年來,腎細胞癌的發病率呈上升趨勢,約占腎惡性腫瘤的80%~90%,以及成人實體腫瘤的2%~3%。臨床上可通過手術切除治療腎細胞癌,但是仍有高達30%~40%的患者出現轉移或復發[1]。有資料顯示,腎癌的高發年齡為40~55歲,以透明腎細胞癌為主,約占腎癌的85%[2]。國內外有些研究表明機體免疫系統調節失衡可能與腎透明細胞癌的發病有關[3-4]。目前腎癌的治療方法仍在不斷的研究中,如靶向藥物治療等,但是很多晚期腫瘤患者未能得到有效解決及治療。隨著科技的發展,關于細胞因子研究越來越多,國內外研究者對于機體免疫反應生理及病理意義認識有了進一步提高。白細胞介素-35(IL-35) 是一種抗炎性細胞因子,能夠參與免疫反應調節。IL-35大部分是由T細胞分泌,是T 細胞發揮免疫調節作用的關鍵細胞因子。許白葉等[5]報道稱,IL-35在多種腫瘤組織中存在高表達的情況,能夠促進腫瘤組織部位血管增生。本研究對IL-35在腎癌中的表達水平及其與腎癌臨床病理特征之間的關系進行分析,現報道如下。
1 資料與方法
1.1一般資料 選取2015年6月至2016年10月間于本院擇期行手術治療的腎透明細胞癌患者60例(腎透明細胞癌組),收集其臨床資料,及腫瘤組織和癌旁組織的標本。另取同期于本院健康查體中心行健康查體的50例健康志愿者為對照組。腎透明細胞癌組中男38例,女22例,年齡(53.16±7.92)歲;觀察組中男31例,女19例,年齡(52.37±8.57)歲。納入標準:(1)非透明細胞腎癌及LPRAML診斷符合WHO制定的相關標準;(2)臨床資料完善;(3)自愿參加本研究,并簽訂知情同意書。排除標準:(1)術前接受過內分泌治療;(2)術前存在急慢性炎癥;(3)既往腫瘤病史。本研究已由醫院倫理委員會批準。
1.2方法
1.2.1收集和處理標本 全部受試者在接受治療前均采集空腹時外周靜脈血樣本5 mL,置于抗凝管中。水平離心機2 500 r/min離心20 min,取上層血清置于 EP 管中保存在-80 ℃。剩余的血液樣本加入紅細胞裂解液10 mL,反應8 min后2 500 r/min水平離心10 min,分離出外周血單個核細胞,置于2 mL EP管中,加入1 mL TRIzol,-80 ℃保存。收集術中新鮮標本組織,包括腫瘤組織、癌旁組織及正常腎臟組織,儲存轉運使用液氮罐,置于-80 ℃保存。
1.2.2實驗方法
1.2.2.1酶聯免疫吸附法(ELISA)檢測血清中IL-35水平 使用人IL-35 ELISA 試劑盒檢測腎透明細胞癌組及對照組血清中IL-35水平,按照試劑盒說明書檢測,所有樣本均檢測2次取平均值。實際水平計算:以標準品水平為縱坐標,光密度(OD)值為橫坐標,繪出標準曲線。由標準曲線查出相應水平,乘以稀釋倍數,即為樣品的實際水平。
1.2.2.2實時定量PCR方法檢測 提取PBMCs及腎組織細胞中總RNA,并將總RNA逆轉錄為cDNA,并用實時定量PCR測定細胞中IL-35相關的EB病毒誘導基因3(EBI3)及亞基免疫因子53(p35)表達水平。總RNA提取使用RNA提取試劑盒,實時定量PCR引物序列如下,EBI3上游5′-GCTCCCTACGTGCTCAAT-3′,下游5′-CCCTGACGCTTGTAACGG-3′;p35上游5′-TCCTCCCTTGAACCGGAA-3′,下游5′-TGACAACGGTTTGGAGGG-3′。
1.2.2.3免疫熒光染色觀察 IL-35在腎癌組織及正常組織中的表達。對腎透明細胞癌組織及正常腎癌組織進行了EBI3及P35的免疫熒光染色,分別為FITC標染抗p35抗體,而RITC標染抗EBI3抗體。
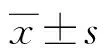
2 結 果
2.1患者臨床資料比較 腎透明細胞癌患者平均腫瘤直徑為(4.30±2.31)cm;TNM-T分期中T1期 36例,T2期13例,T3期9例,T4期2例;腫瘤分期Ⅰ期37例,Ⅱ期10例,Ⅲ期11例,Ⅳ期2例。兩組患者在年齡及性別方面比較差異無統計學意義(P>0.05)。
2.2兩組血清IL-35水平比較 腎透明細胞癌組血清中IL-35為(107.52±56.83)pg/mL,對照組為(66.25±17.33)pg/mL,差異有統計學意義(t=5.326,P=0.015)。不同年齡及性別的患者的血清中IL-35水平比較差異無統計學意義(P>0.05),不同腫瘤分期及淋巴結轉移患者的IL-35水平比較差異有統計學意義(P<0.01),見表1。

表1 IL-35表達量與腎癌的臨床病例特征間的關系

A:兩組PBMCs中EBI3及p35的表達量;B:在腎透明細胞癌組織、癌旁組織及正常腎組織的EBI3及p35的表達量
圖1 EBI3及p35表達量比較

圖2 兩組IL-35亞基表達量

圖3 ROC曲線結果
2.3患者mRNA水平上EBI3及p35表達量對比 在mRNA水平上,腎透明細胞癌組PBMCs中EBI3及p35的表達量明顯高于對照組。腎癌組織、癌旁組織及正常腎組織之間EBI3及p35的表達量比較,腎癌組織中的EBI3及p35的表達量均明顯高于癌旁組織和正常組織,見圖1。
2.4兩組EBI3及p35表達量對比 EBI3及p35在腎透明細胞癌組中均呈現高表達,明顯高于對照組中的表達量,差異有統計學意義(t=18.316,P<0.01),見圖2。
2.5腎透明細胞癌組ROC曲線分析結果 最佳截點為IL-35 80.13 pg/mL時,曲線下面積為0.776,在診斷方面,其靈敏度為61.3%,特異度為91.1%,診斷正確率為73.2%,見圖3。
3 討 論
IL-35是一種由p35及EBI3兩個亞基組成的免疫抑制細胞因子,由EBI3蛋白和p35亞基組成的異源二聚體,是IL-12家族的新成員[6]。有研究發現IL-35是重要的抗炎因子,對機體的自身免疫疾病及調節移植排斥等方面均發揮著重要作用[7]。國內外關于IL-35與免疫性疾病的相關研究也較多,也比較深入,而與腫瘤的進展相關研究較少。IL-35與多種腫瘤疾病具有相關性,如皮膚黑色素瘤及鼻咽癌等均發現IL-35的表達。IL-35能誘導Treg細胞增殖,抑制輔助性T細胞17型(Th17)細胞的分化,能夠改善膠原性關節炎臨床癥狀。DONG等[8]經研究證實IL-35在胸膜結核性胸腔積液中表達量較高。總結最近國內外關于IL-35的相關研究,發現它在腫瘤發生、發展、預后及轉歸中起重要作用。但也有研究發現IL-35能夠抑制腫瘤生長并提高腫瘤細胞凋亡的敏感性[9]。但目前關于IL-35在腎臟惡性腫瘤的發生、發展中的作用的研究較少,有待進一步研究。
ZHANG等[10]研究報道經實驗在腫瘤微環境中檢測到IL-35及調節性T細胞(Treg)明顯增加。本研究發現腎癌患者的血清IL-35水平明顯高于健康志愿者,與ZHANG等[10]的結論部分一致。本文通過繪制ROC曲線判斷IL-35對腎透明細胞癌的診斷價值,發現IL-35水平能夠作為一種新指標來診斷腎癌,最佳截點為IL-35 80.13 pg/mL,其靈敏度為61.3%、特異度為91.1%,診斷正確率為73.2%。JIN等[11]曾發表文章稱胰腺導管腺癌患者的血清中IL-35水平明顯升高,IL-35參與了疾病的病理生理過程。此外也有研究發現關于黑色素瘤及結腸癌組織的研究,均發現IL-35水平增加,IL-35能通過抑制CD4+T細胞的增殖,進而抑制機體的抗腫瘤免疫。此外,IL-35能夠促進腫瘤血管的增生,促進腫瘤的生長[12-13]。IBUSUKI等[14]曾報道非小細胞肺癌患者的血清IL-35水平與淋巴轉移密切相關。此外,本研究發現血清IL-35水平與腫瘤分期及淋巴結轉移密切相關,與IBUSUKI的研究結果部分一致。腫瘤分期及淋巴結轉移是判斷癌癥患者預后的一項重要指標,所以本研究認為血清中IL-35水平可以在一定程度上反映腎透明細癌的預后。
本研究對IL-35 mRNA在腎癌中的表達水平也進行了研究,發現腎透明細胞癌組外周血單個核細胞中IL-35的亞基(EBI3及p35)的表達量明顯高于對照組;而腎癌組織中的EBI3及p35的表達量均明顯高于癌旁組織和正常組織。體內IL-35由Treg分泌,有免疫負調控的作用,通過基因表達分析發現,其他多種組織也可以表達IL-35。有研究證實EBI3在急性粒細胞白血病細胞及霍奇金淋巴瘤中均表達升高[15-16]。本研究認為臨床上推廣通過腎臟穿刺活檢,檢測IL-35 mRNA有一定的困難,建議推廣應用血液中檢測IL-35水平來判斷疾病的嚴重程度及預后,也更加方便快捷。
綜上所述,IL-35在腎透明細胞癌患者的外周血及組織中均明顯升高,血清中IL-35水平與臨床分期及淋巴結轉移密切相關,能夠在一定程度上反映腎透明細胞癌預后。本研究為單中心研究,且樣本數量較少,建議進行多中心合作,擴大樣本數量,進一步研究IL-35的具體功能及相關機制。
參考文獻
[1]趙麗,王萍.白介素-35與心血管疾病關系研究進展[J].廣西醫學,2017,39(1):84-86.
[2]張晴,魏淑萍,黃鵬飛,等.腎透明細胞癌病理分級與其超聲特征的相關性分析[J].醫學研究生學報,2017,30(10):1071-1074.
[3]FAN Y G,ZHAI J M,WANG W,et al.IL-35 over-expression is associated with Genesis of gastric cancer[J].Asian Pac J Cancer Prev,2015,16(7):2845-2849.
[4]徐一鵬,朱紹興,劉維輝,等.IL-2、IFN-α、IFN-γ對腎透明細胞癌786-0細胞中B7-H4表達的影響[J].中國腫瘤生物治療雜志,2013,20(5):547-551.
[5]許白葉,張靜,王清海,等.阻斷白介素-3減輕膿毒血癥小鼠的炎癥反應[J].中國現代醫學雜志,2016,26(13):28-36.
[6]SKROMBOLAS D,WYLIE I,MAHARAJ S,et al.Characterization of an IL-12 p40/p35 truncated fusion protein that can inhibit the action of IL-12[J].J Interferon Cytokine Res,2015,35(9):690-697.
[7]NING X W,JIAN Z J,WANG W.Low serum levels of interleukin 35 in patients with rheumatoid arthritis[J].Tohoku J Exp Med,2015,237(2):77-82.
[8]DONG X,YANG J.High IL-35 pleural expression in patients with tuberculous pleural effusion[J].Med Sci Monit,2015,21(8):1261-1268.
[9]陶千山,翟志敏.IL-35及其誘導產生的
新型調節性T細胞——iTR35細胞[J].國際免疫學雜志,2013,36(5):329-332.
[10]ZHANG Y,SUN H,WU H,et al.Interleukin 35 is an Independent prognostic factor and a therapeutic target for nasopharyngeal carcinoma[J].Contemp Oncol,2015,19(2):120-124.
[11]JIN P,REN H,SUN W,et al.Circulating IL-35 in pancreatic ductal adenocarcinoma patients[J].Hum Immunol,2014,75(1):29-33.
[12]黃崇標,田野,崔焱,等.白細胞介素35的在腫瘤發展中的作用[J].中國肺癌雜志,2016,19(4):230-235.
[13]LIU H,ZHANG W,TIAN F F,et al.IL-35 is involved in the pathogenesis of Guillain-Barré syndrome through its influence on the function of CD4+T cells[J].Immunol Invest,2015,44(6):566-577.
[14]IBUSUKI K,SAKIYAMA T,KANMURA S,et al.Human neutrophil peptides induce interleukin-8 in intestinal epithelial cells through the P2 receptor and ERK1/2 signaling pathways[J].Int J Mol Med,2015,35(6):1603-1609.
[15]WANG J,TAO Q,WANG H,et al.Elevated IL-35 in bone marrow of the patients with acute myeloid leukemia[J].Hum Immunol,2015,76(9):681-686.
[16]曹蕾,范磊,徐衛,等.第56屆美國血液學年會研究熱點報道:慢性淋巴細胞白血病治療研究進展[J].中華血液學雜志,2015,36(4):358-360.

