谷子種子DNA快速提取新方法
龐 冰 ,王艷梅 ,郝建平 ,,王陸軍 ,王創(chuàng)云 ,李培良 ,鄧艷芳,周 瓊,李志敏,董永軍,張婷婷,裴成成,牛學(xué)謙
(1.山西大學(xué)生命科學(xué)學(xué)院,山西太原030006;2.山西省農(nóng)業(yè)科學(xué)院作物科學(xué)研究所,山西太原030031;3.山西省玉米工程技術(shù)研究中心,山西太原030031;4.山西省農(nóng)業(yè)科學(xué)院農(nóng)業(yè)科技信息研究所,山西太原030031)
DNA作為分子試驗(yàn)的基礎(chǔ),其質(zhì)量的好壞決定著試驗(yàn)的成功與否[1]。隨著SSR,SNP和基因測(cè)序等高通量生物技術(shù)的發(fā)展,農(nóng)作物研究需要檢測(cè)的樣本量顯著增加,所以,能夠在短時(shí)間內(nèi)快速地提取大量高質(zhì)量樣本的DNA,是提高分子試驗(yàn)效率的有效手段[2-4]。
當(dāng)前,谷子DNA提取的主要方法包括SDS(十二烷基磺酸鈉)法、CTAB(十六烷基三乙基溴化銨)法和高鹽提取法等[5-7]。但這幾種提取方法均以植物幼葉為材料,需經(jīng)過(guò)3~7 d的發(fā)芽期,需要進(jìn)行液氮研磨,水浴、異丙醇沉淀耗時(shí)較長(zhǎng),批量核酸提取工作量繁重[8-10]。
本試驗(yàn)旨在探究直接以谷子種子為材料提取DNA的方法,簡(jiǎn)化操作流程,縮短提取周期,為谷子高通量分子檢測(cè)奠定基礎(chǔ)。
1 材料和方法
1.1 材料
山西省主要谷子種質(zhì)資源及常規(guī)品種如表1所示。

表1 10份材料名稱及地理來(lái)源
1.2 試劑及主要儀器設(shè)備
2%的CTAB分離緩沖液;0.5 mol/L的EDTA;1 mol/L的 Tris-HCl;β-巰基乙醇;TE 緩沖液;氯仿 /異戊醇(24∶1);異丙醇;瓊脂糖;TAE 緩沖液;乙醇(70%);GelStain。
高速冷凍離心機(jī)(Eppendorf 5810R);PCR儀(eppendorf);微量紫外分光光度計(jì)(北京凱奧5600);電泳儀(北京君意東方JUNYI3000E)。
1.3 試驗(yàn)方法
1.3.1 谷子基因組DNA提取 取種子0.1 g或幼葉50 mg,機(jī)械粉碎;加入 800 μL CTAB 提取液,65 ℃水浴15 min,期間不定期搖勻;加入等體積氯仿/異戊醇,混勻3 min,以12 000 r/min離心5 min,取上清,重復(fù)2次;加入0.8倍體積的異丙醇(-20℃預(yù)冷),置于-20℃放置5 min;取出后12 000 r/min離心1 min,棄上清;加入500 μL的70%乙醇,搖勻;小心將酒精倒出,自然風(fēng)干后加入50 μL含RNase的TE緩沖液,保存?zhèn)溆谩?/p>
1.3.2 DNA質(zhì)量檢測(cè) 采用0.8%瓊脂糖進(jìn)行電泳檢測(cè);采用紫外分光光度計(jì)測(cè)定A260/280值及其質(zhì)量濃度。
1.3.3 SSR-PCR檢測(cè) 引物名稱為 SiGMS462,正向序列:AGGCCCAGTTTAAATGCAAG;反向序列CTAGGAAGCATCATCCTCCG。反應(yīng)體系(20 μL):DNA模板60ng;10×Buffer(含MgCl2)2μL;2.5mmol/L dNTPs 1 μL;10 mmol/L 引物各 0.5 μL;2.5 U/μL Taq酶 0.1 μL;ddH2O12.9 μL。反應(yīng)條件:94 ℃ 5 min;94℃30 s,52℃40 s,72℃ 1 min,循環(huán) 35次;72℃延伸10 min。采用0.8%瓊脂糖進(jìn)行電泳檢測(cè),120 V電泳45 min。
2 結(jié)果與分析
2.1 谷子基因組DNA的純度與質(zhì)量濃度分析
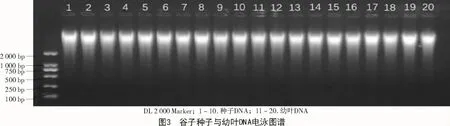
采用新方法提取的幼葉DNA質(zhì)量濃度比種子高,但個(gè)體差異較大,最高可達(dá) 4 671.88 ng/μL,最低為 2 530.51 ng/μL,總體趨勢(shì)不穩(wěn)定;新方法提取的種子DNA總體趨勢(shì)相對(duì)穩(wěn)定,基本都在2 000~3 000 ng/μL(圖1、表2)。采用新方法提取的種子和幼葉的核酸,A260/280值均處于 1.8~2.0(圖 2);經(jīng)過(guò)瓊脂糖電泳檢測(cè),結(jié)果顯示,所得條帶清晰,一致度高,無(wú)拖尾現(xiàn)象,DNA完整性較好(圖3)。說(shuō)明使用新方法提取的種子DNA質(zhì)量與幼葉一致,無(wú)明顯差異。
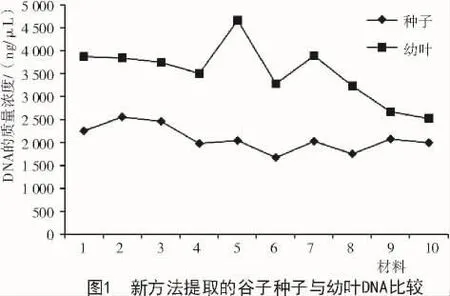
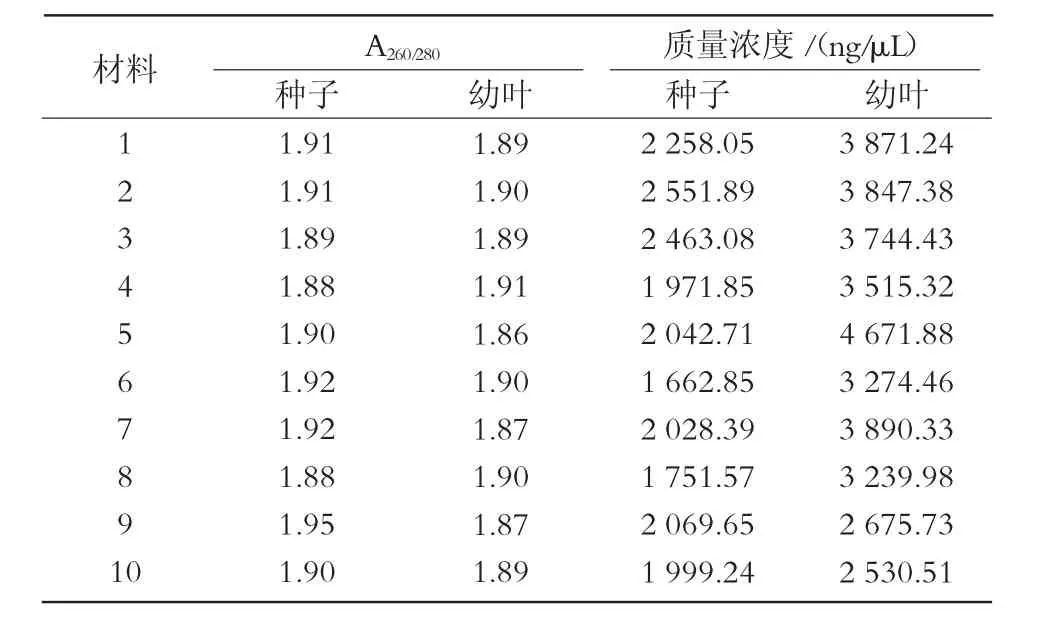
表2 谷子種子與幼葉基因組DNA紫外分光光度計(jì)檢測(cè)結(jié)果

2.2SSR-PCR 驗(yàn)證效果
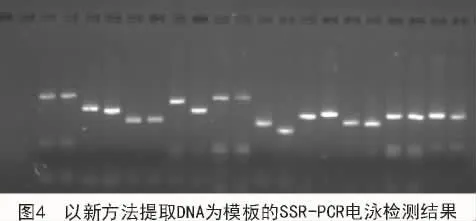
為驗(yàn)證新方法提取的DNA能否用于SSR分子標(biāo)記試驗(yàn),采用SSR引物SiGMS462對(duì)所提取的谷子核酸進(jìn)行擴(kuò)增。從圖4可以看出,擴(kuò)增產(chǎn)物的電泳條帶清晰,多態(tài)性顯著。表明新方法提取的DNA能夠滿足SSR等分子標(biāo)記檢測(cè)對(duì)DNA質(zhì)量與數(shù)量的要求。
3 討論與結(jié)論
隨著谷子基因組測(cè)序的完成,谷子分子標(biāo)記開(kāi)發(fā)與檢測(cè)成為當(dāng)前的研究熱點(diǎn)。作為谷子分子標(biāo)記檢測(cè)的第1步,核酸提取的結(jié)果直接影響下游試驗(yàn),因此,找到一套簡(jiǎn)便、高效的DNA提取方法很有必要[11-13]。近年來(lái),人們對(duì)于谷子基因組DNA提取方法進(jìn)行了大量的研究,如堿處理法[14]、高溫水煮法[15]、SDS 一步法[16]、TE 研磨法[17]等,這些提取方法速度快、成本低,避免使用液氮研磨、苯酚等有毒化學(xué)試劑,甚至將破碎后的提取液直接作為模板,但都存在所得DNA質(zhì)量不穩(wěn)定,無(wú)法保證后續(xù)分子檢測(cè)的準(zhǔn)確性[18-20]。并且所用材料多為谷子的幼葉,需要加入β-巰基乙醇等防止氧化,對(duì)人體以及環(huán)境會(huì)造成一定程度的危害[21-22]。
本試驗(yàn)直接以谷子干種子為材料進(jìn)行DNA提取,無(wú)需經(jīng)過(guò)3~7 d的發(fā)苗期,無(wú)需液氮研磨,直接通過(guò)機(jī)械研磨破碎細(xì)胞壁,減少了核酸在異丙醇中的沉淀時(shí)間,提取過(guò)程簡(jiǎn)便、高效。同時(shí)無(wú)需加入苯酚、β-巰基乙醇等對(duì)人體有害的試劑,所獲DNA能夠滿足SSR等分子檢測(cè)試驗(yàn)的需求,為實(shí)現(xiàn)谷子高通量分子檢測(cè)奠定了基礎(chǔ)。
參考文獻(xiàn):
[1]周晶,曾慶濤,劉銓義,等.一種適用于棉花種子的DNA快速提取方法[J].作物雜志,2014(2):31-33.
[2]魏琦超,暢麗萍,周巖,等.利用改良CTAB法提取小麥干種子總 DNA[J].山西農(nóng)業(yè)科學(xué),2009,37(6):30-32.
[3]王惠,郭峰,關(guān)超,等.適用于SSR分析的半粒水稻干種子DNA快速提取[J].科技導(dǎo)報(bào),2013(25):58-60.
[4]田麗波,谷幸幸,商桑,等.苦瓜基因組DNA的提取及ISSR擴(kuò)增體系的優(yōu)化[J].中國(guó)農(nóng)學(xué)通報(bào),2013,29(4):88-93.
[5]韓玉杰,賈煒瓏,王自霞,等.幾種提取植物DNA方法的比較[J].山西農(nóng)業(yè)科學(xué),2008,36(7):17-19.
[6]凌莉,李志勇,黃韻,等.食品中植物基因組DNA提取純化方法研究進(jìn)展[J].食品科技,2012(5):6-10,15.
[7]張換樣,李靜,南芝潤(rùn),等.甘薯DNA的小量快速提取[J].山西農(nóng)業(yè)科學(xué),2009,37(1):12-14.
[8]戴劍,洪德林,張大棟,等.一種快速高效的DNA提取方法研究[J].麥類作物學(xué)報(bào),2011(3):437-442.
[9]龔雙軍,楊立軍,劉輝,等.1種小麥白粉病菌DNA基因組的微量簡(jiǎn)捷提取方法[J].微生物學(xué)雜志,2011(1):24-27.
[10]顏松.藥用植物基因組DNA提取及鐵皮石斛RAPD反應(yīng)體系的優(yōu)化[D].重慶:西南交通大學(xué),2009.
[11]張曉祥,王玲,壽路路.一種快速提取小麥基因組DNA的改良CTAB 方法[J].中國(guó)農(nóng)學(xué)通報(bào),2012,28(36):46-49.
[12]許明,程祖鋅,黃志偉,等.一種適于轉(zhuǎn)基因水稻PCR檢測(cè)的微量 DNA 快速提取法[J].生物技術(shù)通報(bào),2010(3):128-130.
[13]王蘭,龍?jiān)沏懀瑒⒁?一種用于PCR的植物基因組DNA快速制備方法[J].分子植物育種,2009,7(2):425-428.
[14]樓巧君,陳亮,羅利軍.三種水稻基因組DNA快速提取方法的比較[J].分子植物育種,2005(5):749-752.
[15]任海龍.藥用植物大黃種子基因組DNA的提取方法研究[J].山西農(nóng)業(yè)科學(xué),2018,46(3):325-327,349.
[16]劉風(fēng)路,張金麗,李靖,等.西南地區(qū)榧樹(shù)屬植物3種不同總DNA 提取方法的比較分析 [J].天津農(nóng)業(yè)科學(xué),2018,24(3):1-4.
[17]文靜,謝培,孫琛,等.珠子參新鮮和干燥塊莖DNA提取方法的比較研究[J].陜西農(nóng)業(yè)科學(xué),2018,64(2):1-3,11.
[18]盛鷗,張玉娥,鄧貴明,等.香蕉不同組織的基因組DNA制備方法的比較[J].分子植物育種,2017,15(12):5052-5059.
[19]董永軍,王陸軍,郝建平,等.玉米干種子基因組DNA提取方法的改進(jìn)[J].山西農(nóng)業(yè)科學(xué),2017,45(12):1903-1906.
[20]王瑞云,劉笑瑜,王海崗,等.用高基元微衛(wèi)星標(biāo)記分析中國(guó)糜子遺傳多樣性[J].中國(guó)農(nóng)業(yè)科學(xué),2017,50(20):3848-3870.
[21]閆玖英,馬長(zhǎng)青,常博,等.改良CTAB法用于蘋(píng)果果實(shí)基因組DNA 的提取[J].分子植物育種,2017,15(9):3610-3615.
[22]曾巧英,凌秋平,胡斐,等.5種提取方法對(duì)甘蔗汁中DNA提取的效果[J].安徽農(nóng)業(yè)科學(xué),2017,45(25):136-138,152.

