肉鴨消化道酵母益生菌膽酸鹽耐受性及其機理研究
劉 瓊, 羅青平, 左家華, 王學東,胡駿鵬, 段勝浩, 鄭紅生,胡先勤*
(1.武漢輕工大學,湖北武漢 430023;2.農業部畜禽細菌病防治制劑創制重點實驗室,湖北武漢 430064;3安琪酵母股份有限公司,湖北宜昌443003;4.武漢永生鴨業有限公司,湖北武漢 430077)
膽酸鹽是膽汁中由膽固醇衍生而來的,是人和動物體中具有甾核結構的一類兩性大分子,肉鴨腸道中膽酸鹽的濃度約為0.3%,其對于腸道菌群如釀酒酵母菌、乳酸桿菌的生存和生長具有抑制作用(Adebola 等,2014)。 García-Hernández 等(2012)對雞排泄物中的酵母益生菌進行耐膽酸鹽試驗發現,部分釀酒酵母菌能夠耐受0.3%~0.6%的膽酸鹽濃度。由此可見,在消化道正常膽汁濃度下,酵母益生菌具有良好的抗膽酸鹽能力。海藻糖是一類非還原性的二糖(Jules,2008),是酵母細胞在應對外界環境變化時,保護自身所形成的一種具有高抗性的應激狀態物質,在生物圈內的表達無所不在。其由兩個葡萄糖分子經過α1-1糖苷鍵相連,具有其他糖類所不具有的一系列特殊的物理特征,如高親水性和化學穩定性,不形成分子內氫鍵。當酵母細胞處于高濃度膽酸鹽環境中時,細胞內鹽濃度變化,會引起蛋白質變性、改變細胞膜構造等危害酵母細胞生長代謝的變化。海藻糖對酵母細胞處于高濃度膽酸鹽環境中的保護機理可能是由于其具有很強的水分子束縛能力,使得膜蛋白的親水性部分與水結合,最終防止了酵母細胞膜的變性(Argüelles,2000)。 本試驗旨在從肉鴨消化道內分離篩選出的7株釀酒酵母中,通過高濃度膽酸鹽應激處理選取高抗性菌株,并探究高濃度膽酸鹽與酵母細胞質膜ATPase活性及胞內海藻糖積累量的相關性,為開發高抗性、專一型的酵母益生菌制劑奠定基礎。
1 材料與方法
1.1 材料
1.1.1 樣品來源 本實驗室從肉鴨腸道分離保存的7株釀酒酵母(張霞等,2015)。
1.1.2 培養基 瓊脂培養基、YPD培養基均為國產。
1.1.3 試劑 GENMED Bradford蛋白質濃度定量試劑盒 (Genmed Scientifics INC.U.S.A),GEN-MED酵母ATP酶(ATPase)活性酶連續反應光譜法定量檢測試劑盒 (Genmed Scientifics INC.U.S.A),牛膽鹽、三氯乙酸、硫酸、蒽酮等均為國產。
1.2 試驗方法
1.2.1 酵母菌的培養 將7株釀酒酵母分別接種于YPD培養基中,28℃、150 r/min 2次培養(以獲得第二代酵母細胞)至對數期(107~108cfu/mL)。1.2.2 酵母菌膽酸鹽耐受性 取適量制備好的菌懸液,在600 nm波長處用液體YPD培養基調節其OD值為 (0.8±0.02), 在膽鹽濃度為0%、0.30%、0.60%(牛膽鹽,Solarbio,中國)的液體YPD中培養24 h后,參考國標GB4789.15-2010,計算其存活率,計算公式為:
S/%=[(cfu/mL)YPD+膽鹽×100]/(cfu/mL)YPD。
1.2.3 酵母菌細胞膜ATPase活性測定 取10 mL待測的新鮮真菌/酵母細胞 (OD600=0.4~0.8),移入到預冷的15mL錐形離心管中,置于冰槽中5min,離心(1000 g,4 ℃,5 min),抽去上清液,加入 250 μL GENMED裂解液,充分混勻,移入預冷的1.5 mL離心管中,加入100 mg GENMED強化液,強力渦旋振蕩15 s,置于冰槽中1 min(重復五次),加入250μLGENMED裂解液,充分混勻,離心(16000 g,4℃,15 min),移取500μL上清液到新的預冷的1.5 mL離心管,移取10μL進行蛋白定量檢測(使用GENMED Bradford蛋白質濃度定量試劑盒-MS30030.1)。移取730μL GENMED緩沖液到新的比色皿,加入20μL ENMED酶促液,100μL GENMED反應液,100μL GENMED底物液,放進28℃培養箱里靜置3 min,加入50μL待測樣品,混勻,即刻放進分光光度儀檢測:340 nm讀數0~30 min。樣品ATPase活性計算公式為:
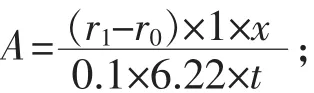
式中:A 為樣品活性,mg;r1為樣品讀數;r0為背景讀數;為x為樣品稀釋倍數;6.22為毫摩爾吸光系數;t為反應時間,min。
1.2.4 酵母細胞胞內海藻糖含量測定 精確稱取鮮酵母0.1 g(稱準至0.0002 g)于離心管中,加入4.0 mL 0.5 mol/L三氯乙酸溶液于振蕩器振蕩混勻后置于帶有冰塊的冰水中,每15 min振蕩一次,共1 h,于離心機3000 r/min離心5 min,將上清液倒入50 mL容量瓶中,用冰水洗滌離心管及沉淀,振蕩混勻后,再放如高速離心機中3000 r/min離心5 min,將上清液倒入50 mL容量瓶中,然后用冰水稀釋至刻度,搖勻。于50 mL容量瓶中加入4.0 mL 0.5 mol/L三氯乙酸溶液,用冰水稀釋至刻度,搖勻,作為空白溶液。吸取空白及樣品1.00 mL于兩個潔凈干燥的試管中,再分別精確加入蒽酮試液5 mL,振蕩搖勻,沸水浴中反應時間為10 min,拿出立即將樣液溫度冷卻至室溫,再次搖勻,放于分光光度計630 nm處,用1 cm比色皿測定吸光度,以空白作對照。試驗樣品中海藻糖積累量的計算公式為:
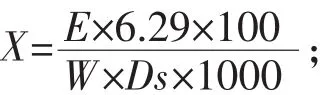
式中:X為試樣中海藻糖的百分含量,%;E為試樣的吸光度;6.29為當E=1時,每毫升溶液中含海藻糖的質量,mg;W試樣質量,g;Ds為試樣干物質的百分含量,%。
2 結果和分析
2.1 不同膽酸鹽濃度環境培養酵母菌存活率通過高濃度膽酸鹽沖擊試驗,采用平板涂布計算釀酒酵母在不同膽酸鹽濃度環境的存活率,結果發現7株釀酒酵母均可在高濃度膽酸鹽環境中生長,7株菌株的存活率都隨膽酸鹽濃度的增加而減小,釀酒酵母培養環境膽酸鹽濃度對酵母生長有顯著影響,不同酵母菌株對環境膽酸鹽耐受性有差異(表1)。且Y-2、Y-6和Y-7三株釀酒酵母菌株在不同膽酸鹽濃度環境中的存活率均高于其他菌株。
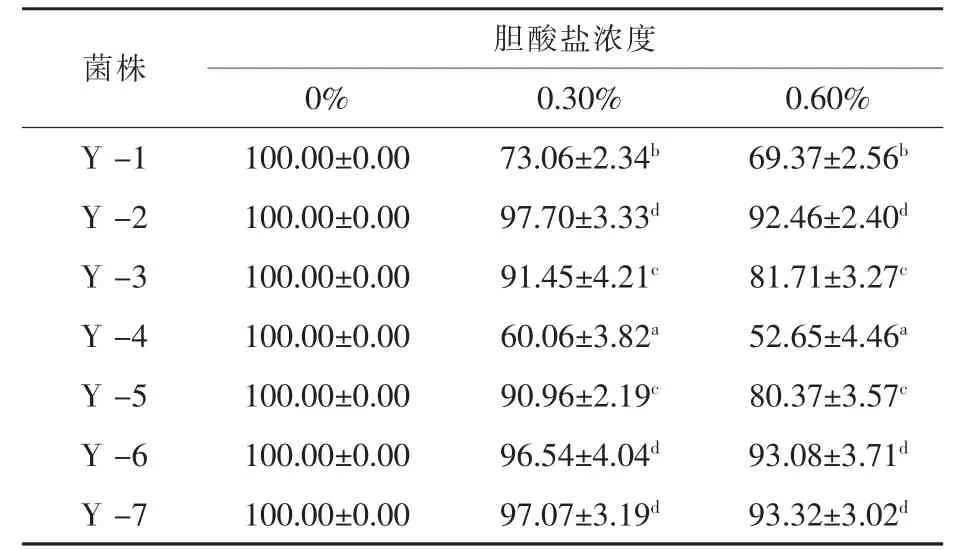
表1 不同膽酸鹽濃度環境中菌株的存活率%
2.2 不同膽酸鹽濃度環境中酵母菌細胞膜ATPase活性 酵母細胞質膜ATPase屬于膜結合蛋白,高濃度膽酸鹽脅迫下,酵母細胞質膜結構及其穩定性發生變化從而影響ATPase活性。酵母細胞處于高濃度膽酸鹽脅迫環境中時,通過加強細胞質膜ATPase活性,促進Na+/H+的逆向轉運,從而避免細胞內膽酸鹽濃度過高,保護其細胞免受惡劣外界環境的損害。從表2可知,7株釀酒酵母細胞質膜ATPase活性隨著膽酸鹽的濃度增加而增加,在膽酸鹽的濃度為0.3%時該酶活性增長較快,隨著膽鹽濃度繼續增加,酶活性增加幅度變小。且Y-2、Y-6和Y-7這3株菌株在高濃度膽酸鹽環境培養時的ATPase活性均高于其他菌株,這一結果與其細胞存活率試驗結果一致,因此認為,酵母細胞質膜ATPase在維持其細胞結構的穩定中起到重要作用。由于高濃度膽酸鹽環境下酵母菌株存活率降低,但其ATPase活性增加,推斷是由于存活的釀酒酵母細胞在處于高濃度膽酸鹽環境中時,其細胞質膜ATPase表達量增加所致。
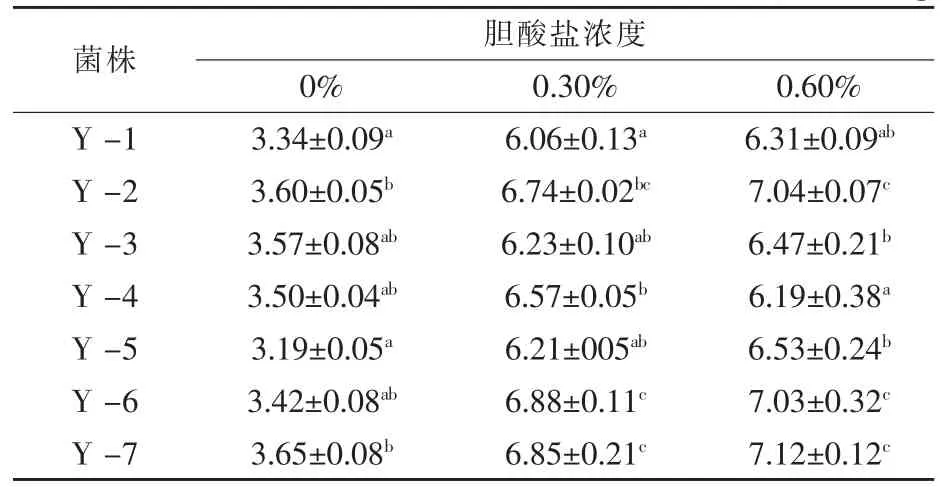
表2 7株酵母不同膽酸鹽濃度培養24 h后細胞質膜ATPase活性 μmol/mg
2.3 不同膽酸鹽濃度環境中酵母菌株胞內海藻糖含量 海藻糖不僅是釀酒酵母中重要的貯藏性碳源,還對細胞生物膜、蛋白質、核酸等大分子物質結構的穩定性起到重要的作用 (張和笙等,1999)。在惡劣的環境中,海藻糖可以保護酵母細胞的結構,這得益于其獨特的物理性質 (咼于明等,2014)。海藻糖的含量對高濃度膽酸鹽條件下酵母的存活率起著至關重要的作用 (黃國宏等,2007)。從表3可知,7株釀酒酵母胞內海藻糖積累量隨膽酸鹽濃度的增加而降低,但膽酸鹽耐受性較好的菌株其胞內海藻糖積累量始終高于耐受性較差的菌株,說明酵母細胞內的海藻糖確實對其細胞處于高濃度膽酸鹽環境中起到一定的保護作用,隨著酵母細胞生長環境膽酸鹽濃度的增加,其胞內海藻糖積累量降低,可能是由于酵母細胞處于高濃度膽酸鹽環境中時部分酵母細胞死亡所致。供試的7株釀酒酵母菌株Y-2、Y-6和Y-7胞內海藻糖積累量始終高于其余幾株,這與其細胞存活率試驗結果一致。
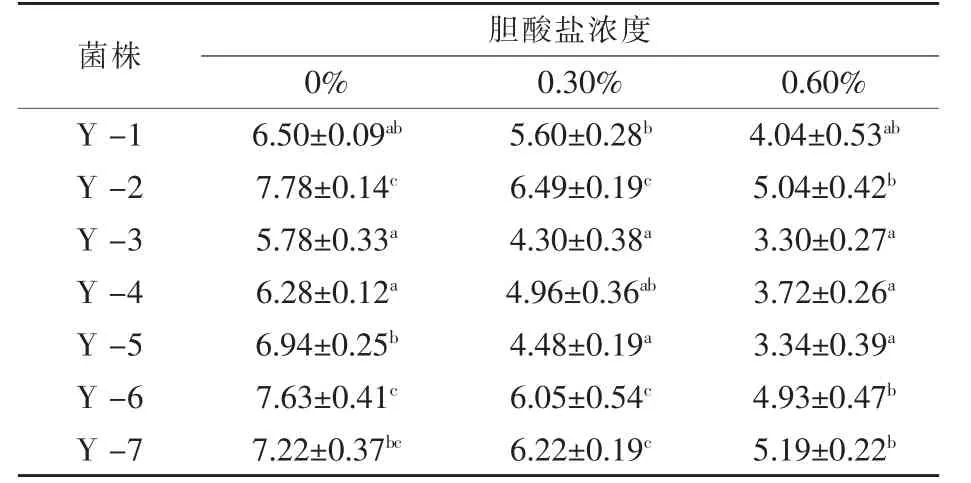
表3 釀酒酵母在不同膽酸鹽濃度培養24 h后胞內海藻糖積累量%
3 討論
動物消化道高濃度膽酸鹽環境對釀酒酵母生長具有抑制損害作用,但部分釀酒酵母具有良好的膽酸鹽耐受性(王繼花,2008)。本試驗對肉鴨消化道分離出的7株釀酒酵母進行高濃度膽酸鹽沖擊試驗,研究了7株肉鴨原籍酵母菌株的膽酸鹽耐受性,并對其可耐受高濃度膽酸鹽環境的機理進行了初步探討。7株釀酒酵母菌株均可在高濃度膽酸鹽環境中生長,其存活率隨膽酸鹽濃度的增加而減小,不同酵母菌株對環境膽酸鹽耐受性有差異。這可能是由于酵母生長環境中高濃度的膽酸鹽對酵母細胞結構產生破壞,導致耐受性較差的酵母菌生長繁殖受到抑制甚至死亡。
關于釀酒酵母細胞膽酸鹽耐受性機理研究中,有研究證實,當酵母細胞長期處于不利于自身生長的惡劣環境條件中時,其細胞內物質含量及組分往往會發生明顯變化(Bonhivers等,1998)。本試驗對酵母細胞質膜ATPase活性和胞內海藻糖積累量進行分析發現,7株釀酒酵母細胞質膜ATPase活性與其生長環境膽酸鹽濃度呈負相關,因此推斷隨環境膽酸鹽濃度的增加,釀酒酵母細胞質膜ATPase大量表達,通過其自身構象的變化保證了酵母細胞內離子的平衡,但隨著膽酸鹽濃度的增加,由于酵母細胞膜遭到破壞而死亡,其ATPase活性增加幅度變小。7株釀酒酵母胞內海藻糖積累量與其生長環境膽酸鹽濃度呈正相關,說明酵母細胞處于高濃度膽酸鹽環境中時,其細胞結構遭到破壞大量死亡,但其存活率較高的菌株海藻糖含量也較高,因此推斷,釀酒酵母細胞處于高濃度膽酸鹽環境中時海藻糖對其細胞起到了保護作用。Y-2、Y-6和Y-7三株菌株細胞質膜ATPase活性與其胞內海藻糖積累量變化均與其存活率結果一致。
4 結論
肉鴨消化道酵母菌株的膽酸鹽耐受性存在差異,不同菌株的膽酸鹽耐受性與其細胞質膜ATPase活性和胞內海藻糖積累量密切相關。本研究中Y-2、Y-6和Y-7三株釀酒酵母菌株的膽酸鹽耐受性較其余幾株釀酒酵母菌株的膽酸鹽耐受性佳,可作為后續開發肉鴨專用飼用酵母益生菌的備選菌株。
參考文獻
[1]黃國宏,李科德,曾慶孝.酵母葡聚糖的制備及其理化性質研究[J].食品與發酵工業,2007,8:108 ~ 112.
[2]王繼花.鹽脅迫下釀酒酵母生理生化特性的研究:[博士學位論文][D].遼寧:大連工業大學,2008.
[3]咼于明,劉丹,張炳坤.家禽腸道屏障功能及其營養調控[J].動物營養學報,2014,10:3091 ~ 3100.
[4]張和笙,梁衛紅.淺論鎂離子對啤酒發酵的影響[J].釀酒科技,1999,1:43 ~ 44.
[5]中華人民共和國國家技術監督局.GB4789.15[S].中華人民共和國衛生部.北京:中國標準出版社,2010-03-26.
[6]張霞,王學東,李彪,等.肉鴨消化道酵母益生菌的分離與鑒定[J].飼料工業,2015,22:59 ~ 64.
[7]Adebola OO,Corcoran O,Morgan WA.Synbiotics:the impact of potential prebiotics inulin,lactulose and lactobionic acid on the survival and growth of lactobacilli probiotics[J].Journal of functional foods,2014,10:75 ~ 84.
[8]Argüelles J C.Physiological roles of trehalose in bacteria and yeasts:a comparative analysis[J].Archives of Microbiology,2000,174(4):217 ~ 224.
[9]Bonhivers M,Carbery JM,Gould SJ,et al.Aquaporinsin Saccharomyces genetic and functional distinctions between laboratory and wild-typestrains[J].Biol.Chem,1998,273 (42): 27565 ~ 27572.
[10]García-Hernández Y,Rodríguez Z,Brandao L R,et al.Identification and in vitro screening of avian yeasts for use as probiotic[J].Res Vet Sci,2012,93(2):798 ~ 802.
[11]Jules M.New insights into trehalose metabolism by Saccharomyces cerevisiae:NTH2 encodes a functional cytosolic trehalase,and deletion of TPS1 reveals Ath1p-dependent trehalose mobilization[J].Appl Environ Microbiol,2008,74(3):605 ~ 614.

