tumstatin基因修飾巨核細胞聯合化療抑制肺腺癌小鼠皮下移植瘤生長
王章飛,羅以勤,李 娟,婁 蓉
化療是惡性腫瘤臨床治療的常用方法之一,而多數化療藥易引起患者骨髓抑制使患者血小板減少,臨床上為提高患者耐受常預防性或治療性地輸注血小板。然而,多數研究[1-2]表明血小板活化后釋放的細胞因子能促進腫瘤新生血管形成,最終促進腫瘤的生長和轉移,使患者預后較差。tumstatin是一種近些年發現的內源性血管生成抑制因子,可通過功能性受體特異性地誘導血管內皮細胞凋亡、抑制其增殖,降低了新生血管的生成,從而使腫瘤生長得到抑制[3]。該研究在攜帶tumstatin基因的慢病毒轉導CD34+細胞經體外擴增培養后生成有抗血管生成作用的巨核細胞/血小板[4]和非肥胖糖尿病/重癥聯合免疫缺陷(non-obese diabetic/server combined immune-deficiency, NOD/SCID)鼠體內產生有抑制血管形成且保持正常聚集功能的血小板研究基礎上[5],建立NOD/SCID小鼠A549細胞肺腺癌移植瘤模型, 體內研究tumstatin轉基因巨核細胞聯合化療藥GEM對腫瘤的抑制作用和小鼠生存率的影響。
1 材料與方法
1.1主要材料NOD/SCID鼠24只, ♀, 體質量(19±1) g, 清潔級,購自上海斯萊克實驗動物有限公司。A549肺腺癌細胞株購自中國科學院上海生命科學研究院細胞中心。NK細胞抑制劑anti-asialo GM1購自美國BioLegend公司;GEM購自江蘇豪森藥業股份有限公司;鼠抗人CD31 mAb購自北京中杉金橋生物技術有限公司;巨核細胞體外誘導培養基購自加拿大STEMCELL公司;CD34磁珠購自德國Miltenyi Biotec公司;tumstatin轉基因巨核細胞由安徽省立醫院輸血科細胞培養室制備。
1.2方法
1.2.1A549細胞培養 肺腺癌A549細胞培養于含100 ml/L胎牛血清、1×105U/L鏈霉素和1×105U/L青霉素的RPMI-1640培養液中, 在37 ℃、50 ml/L CO2培養箱內常規傳代培養。
1.2.2tumstatin轉基因巨核細胞的制備 參照文獻[4],從新生兒臍帶血中分離單個核細胞,用免疫磁珠法篩選CD34+細胞,用攜帶tumstatin的慢病毒轉染CD34+細胞,用STEMCELL無血清培養基,在前面實驗的基礎上選用STEMCELL擴增效率更高的組合細胞因子在37 ℃、50 ml/L CO2培養箱內常規傳代培養,培養1周后計算轉染效率。以表達ZsGreen 綠色熒光的細胞為轉染陽性細胞,統計同一視野下轉染陽性細胞數和總細胞數;轉染效率=ZsGreen 陽性細胞數/總細胞數×100%。CD41a是巨核細胞和血小板的特異性抗體,在體外擴增第11天流式分析CD34-CD41a+的表達,將培養細胞進行涂片并瑞氏染色觀察細胞形態。輸注到小鼠體內的巨核細胞均為體外擴增培養11~15 d的巨核細胞。
1.2.3肺腺癌模型的制作及給藥 取對數生長的A549細胞, 計數1×106的細胞懸浮于0.2 ml生理鹽水中皮下注射到小鼠背部,植入后約第45天提取腫瘤,去除壞死組織和非癌組織后,將癌細胞癌組織切成大小約2 mm× 2 mm的小塊懸浮于生理鹽水中,以0.2 ml/只皮下注射到NOD/SCID小鼠背部。待瘤體直徑大于5 mm[6]以后將小鼠隨機分為4組(每組6只):生理鹽水對照組(A組,對照組)、GEM化療組(B組,單純化療組)、GEM聯合巨核細胞組(C組)、GEM聯合tumstatin轉基因巨核細胞組(D組);其中B、C、D三組為治療組。各治療組第1、3、5天腹腔注射60 mg/g的GEM,第2、4、6天C、D組分別經尾靜脈注射巨核細胞和tumstatin轉基因修飾巨核細胞5×105/只,輸注巨核細胞同時輸注20 μl asialo GM1 抗血清(自然殺傷細胞抑制劑),生理鹽水對照組每天注射等量的生理鹽水,上述6 d 為一個療程, 給藥4個療程,共24 d 。治療期間,每3 d 測量1次腫瘤體積和小鼠質量,繪制腫瘤生長曲線。在治療的第15天對各組活著的小鼠眼眶取血0.5 ml,用希森美康xs-800i血細胞分析儀進行分析。治療第24天小鼠以頸椎脫臼法處死, 剝離出瘤體, 剔除多余的結締組織, 測量瘤體的長徑和短徑并稱重,以40 g/L甲醛溶液固定瘤體, 石蠟包埋, 以3 μm厚度連續切片。治療期間記錄小鼠生存情況,繪制各組小鼠生存曲線。
1.2.4評估抗腫瘤活性 通過監測腫瘤生長速率評估抗腫瘤活性,并使用游標卡尺測量腫瘤大小,腫瘤大小用二維尺度測定,用下式計算:腫瘤體積=π/6×(長徑×短徑2),取腫瘤體積平均值,繪制腫瘤生長曲線。抑瘤率以T/C值進行計算。T/C值是抗腫瘤功效的重要指標,T/C值<0.42,認為有效[7]。
1.2.5HE染色 取腫瘤蠟塊,低溫處理后以最大面積做3 μm厚度切片, 蘇木精—伊紅(HE)染色法處理后,在100倍光學顯微鏡下尋找壞死面積最高區域, 200倍光學顯微鏡下隨機選3個視野進行拍照, 觀察腫瘤組織壞死情況。
1.2.6SP免疫組織化學染色 取腫瘤蠟塊,3 μm切片, 二甲苯脫蠟, 梯度酒精脫水,常規免疫組化步驟,微血管密度(microvessel density,MVD)計數參照Weidner法[8]: ① 以血管內皮細胞染成棕黃色或棕色為CD31陽性; ② 切片在100倍光學顯微鏡下觀察MVD最高區域, 200倍光學顯微鏡下選擇不重復視野計數十個視野CD31陽性的微血管數, 取平均值作為MVD。
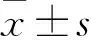
2 結果
2.1tumstatin轉基因巨核細胞慢病毒感染的CD34+造血干細胞熒光顯微鏡分析、計算得出細胞轉染陽性率為91.2%。流式分析顯示在體外擴增第11天,CD34-CD41a+達到62.3%。瑞氏染色形態學分析顯示tumstatin轉基因細胞呈現出典型的巨核細胞形態,胞質內充滿大小不等的紫紅色顆粒或血小板,細胞周圍可見有血小板堆集;表明轉基因的表達并不影響CD34+細胞誘導分化為巨核細胞和血小板,見圖1。

圖1 綠色熒光蛋白ZsGreen在轉染細胞的表達及CD34+誘導分化巨核細胞流式圖和形態學鑒定圖
A:轉染并換液72 h后光學顯微鏡觀察結果×100;B:換液后72 h熒光顯微鏡下觀察轉染結果×100;C:轉染后細胞第11天CD34和CD41a表達率;D:轉染后的巨核細胞和血小板×1 000
2.2聯合治療對肺腺癌皮下腫瘤的抑制作用給藥前,游標卡尺測量并計算出的各組肺腺癌小鼠皮下移植瘤體積大小無明顯差異。經腹腔和尾靜脈給予GEM和轉基因、非轉基因巨核細胞以后, 治療組較對照組均出現不同程度的抑制作用,見圖2,生長曲線表明生理鹽水對照組在24 d 內顯示出連續的腫瘤體積增加,第15天以后出現快速生長,對各組生長曲線進行回歸分析發現A組生長最快(生長速率k=0.010 57 cm3/d),見圖3A。GEM組(生長速率k=0.004 626 cm3/d)和GEM聯合巨核細胞組(生長速率k=0.006 244 mm3/d)皮下腫瘤生長到18 d和24 d,顯示出相對緩慢的回歸,但前期作用不明顯,而GEM聯合tumstatin轉基因巨核細胞組(生長速率=0.002 589 cm3/d)顯示出持續的腫瘤體積抑制達24 d ,表明更高更穩定的療效。
從圖3B可以看出,治療組3組中只有GEM聯合tumstatin轉基因巨核細胞組在20 d 以后T/C值<0.42,顯示出良好的療效。 相比之下,化療組和非轉基因巨核細胞聯合組顯示的T/C值在大多數時間點遠遠超過0.42,表明療效相對較差。

圖2 小鼠給藥前和給藥后腫瘤大小
2.3聯合治療提高血細胞值及單純化療小鼠生存率GEM給藥前,各組小鼠的體質量均為(19±1)g,毛發平順,活動能力(攀爬、移動)強,給藥1周后開始出現體重下降、毛發勃起、活動力減弱、脫毛,其中單純化療組脫毛和體重減輕最明顯,而生理鹽水組小鼠體質量、毛發等并無明顯變化。給藥15 d 后眼眶取的血用血細胞分析儀進行分析發現,B組外周血中三系細胞顯著減少,血小板遠低于A組(P<0.01)。C、D組的白細胞遠高于A組,血小板較未添加巨核細胞的B組有明顯提高(P<0.01),而紅細胞略低于生理鹽水組,見表1,在給藥18 d時B組小鼠全部死亡,D組還有部分存活,見圖3,對比單純化療組小鼠的生存率得到顯著提高(P<0.05)。

表1 第15天小鼠血細胞值
與A組比較:**P<0.01;與B組比較:##P<0.01

圖3 小鼠皮下腫瘤的生長曲線、T/C值和生存曲線
2.4聯合化療對肺腺癌小鼠腫瘤組織壞死的影響處死小鼠后取出瘤體進行HE染色, 結果顯示, 對照組皮下瘤組織以輕、中度壞死為主, 治療組以中、重度壞死為主, 細胞核萎縮、變形及破碎, 細胞排列稀疏, 以胞質著粉紅色及紫色為主, 腫瘤壞死程度高于生理鹽水組; 其中化療組和巨核細胞聯合化療組以中度壞死為主, 壞死程度略高于對照組,而tumstatin轉基因巨核細胞聯合化療組以重度壞死為主,壞死程度高于其他3組。見圖4。

圖4 各給藥組小鼠瘤體壞死情況 HE×200
2.5聯合化療對肺腺癌小鼠腫瘤微血管形成的影響免疫組織化學測定給藥24 d后的各組移植瘤小鼠皮下MVD(化療組取第18天腫瘤組織), 結果表明, 生理鹽水組腫瘤組織微血管新生最為明顯, 治療組MVD均低于生理鹽水對照組,其中tumstatin轉基因巨核細胞聯合化療組的MVD最低, 其次為GEM化療組(18 d)和巨核細胞聯合化療組, 與生理鹽水對照組比較差異有統計學意義(P<0.01), 且tumstatin轉基因巨核細胞聯合化療組腫瘤微血管新生抑制作用最明顯,見圖5。
3 討論
惡性腫瘤如肺癌,發病率逐年增加,嚴重威脅人類健康,化療是其臨床治療的常用方法之一。但多數化療藥像卡鉑、紫杉醇、GEM等藥物會造成骨髓抑制,導致不同程度的血小板減少,限制了臨床化療藥物的劑量和應用。目前,臨床上主要采取直接血小板輸注進行臨床治療,而血小板對腫瘤生長和轉移具有強烈的促進作用,常引起預后不良[1-2]。

圖5 各組小鼠肺腺癌微血管生長情況 ×200
A:生理鹽水對照組;B:GEM化療組(第18天);C:GEM聯合巨核細胞組;D:GEM聯合tumstatin轉基因巨核細胞組;E:各組小鼠瘤體的MVD;與生理鹽水對照組比較:**P<0.01
已知腫瘤的生長和轉移依賴于新生血管的形成,當腫瘤直徑達到1~2 mm時,血管生成對維持腫瘤生長至關重要[9]。研究[10-11]表明,血管生成調節蛋白大部分被證實貯存在血小板α-顆粒,生理或病理條件下血小板活化釋放多種血管生成調節因子參與調節血管生成,其中促進因子持續地占有主導地位。為此,筆者設想通過攜帶相關基因的慢病毒轉導巨核細胞/血小板前體細胞,經擴增培養生成具有抗血管生成作用的血小板,利用其靶向作用在腫瘤部位釋放血管生成抑制因子治療腫瘤。
tumstatin是來源基底膜Ⅳ型膠原α3鏈C末端非膠原區的內源性新生血管生成抑制因子,分子量為30.54 ku,主要經過MMP-9降解基膜的Ⅳ型膠原α3鏈產生,體內外實驗證明tumstatin是通過特異性結合腫瘤血管內皮細胞表面上調的αvβ3整合素受體(主要是β3),抑制內皮細胞蛋白質合成,最終抑制腫瘤生長和轉移,其抗血管生成能力至少是endostatin的10倍[12]。本研究用tumstatin基因修飾造血干細胞CD34+細胞,在巨核細胞/血小板特異的GpIbα啟動子作用下靶向表達tumstatin,以A549肺腺癌細胞接種較少發生排斥反應及移植物抗宿主病的NOD/SCID小鼠建立的肺腺癌異位移植瘤模型為研究對象。在對小鼠肺腺癌治療過程中連續用化療藥物GEM作用于腫瘤細胞,主動抑制血小板產生,然后輸注基因修飾的巨核細胞,血小板在體內產生并在腫瘤部位活化,釋放目標蛋白,從而達到抗血管生成和化療的聯合作用。結果表明,單純輸注化療藥顯著抑制了小鼠血小板和各項血細胞的產生,而輸注基因修飾的巨核細胞提高了小鼠血小板水平,提高了小鼠生存率,但還是存在一定的排斥反應,白細胞較對照組升高很多。MVD的測定結果表明tumstatin轉基因巨核細胞有很高的抗腫瘤血管新生的作用,這也可能是tumstatin抑制了內皮細胞蛋白質合成,使內皮細胞的凋亡增加從而使腫瘤生長得到抑制。該方法在一定程度上解決了化療藥物的使用引起的患者血小板減少癥和血小板的輸注引起的腫瘤新血管生成增加的弊端,具有基因治療的優勢(如腫瘤治療針對性強,靶向性高和非細胞毒性等)。另外,基因修飾的巨核細胞在體內不能永久生存,因此轉基因巨核細胞的輸注引起人體基因突變概率低,這使基因治療聯合化療在發揮更大的抗腫瘤效果的同時減少了出現不良反應的可能。而對腫瘤細胞具有目標特異性的血小板若采用患者自身分離培養的攜帶目的蛋白作為輸送載體的血小板,可以有效避免機體的免疫排斥反應,具有更高的安全性。同時本研究有一定局限性,選擇的GEM的腫瘤殺傷作用不強,但高度抑制骨髓造血,使小鼠過早死亡,影響了腫瘤轉移的研究,因此tumstatin基因和GEM對抑制腫瘤轉移的作用有待進一步研究。
參考文獻
[1] Apelseth T O, Hervig T, Wentzel-Larsen T, et al. A prospective observational study of the effect of platelet transfusions on levels of platelet-derived cytokines, chemokines and interleukins in acute leukaemia patients with severe chemotherapy-induced cytopenia[J]. Eur Cytokine Netw, 2011, 22(1): 52-62.
[2] Bottsford-Miller J, Choi H J, Dalton H J, et al. Differential platelet levels affect response to taxane-based therapy in ovarian cancer[J]. Clin Cancer Res, 2015, 21(3): 602-10.
[3] Maeshima Y, Sudhakar A, Lively J C, et al. tumstatin, an endothelial cell-specific inhibitor of protein synthesis[J]. Science, 2002, 295(5552): 140-3.
[4] Li J, Luo J, Luo Y Q, et al. Overexpression of tumstatin in genetically modified megakaryocytes changes the proangiogenic effect of platelets.[J]. Transfusion, 2014, 54(8):2106-17.
[5] 任薈蓉, 羅以勤, 李 娟,等. Tumstatin轉基因巨核細胞在NOD/SCID鼠體內產生抗新生血管作用血小板[J]. 安徽醫科大學學報, 2016, 51(4):511-5.
[6] Pranatharthiharan S, Patel M D, Malshe V C, et al. Asialoglycoprotein receptor targeted delivery of doxorubicin nanoparticles for hepatocellular carcinoma[J]. Drug Deliv, 2017,24(1):20-9.
[7] Lorusso P M, Aukerman S L, Polin L, et al. Antitumor efficacy of interleukin-2 alone and in combination with adriamycin and dacarbazine in murine solid tumor systems[J]. Cancer Res, 1990, 50(18):5876-82.
[8] Banerji S, Ni J, Wang S X, et al. LYVE-1, a new homologue of the CD44 glycoprotein, is a lymph-Specific Receptor for Hyaluronan[J]. J Cell Biol, 1999, 144(4):789-801.
[9] Folkman J. Fundamental concepts of the angiogenic process[J]. Curr Mol Med,2003,3(7):643-51.
[10] Italiano J E, Richardson J L, Patelhett S, et al. Angiogenesis is regulated by a novel mechanism: pro-and antiangiogenic proteins are organized into separate platelet α granules and differentially released[J]. Blood, 2008, 111(3):1227-33.
[11] Battinelli E M, Markens B A, Jr I J. Release of angiogenesis regulatory proteins from platelet alpha granules: modulation of physiologic and pathologic angiogenesis[J]. Blood, 2011, 118(5):1359-69.
[12] Maeshima Y,Manfredi M,Reimer C,et al. Identification of the anti-angiogenic site within vascular basement membrane-derived tumstatin[J]. J Biol Chem,2001,276(18):15240-8.

