CormⅡ對膿毒癥血小板α顆粒釋放的影響及作用機制
黃 立 方 強
(浙江大學醫學院附屬第一醫院,浙江 杭州 310003)
膿毒癥可發展為休克和多器官功能障礙綜合征(MODS)。凝血功能紊亂在膿毒癥發病過程中具有重要作用〔1,2〕。血小板是凝血系統的主要功能成分,膿毒癥發病時產生的大量炎癥介質會促進血小板活化,血小板α顆粒(PLT-α)釋放出血小板衍生因子(PDGF)-bb、基質金屬蛋白酶(MMP)-2等活性物質,可進一步加重凝血系統紊亂和炎癥損傷〔3〕。外源性一氧化碳釋放分子(Corm)Ⅱ可將攜帶的一氧化碳釋放入組織氣管中發揮作用〔4〕。相關研究發現,CormⅡ可明顯抑制膿毒癥時大鼠體內血小板的聚集、釋放及體內炎癥反應〔5〕。本研究旨在探討CormⅡ對PLT-α釋放的影響及作用機制。
1 材料與方法
1.1主要試劑 CormⅡ、脂多糖、兔抗人VAMP8單抗購于寶日醫生物技術(北京)有限公司;鼠抗人FITC-CD41單抗、血小板P選擇素單抗、MUNC18a單抗均于上海科華生物工程股份有限公司;兔抗人p-PPKCδ單抗、p-PMUNC18a單抗購于上海捷瑞生物工程有限公司;PDGF-bb、MMP-2試劑盒購于南京森貝伽生物科技有限公司;PKCδ抑制劑LY317615購于美國MCE公司。
1.2模型建立與分組 采集健康供血者空腹外周靜脈血30 ml,抗凝處理后1 500 r/min離心20 min,取上層富含血小板的血漿,隨機分為5組:空白對照組(不作處理)、脂多糖組(10 μmol/L脂多糖誘導)、無活性CormⅡ組(脂多糖和30 μmol/L無活性CormⅡ誘導)、10 μmol/L和30 μmol/L CormⅡ組(10 μmol/L脂多糖誘導的同時給予不同濃度CormⅡ誘導);各組均放入37℃ 5% CO2培養箱中孵育2 h。
1.3檢測方法
1.3.1酶聯免疫吸附法(ELISA)檢測PDGF-bb、MMP-2含量 取各組上清液用ELISA檢測PDGF-bb、MMP-2含量,嚴格按試劑盒說明書操作;讀取酶標儀492 nm波長處吸光度值,計算其濃度。
1.3.2流式細胞術檢測血小板P選擇素表達 取樣品放入流式細胞儀試管中,在終濃度為10%的甲醛溶液固定20 min。向各組中分別加入FITC-CD41、血小板P選擇素單抗,室溫下暗室中反應20 min,流式細胞儀通過單抗免疫標記檢測呈陽性的血小板比例。
1.3.3免疫熒光法檢測PLT-α分布情況 取各組細胞懸液放入2 ml離心管中,4℃ 2 000 r/min離心10 min,棄去上清,下層沉淀為血小板,室溫下10%的低聚甲醛固定30 min。磷酸緩沖液洗滌,標本放于冰上用0.5%曲拉通X-100通透30 min,室溫下用1%牛血清白蛋白(BSA)封閉3 h。滴加兔抗人VAMP8單抗,4℃反應過夜,次日滴加二抗,室溫下暗室中勻速搖晃60 min,磷酸緩沖液洗滌,4℃ 2 000 r/min離心10 min,棄去上清,重懸后在倒置顯微鏡下觀察PLT-α分布。
1.3.4Western印跡法檢測p-PKCδ、p-MUNC18a蛋白表達情況 為進一步探討CormⅡ影響PLT-α釋放的作用機制,增加LY317615組(10 μmol/L脂多糖+100 nmol/L LY317615)、CormⅡ+LY317615組(10 μmol/L脂多糖+30 μmol/L CormⅡ+ 100 nmol/L LY317615)。采集30 ml外周靜脈血,分離得到上層富含血小板的血漿,隨機分為6組,每組含2.5 ml富含血小板的血漿,按上述處理:37℃ 5%CO2培養箱中孵育30 min。收集各組樣品,4℃ 2 000 r/min離心10 min,獲取血小板,加300 μl含磷酸酶、蛋白酶抑制劑的裂解液,冰上裂解40 min。4℃ 10 000 r/min離心10 min,棄去不溶物,測定蛋白濃度。加上樣緩沖液,煮沸10 min,冷藏保存。十二烷基硫酶鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳、轉膜后室溫下封閉3 h,滴加兔抗人p-PKCδ單抗、p-PMUNC18a單抗,4℃孵育過夜,滴加辣根過氧化物酶(HRP)標記的二抗,室溫下孵育3 h。洗滌后電化學發光(ECL)顯色,測定條帶灰度值。
1.4統計學分析 使用SPSS21.0軟件行t檢驗。
2 結 果
2.1CormⅡ對脂多糖誘導后PLT-α內容物釋放的影響 脂多糖誘導后PLT-α釋放的PDGF-bb、MMP-2及血小板P選擇素表達水平均明顯高于空白對照組,差異有統計學意義(P<0.05);無活性CormⅡ組PLT-α內容物釋放及血小板P選擇素表達水平與脂多糖組差異無統計學意義(P>0.05);CormⅡ誘導后,PLT-α釋放的PDGF-bb、MMP-2明顯減少,血小板P選擇素表達水平明顯降低且呈劑量依賴性。見表1。

表1 CormⅡ對脂多糖誘導后PLT-α內容物釋放的影響
與對照組相比:1)P<0.05;與脂多糖組相比:2)P<0.05
2.2CormⅡ對脂多糖誘導后PLT-α分布的影響 VAMP8單抗標記的PLT-α免疫熒光檢測顯示,脂多糖誘導后中央區的PLT-α逐漸向血小板磷脂膜區轉移,與磷脂膜融合后釋放到血小板外;無活性CormⅡ組與脂多糖組PLT-α分布情況相似;CormⅡ誘導后PLT-α向血小板膜匯聚明顯減少。見圖1。
2.3CormⅡ對血小板PKCδ活性的影響 脂多糖誘導后血小板PKCδ磷酸化(p-PKCδ)相對表達量為1.12±0.45,明顯高于對照組的0.55±0.17,差異有統計學意義(P<0.05);無活性CormⅡ組p-PKCδ相對表達量為1.15±0.31,與脂多糖組之間比較差異無統計學意義(P>0.05);LY317615組、CormⅡ組、CormⅡ+LY317615組p-PKCδ相對表達量分別為0.62±0.10、0.67±0.24、0.64±0.05,與脂多糖組和無活性CormⅡ組相比明顯降低,差異有統計學意義(P<0.05)。見圖2。
2.4CormⅡ對血小板MUNC18a活性的影響 脂多糖誘導后血小板MUNC18a磷酸化(p-MUNC18a)相對表達量為2.41±0.28,明顯高于對照組的1.33±0.45,差異有統計學意義(P<0.05);無活性CormⅡ組p-MUNC18a相對表達量為2.48±0.56,與脂多糖組之間差異無統計學意義(P>0.05);LY317615組、CormⅡ組、CormⅡ+LY317615組p-MUNC18a相對表達量分別為1.62±0.49、1.59±0.17、1.40±0.13,與脂多糖組和無活性CormⅡ組相比明顯降低,差異有統計學意義(P<0.05)。見圖3。

圖1 VAMP8單抗標記的各組PLT-α
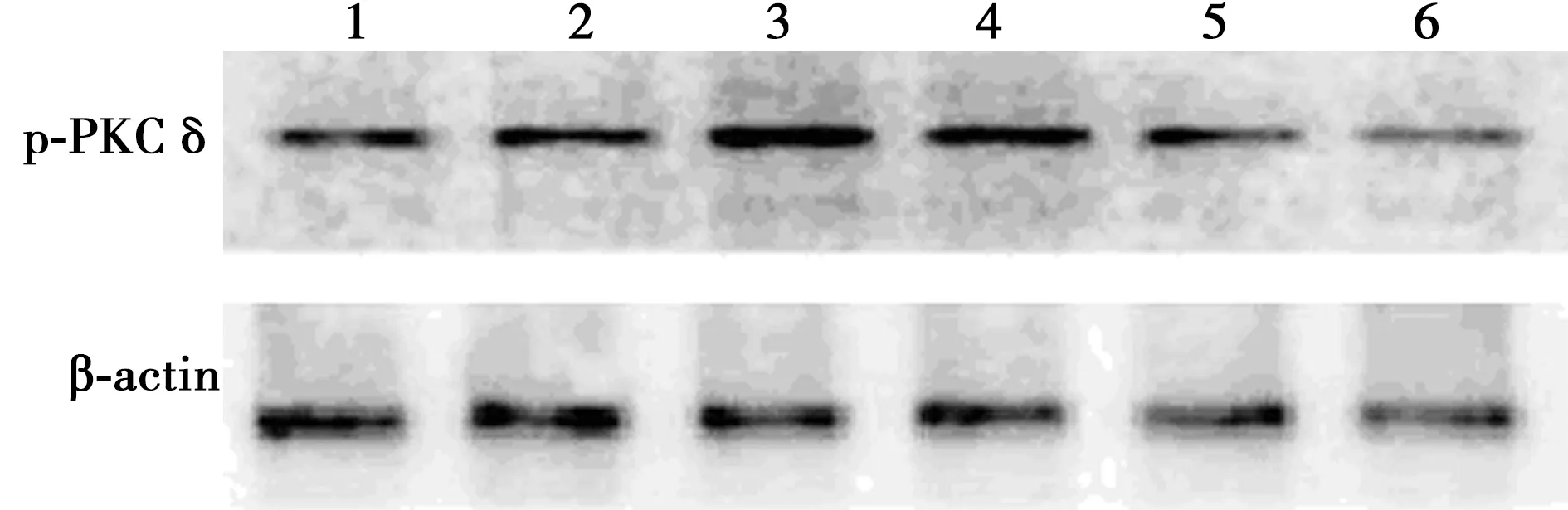
1:對照組;2:LY317615組;3:脂多糖組;4:無活性CormⅡ組;5:CormⅡ組;6:CormⅡ+LY317615組;同下圖圖2 CormⅡ對血小板PKCδ活性的影響

圖3 CormⅡ對血小板MUNC18a活性的影響
3 討 論
膿毒癥發病過程中血小板異常活化具有重要作用,活化過程中還可刺激PLT-α釋放出PDGF-bb、MMP-2、P-選擇素等大量功能性蛋白分子。多種類型的活化分子在加速血小板活化的同時也加重了膿毒癥的炎性損傷〔6〕。動物試驗證實,CormⅡ分泌的一氧化碳可降低脂多糖誘導的血小板聚集、顆粒釋放等異常活化,而單純CormⅡ對血小板生理功能無明顯影響。本實驗結果顯示,PLT-α內容物在脂多糖誘導后釋放水平明顯提升,而CormⅡ干預可明顯降低內容物的釋放量;進一步通過免疫熒光觀察顯示,脂多糖誘導后中央區的PLT-α逐漸向血小板磷脂膜區轉移,與磷脂膜融合后釋放到血小板外,CormⅡ干預可有效緩解上述趨勢。
PKC家族是一種在哺乳動物體內廣泛分布的蛋白激酶,目前共發現10種亞型,血小板中含有α、β、δ 3種亞型。相關研究發現,PKCα、PKCβ是在血小板正常生理功能中發揮正向調節作用,將其敲除后會明顯降低血小板的分泌功能〔7〕;PKCδ主要調控血小板中致密顆粒的釋放,在PLT-α釋放中發揮作用〔8〕。SM蛋白是一系列親水性蛋白分子家族,可參與PLT-α釋放,已發現的釋放相關SM蛋白包括MUNC18a、MUNC18b。其中人和小鼠的血小板中均含有MUNC18a,其參與血小板復合物形成的調控〔9〕。相關基礎研究顯示,MUNC18a是PKCδ主要的下游信號分子,當其活化后能夠將MUNC18a第207位絲氨酸磷酸化,促進PLT-α的釋放〔10〕。本次研究顯示,脂多糖誘導后血小板PKCδ和MUNC18a磷酸化水平均增強,當給予PKCδ特異性抑制劑LY317615和CormⅡ干預后,磷酸化水平受到明顯抑制。提示膿毒癥發病時脂多糖誘導血小板活化,引發血小板中PKCδ磷酸化,其活性增加可進一步磷酸化下游MUNC18a,活化的MUNC18a可促進PLT-α釋放。
綜上,膿毒癥發病時機體中血小板PKCδ/MUNC18a信號通路被激活,誘導PLT-α釋放量增加;通過CormⅡ釋放一氧化碳進行干預,可行PKCδ/MUNC18a通路活化,降低PLT-α釋放,減弱膿毒癥損傷。
4 參考文獻
1樊楚明,楊欣悅,任靖宇,等.老年膿毒癥患者APACHEⅡ評分與降鈣素原及C-反應蛋白的相關性〔J〕.中國老年學雜志,2016;36(2):426-7.
3康秋香.膿毒癥急性肺損傷時HSPA12B對肺血管通透性的影響及其機制〔D〕.上海:第二軍醫大學,2015.
4Campos IA,Ximenes EA,CarvalhoJúnior CHR,etal.Zymomonas mobilis culture protects against sepsis by modulating the inflammatory response,alleviating bacterial burden and suppressing splenocyte apoptosis〔J〕.Eur J Pharmaceuti Sci,2013;48(1/2):1-8.
5李 欣.右美托咪定對膿毒癥大鼠炎癥反應作用及其機制的研究〔D〕.長沙:中南大學,2013.
6Rascher D,Geerlof A,Kremmer F,etal.Total internal reflection (TIRF)-based quantification of procalcitonin for sepsis diagnosis--a point-of-care testing application〔J〕.Biosens Bioelectronics,2014;59:251-8.
7張 旭.膿毒癥肺損傷時對HSPA12B有調控作用的miRNA篩選及其意義〔D〕.上海:第二軍醫大學,2015.
8謝克亮.氫氣對膿毒癥的保護效應及機制研究〔D〕.天津:天津醫科大學,2013.
9孫改霞,劉圣君,趙自剛,等.血管通透性增高發生機制研究進展〔J〕.中國老年學雜志,2016;36(2):487-9.
10陳良宏,戢新平.膿毒性腦病危險因素分析及早期治療〔J〕.北華大學學報:自然科學版,2012;13(6):668-71.

