鐵鎳物質的量比對雙金屬催化劑性能的影響
安曉倩,張古承,張靜,衛陳默,周鵬,徐浩,葉倩,周冠宇,楊富花
?
鐵鎳物質的量比對雙金屬催化劑性能的影響
安曉倩,張古承,張靜,衛陳默,周鵬,徐浩,葉倩,周冠宇,楊富花
(四川大學建筑與環境學院,四川 成都,610065)
采用溶膠?凝膠法制備鐵鎳雙金屬氧化物((Fe-NiO)催化劑以避免均相體系金屬離子污染的問題。制備不同物質的量比的鐵鎳雙金屬催化劑,利用X線衍射(XRD)、X線光電子能譜(XPS)、掃描電子顯微鏡(SEM)、傅里葉變換紅外線光譜(FT?IR)對催化劑表面特性進行表征;同時以鄰苯二甲酸二甲酯(DMP)的降解率為指標衡量其異相催化臭氧(O3)的能力,并且重復使用5次以探究催化劑的穩定性。研究結果表明:制備的上述5種催化劑均表現出優越的催化性能,實驗進行5 min后DMP降解率分別為85.93%,63.33%,83.92%,78.58%和80.93%;投加催化劑后,O3分解率與DMP降解率具有相似的趨勢。Fe-NiO催化劑表面組成主要為Fe3O4,NiFe2O4和NiO;Fe-NiO催化劑微粒主要由0.1~0.3 μm顆粒集聚形成,并產生較多孔洞;Fe-NiO催化劑表面存在表面羥基(—OH),由此推測催化過程主要為多價態金屬元素及—OH共同作用的結果。
高級氧化;異相催化;雙金屬氧化物;臭氧
當今自然水體中的有機污染物越來越復雜,通過傳統的水處理技術難以將其高效降解。同時,某些殘留的有毒物質會對人體的健康產生潛在的威脅。高級氧化技術(AOPs)因能達到高效、快速降解有機物污染物的目的而得以快速發展。近年來,催化臭氧工藝因其對難降解有機物具有高效處理能力以及對水質產生較低的負面影響而得到廣泛關注[1?3]。臭氧催化過程中產生的羥基自由基(?OH)是一種強氧化劑,對大多數有機污染物具有較強的降解能力[4?5],能夠克服單獨臭氧工藝對有機污染物的選擇性問題。這種技術不需要輔助加熱或光照系統,可直接應用于實際水處理工程[6]。ANIPSITAKIS等[7?11]研究發現過渡金屬具有較強的催化臭氧的能力,相對于均相催化,過渡金屬元素氧化物異相催化在保留其催化效能的基礎上避免了金屬離子污染的問題[12]。MURUGANANDHAM等[13]合成的氧化鋅對2?乙氧基乙酸乙酯具有良好的催化降解效果。DONG等[9]將-MnO2作為新型水處理催化劑催化臭氧降解有機污染物,取得良好效果。此外,SONG等[14]探討了不同制備條件對二氧化鈦降解苯酚活性的影響。鐵、鎳、銅、鈷也是較為常用的制備催化劑的過渡金屬元素[15?17]。與單一金屬元素氧化物相比,對雙金屬氧化物的研究相對較少。根據已有文獻報道,在適宜條件下制備的雙金屬氧化物與單一金屬氧化物相比具有更好的催化性能。LI等[18]發現Pd-Ce金屬氧化物異相催化臭氧降解丙酮酸比單一氧化物表現出更加優良的催化活性。同時,REN等[19]發現雙金屬氧化物對過硫酸氫鹽也具有顯著的催化效果。可見,雙金屬氧化物在水處理領域中具有廣闊的應用前景。不同的制備條件對催化劑表面組成以及表面官能團的影響不同[20?22]。本文作者探討制備過程中金屬元素物質的量比對鐵鎳雙金屬氧化物(Fe-NiO)催化劑的影響,以鄰苯二甲酸二甲酯(DMP)為目標物,衡量不同制備條件下催化劑的催化效能。通過X線衍射(XRD)和X線光電子能譜(XPS)表征Fe-NiO催化劑的組成成分以及化學狀態,并且利用傅里葉變換紅外線光譜(FT?IR)探討催化劑表面存在的官能團,采用掃描電子顯微鏡 (SEM)探討其表面形貌特征。
1 設備材料與方法
1.1 實驗材料
DMP 購自西格瑪?奧德里奇(美國);六水硝酸鎳(Ni(NO3)2?6H2O)、九水硝酸鐵(Fe(NO3)3?9H2O)、叔丁醇(TBA)、二水磷酸二氫鈉(NaH2PO4?2H2O)、十二水磷酸氫二鈉(Na2HPO4?12H2O)和亞硫酸鈉(Na2SO3)均購自成都市科龍化工試劑廠(中國成都),以上所有的藥品均為分析純,實驗所用溶液由超純水配制;新鮮雞蛋在當地市場購得(中國成都);反應體系pH由磷酸緩沖液調節。
1.2 催化劑制備
Fe-NiO催化劑利用雞蛋清通過溶膠?凝膠法(sol–gel process)制備[19, 23]。將鐵鎳混合金屬離子溶液緩慢加入雞蛋清中,劇烈攪拌至均勻混合。將混合液置于80℃水浴中加熱形成凝膠,靜置陳化后烘干,在500℃下焙燒得到Fe-NiO催化劑。改變鐵鎳混合液中金屬離子物質的量比,分別為(Fe3+):(Ni2+)= 1:4,1:2,1:1,2:1,4:1(其中,為物質的量,mol),得到不同制備條件下的催化劑。
1.3 實驗過程與分析
催化O3氧化DMP的實驗在平底燒瓶內進行。反應體系水量為500 mL,反應體系溫度為(18±1)℃,磷酸緩沖液調節pH=7.1。O3以干燥O2(純度≥99%)為氣源,通過臭氧發生器(HTU?500SE型,AZCO公司,加拿大)生成,O3的濃度通過紫外可見分光光度計(UV?1800型,美普達儀器有限公司,中國上海) 在波長254 nm處測量[24]。在溶液中加入Fe-NiO催化劑和 DMP溶液瞬間開始計時,取樣時樣品經玻璃纖維濾膜 (孔徑為0.7 μm,Whatman,英國) 過濾后,立即轉移至含有過量Na2SO3溶液的試管中終止反應。
DMP的濃度由高效液相色譜儀 (HPLC,Waters e2695,Waters公司,美國) 分析測定,色譜柱型號為Waters C18(5 μm),檢測器波長為230 nm,流動相為甲醇和純水混合液(甲醇與水體積比為1:1),流量為1.0 mL/min。O3分解實驗體系中不投加DMP溶液,保持其余控制條件一致進行實驗,O3的濃度通過靛藍法利用紫外可見分光光度計進行檢測[25]。
2 結果與討論
2.1 XPS表征
圖1所示為Fe-NiO催化劑的XPS譜。圖1(a)中Fe 2p軌道的結合能710.9 eV和724.8 eV分別對應Fe3O4[26]及NiFe2O4中的Fe的結合能。Fe3O4存在形式為FeO?Fe2O3,即Fe存在+2與+3價態。
圖1(b)中Ni 2p軌道上+3價對應電子結合能為861.4 eV,而855.4 eV與873.4 eV均對應+2價的Ni的電子結合能[27],可見Fe-NiO催化劑表面Fe和Ni化合價均存在+2和+3這2種價態。氧化還原反應的本質為電子的轉移,催化劑中多價態金屬元素的存在會加速轉移過程,從而產生強氧化性自由基[1, 28?29]。

(a) Fe分譜;(b) Ni分譜;(c) O分譜
圖1(c)中O 1s 軌道出現2個峰,其中529.4~ 530.0 eV處的峰對應金屬氧化物中的晶格氧XPS峰,531.25~531.8 eV處的峰則對應催化劑表面的—OH中的氧XPS峰。研究表明表面—OH在催化過程中具有重要作用,是影響催化效率的主要因素之一[30]。表面—OH的存在使金屬離子處于配位不飽和的狀態,進而作為活性位點吸附水溶液中有機污染物,并且與溶解的O3作用引發其鏈式分解,最終導致?OH的生成[31?32]。
總體而言,很難直接通過觀察比較出不同催化劑中峰強度的細微變化,因此,由峰面積計算Fe-NiO催化劑中NiFe2O4,Fe3O4和?OH摩爾分數,結果如表1所示。

表1 不同Fe-NiOx催化劑中NiFe2O4, Fe3O4和—OH摩爾分數
2.2 XRD表征
圖2所示為不同催化劑的XRD譜。從圖2可看出:催化劑表面金屬氧化物主要為Fe3O4,NiFe2O4,Ni2O3和NiO,與XPS表征結果吻合。由圖1(b)發現,當(Fe3+):(Ni2+)由4:1變化至1:4時,Ni的峰強度增強,其中Ni2+增強尤為明顯,表明Fe-NiO催化劑中Ni2+逐漸增多;當(Fe3+):(Ni2+)=1:4時,NiO和NiFe2O4的衍射峰變得更尖銳,表明催化劑結晶程度較好。可見催化劑中Ni2+增加,相應生成的產物NiO和NiFe2O4具有更好的銳化度,衍射峰更強烈。
2.3 FT?IR表征
不同條件制備的催化劑的FT?IR表征結果如圖3所示。由圖3可以看出:催化劑表面具有2個表面羥基(—OH)的吸附峰,首先,在3 425 cm?1處的峰對 應為M—OH (M為Fe或Ni)結構中氫鍵拉伸作用[28],其次,1 628~1 640 cm?1處出現的峰歸因于催化劑表面吸附水的彎曲振動作用。結合表1中—OH摩爾分數分析,制備過程中金屬元素物質的量比的改變并未導致催化劑表面—OH摩爾分數發生顯著變化。此外,600 cm?1附近出現的吸附峰則對應混合金屬氧化物NiFe2O4中四面體位置固有的拉伸振動峰[33],再次表明催化劑中NiFe2O4的存在與XRD和XPS所示結果一致。

n(Fe3+):n(Ni2+):1—1:4;2—1:2;3—1:1;4—2:1;5—4:1。
2.4 SEM表征
圖4所示為不同Fe-NiO催化劑的SEM圖,圖4中5種催化劑均由細小顆粒物組成。由圖4可見:顆粒直徑為0.1~0.3 μm,這些細小顆粒互相集聚從而形成較大的微粒。相較于其他圖像,圖4(b)所示的細小顆粒分布極為均勻,集聚現象更明顯,使Fe-NiO催化劑微粒間空隙較小;圖4(a)所示細小顆粒則形成較為穩固的微觀結構,顆粒集聚形成的微粒互相支撐形成較多的孔洞。

n(Fe3+):n(Ni2+):(a) 1:4;(b) 1:2;(c) 1:1;(d) 2:1;(e) 4:1

n(Fe3+):n(Ni2+):(a) 1:4;(b) 1:2;(c) 1:1;(d) 2:1;(e) 4:1
2.5 Fe-NiOx催化劑的催化性能
加入不同制備條件下所得Fe-NiO催化劑,比較體系中DMP降解情況以分析催化劑的活性,如圖5所示。由圖5可知:當反應體系中不投加催化劑時,反應進行5 min后DMP降解率為38.52%;而投加催化劑后DMP降解率得到顯著提升,Fe-NiO催化劑可顯著提升反應體系的氧化能力,促進目標物DMP降解。在體系中投加(Fe3+):(Ni2+)=1:4的催化劑,DMP降解率達85.93%;相比之下,投加(Fe3+):(Ni2+)=1:2的催化劑,DMP降解率略低,為63.33%,顯然前者的催化性能更優越。
已有研究發現,—OH可能是O3分解為自由基的活性位點,催化劑的催化性能可能與其表面的—OH摩爾分數呈正相關[11, 34]。結合圖1(c)和圖3可知:本研究制備的不同的Fe-NiO催化劑表面均含有—OH。—OH的存在可為O3分解為自由基提供反應場所,從而使DMP降解率較單獨的O3體系得到提升。此外,金屬氧化物的多價態轉換促進界面電子轉移也可能會促進有機物的快速降解[1, 28]。
比較表1 中(Fe3+):(Ni2+)=1:2,(Fe3+):(Ni2+)= 1:4的數據可知,后者—OH相對較少而含有較多NiFe2O4和Fe3O4,但 DMP降解率卻有所提升,表明—OH摩爾分數并不是影響異相催化高級氧化體系氧化能力的主要因素。圖5中(Fe3+):(Ni2+)=1:4與(Fe3+):(Ni2+)=2:1時DMP降解率相差不多,后者含有更多的NiFe2O4和Fe3O4以及較少的—OH,可見雖然金屬元素多價態間轉換會促進高級氧化體系中自由基的生成[19],但也不是決定性因素。異相催化高級氧化過程是一個多種因素共同作用的復雜過程,需要進行更深入研究。
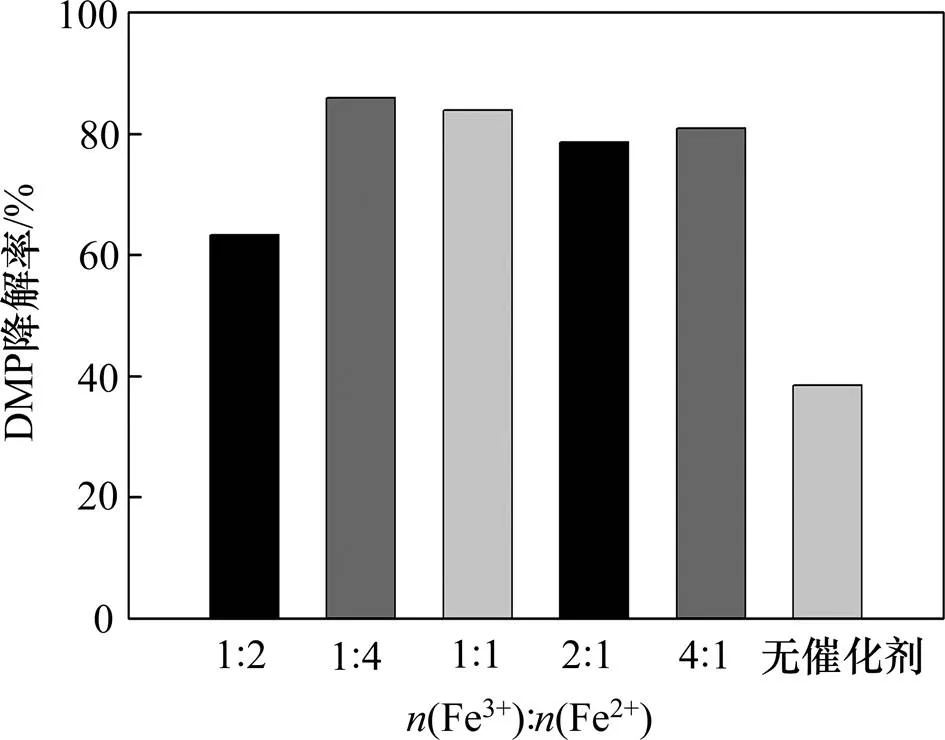
圖5 不同Fe-NiOx催化劑的催化性能
2.6 Fe-NiOx催化劑使用次數對DMP降解的影響
圖6所示為不同Fe-NiO催化劑第2~5次使用、反應5 min后DMP的降解情況。由圖6可知:不同Fe-NiO均具有較穩定的催化性能,5種Fe-NiO催化劑在第2次使用時DMP降解率與圖5相比基本保持不變,分別為61.38%,78.48%,81.32%,78.46%和82.47%。第4次、第5次使用的催化效果出現較明顯下降,但與圖5中不投加催化劑相比仍具有一定的催化活性,表明制備出的催化劑穩定性較強,多次使用仍具有較好的催化效果。

圖6不同使用次數Fe-NiOx催化劑的催化性能
2.7 Fe-NiOx催化劑對O3分解的影響
圖7所示為投加不同Fe-NiO催化劑時O3的分解率。從圖7可以看出:當不投加催化劑時,10 min 后O3分解率僅為22.22%,而投加不同Fe-NiO催化劑后,O3分解率均得到有效提升,并且其變化趨勢與圖5顯示DMP降解率相似,表明體系中DMP的降解主要是因為投加催化劑引起O3分解。
2.8 催化過程中活性物種類
根據文獻報道,叔丁醇(TBA)與O3的反應速率常數為0.03 L/(mol?s),而與?OH的反應速率常數為2.2×108L/(mol?s)[35?37],其可作為?OH的抑制劑,以證明其為O3/Fe-NiO體系中引起DMP降解的氧化物種。選用制備條件為(Fe3+):(Ni2+)=1:4的催化劑進行驗證實驗,結果如圖8所示。由圖8可知:與只投加O3時相比,投加催化劑后,DMP降解率由38.52%提升至85.93%,投加TBA后分別下降至21.68%與24.05%。而只投加Fe-NiO催化劑DMP降解率為3.13%,催化劑的吸附降解可以忽略,可見體系中DMP降解主要是由O3分解產生?OH引起的。
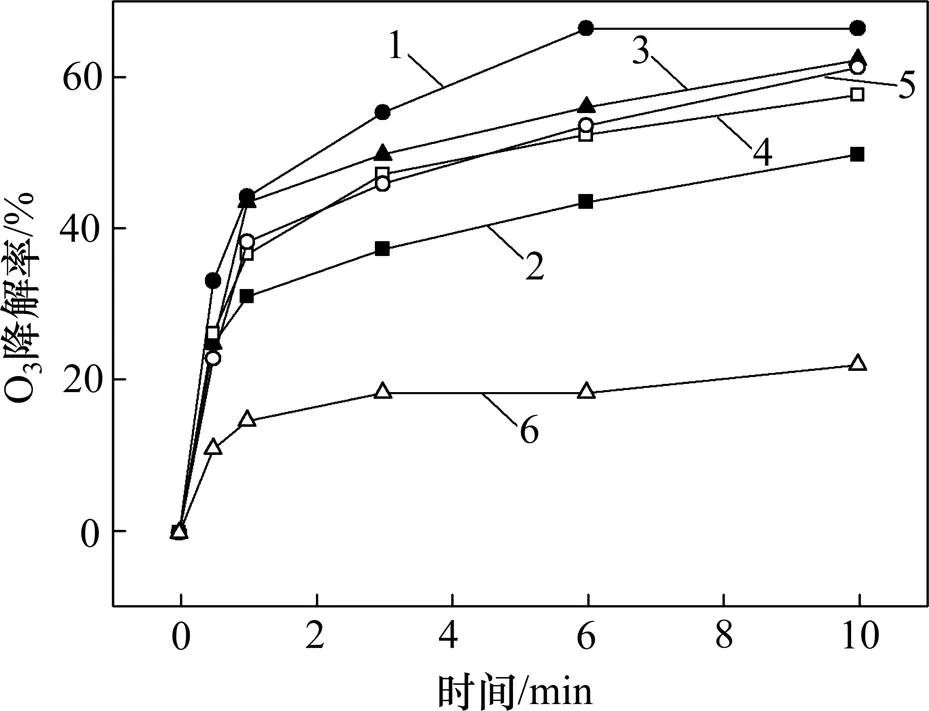
n(Fe3+):n(Ni2+):1—1:4;2—1:2;3—1:1;4—2:1;5—4:1;6—無催化劑。

圖8 投加TBA后DMP分解率
3 結論
1) Fe-NiO催化劑對O3體系具有顯著的催化效果,投加Fe-NiO催化劑后,體系的氧化能力得到顯著提升,并且DMP降解率與O3分解率具有相似的變化趨勢。
2) 不同Fe與Ni物質的量比制得的催化劑表面組成主要為NiFe2O4,Fe3O4,Ni2O3和NiO,但催化劑結晶度以及成分摩爾分數發生變化。
3) SEM結果表明采用溶膠?凝膠法制備出的Fe-NiO催化劑為納米級,主要由0.1~0.3 μm顆粒集聚而產生較多孔洞,從而形成催化劑的主體結構。
4) XPS與FT?IR結果驗證了Fe-NiO催化劑表面存在—OH,不同Fe與Ni物質的量比會影響最終得到的催化劑中有效成分—OH,NiFe2O4和Fe3O4。
5) Fe-NiO催化劑中表面—OH摩爾分數并非影響異相催化能力的唯一因素,金屬元素的多價態間的轉換也會促進O3分解產生?OH,從而提升DMP降解率。
[1] XING Shengtao, HU Chun, QU Jiuhui, et al. Characterization and reactivity of MnOsupported on mesoporous zirconia for herbicide 2,4-D mineralization with ozone[J]. Environmental Science & Technology, 2008, 42(9): 3363?3368.
[2] NIE Yulun, HU Chun, LI Nengneng, et al. Inhibition of bromate formation by surface reduction in catalytic ozonation of organic pollutants over β-FeOOH/Al2O3[J]. Applied Catalysis B: Environmental, 2014, 147(1): 287?292.
[3] TRAPIDO M, HIRVONEN A, VERESSININA Y, et al. Ozonation, ozone/UV and UV/H2O2degradation of chlorophenols[J]. Ozone Science & Engineering, 1997, 19(1): 75?96.
[4] ANDREOZZI R, INSOLA A, CAPRIO V, et al. The use of manganese dioxide as a heterogeneous catalyst for oxalic acid ozonation in aqueous solution[J]. Applied Catalysis A: General, 1996, 138(1): 75?81.
[5] LEGUBE B, LEITNER N. Catalytic ozonation: a promising advanced oxidation technology for water treatment[J]. Catalysis Today, 1999, 53(1): 61?72.
[6] FU H X, LEITNER N, LEGUBE B. Catalytic ozonation of chlorinated carboxylic acids with Ru/CeO2?TiO2catalyst in the aqueous system[J]. New Journal of Chemistry, 2002, 26(11): 1662?1666.
[7] ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13): 3705?3712.
[8] HUANG Ruihuan, YAN Huihua, LI Laisheng, et al. Catalytic activity of Fe/SBA?15 for ozonation of dimethyl phthalate in aqueous solution[J]. Applied Catalysis B: Environmental, 2011, 106(1/2): 264?271.
[9] DONG Yuming, YANG Hongxiao, HE Kun, et al. β-MnO2nanowires: a novel ozonation catalyst for water treatment[J]. Applied Catalysis B: Environmental, 2009, 85(3/4): 155?161.
[10] PULLABHOTLA V S R R, RAHMAN A, JONNALAGADDA S B. Selective catalytic Knoevenagel condensation by Ni-SiO2supported heterogeneous catalysts: an environmentally benign approach[J]. Catalysis Communications, 2009, 10(4): 365?369.
[11] YANG Yixin, MA Jun, QIN Qingdong, et al. Degradation of nitrobenzene by nano-TiO2catalyzed ozonation[J]. Journal of Molecular Catalysis A: Chemical, 2007, 267(1/2): 41?48.
[12] SANCHEZ?POLO M, RIVERA?UTRILLA J, VON GUNTEN U. Metal-doped carbon aerogels as catalysts during ozonation processes in aqueous solutions[J]. Water Research, 2006, 40(18): 3375?3384.
[13] MURUGANANDHAM M, WU J J. Synthesis, characterization and catalytic activity of easily recyclable zinc oxide nanobundles[J]. Applied Catalysis B: Environmental, 2008, 80(1/2): 32?41.
[14] SONG Shuang, LIU Zhiwu, HE Zhiqiao, et al. Impacts of morphology and crystallite phases of titanium oxide on the catalytic ozonation of phenol[J]. Environmental Science & Technology, 2010, 44(10): 3913?3918.
[15] PINES D S, RECKHOW D A. Solid phase catalytic ozonation process for the destruction of a model pollutant[J]. Ozone Science & Engineering, 2003, 25(1): 25?39.
[16] ZHAO Lei, SUN Zhizhong, MA Jun.Novel relationship between hydroxyl radical initiation and surface group of ceramic honeycomb supported metals for the catalytic ozonation of nitrobenzene in aqueous solution[J]. Environmental Science & Technology, 2009, 43(11): 4157?4163.
[17] YUAN Lei, SHEN Jimin, CHEN Zhonglin, et al. Role of Fe/pumice composition and structure in promoting ozonation reactions[J]. Applied Catalysis B: Environmental, 2016, 180: 707?714.
[18] LI Weiwei, QIANG Zhimin, ZHANG Tao, et al. Kinetics and mechanism of pyruvic acid degradation by ozone in the presence of PdO/CeO2[J]. Applied Catalysis B: Environmental, 2012, 113/114: 290?295.
[19] REN Yueming, DONG Qing, FENG Jing, et al. Magnetic porous ferrospinel NiFe2O4: a novel ozonation catalyst with strong catalytic property for degradation of di-n-butyl phthalate and convenient separation from water[J]. Journal of Colloid and Interface Science, 2012, 382(1): 90?96.
[20] DE DIEGO L F, GAYáN P, GARCíA?LABIANO F, et al. Impregnated CuO/Al2O3oxygen carriers for chemical-looping combustion:? avoiding fluidized bed agglomeration[J]. Energy & Fuels, 2005, 19(5): 1850?1856.
[21] CHAN S C, BARTEAU M A. Preparation of highly uniform Ag/TiO2and Au/TiO2supported nanoparticle catalysts by photodeposition[J]. Langmuir, 2005, 21(12): 5588?5595.
[22] MAZILLE F, SCHOETTL T, PULGARIN C. Synergistic effect of TiO2and iron oxide supported on fluorocarbon films(part 1): effect of preparation parameters on photocatalytic degradation of organic pollutant at neutral pH[J]. Applied Catalysis B: Environmental, 2009, 89(3/4): 635?644.
[23] MAENSIRI S, MASINGBOON C, BOONCHOM B, et al. A simple route to synthesize nickel ferrite (NiFe2O4) nanoparticles using egg white[J]. Scripta Materialia, 2007, 56(9): 797?800.
[24] VALDES H, MURILLO F, MANOLI J, et al. Heterogeneous catalytic ozonation of benzothiazole aqueous solution promoted by volcanic sand[J]. Journal of Hazardous Materials, 2008, 153(3): 1036?1042.
[25] BADER H, HOIGNE J. Determination of ozone in water by the indigo method[J]. Water Research, 1981, 15(4): 449?456.
[26] ORLéANS R B C. Database for surface spectroscopies as XPS, AES and UPS[EB/OL]. [2016?10?23]. www.lasurface. com/database/elementxps.php.
[27] WANG Z, CHOU H, WU J C S, et al. CO2photoreduction using NiO/InTaO4in optical-fiber reactor for renewable energy[J]. Applied Catalysis A: General, 2010, 380(1/2): 172?177.
[28] Lü Aihua, HU Chun, NIE Yulun, et al. Catalytic ozonation of toxic pollutants over magnetic cobalt and manganese co-doped γ-Fe2O3[J]. Applied Catalysis B: Environmental, 2010, 100(1/2): 62?67.
[29] SUI Minghao, LIU Jia, SHENG Li. Mesoporous material supported manganese oxides (MnO/MCM?41) catalytic ozonation of nitrobenzene in water[J]. Applied Catalysis B: Environmental, 2011, 106(1/2): 195?203.
[30] MACHOCKI A, IOANNIDES T, STASINSKA B, et al. Manganese-lanthanum oxides modified with silver for the catalytic combustion of methane[J]. Journal of Catalysis, 2004, 227(2): 282?296.
[31] JOSEPH Y, RANKE W, WEISS W. Water on FeO(111) and Fe3O4(111): adsorption behavior on different surface terminations[J]. Journal of Physical Chemistry B, 2000, 104(14): 3224?3236.
[32] ZHANG Tao, MA Jun. Catalytic ozonation of trace nitrobenzene in water with synthetic goethite[J]. Journal of Molecular Catalysis A: Chemical, 2008, 279(1): 82?89.
[33] FLOREA M, ALIFANTI M, PARVULESCU V I, et al. Total oxidation of toluene on ferrite-type catalysts[J]. Catalysis Today, 2009, 141(3/4): 361?366.
[34] ZHANG Tao, LI Chunjuan, MA Jun, et al. Surface hydroxyl groups of synthetic alpha-FeOOH in promoting (OH)?O?center dot generation from aqueous ozone: property and activity relationship[J]. Applied Catalysis B: Environmental, 2008, 82(1/2): 131?137.
[35] ANDREOZZI R, CAPRIO V, INSOLA A, et al. Advanced oxidation processes (AOP) for water purification and recovery[J]. Catalysis Today, 1999, 53(1): 51?59.
[36] HOIGNE J, BADER H. Role of hydroxyl radical reactions in ozonation processes in aqueous solutions[J]. Water Research, 1976, 10(5): 377?386.
[37] HOIGNE J, BADER H. Role of hydroxyl radical reactions of ozone with organic and inorganic compounds in water 2: dissociating organic compounds[J]. Water Research, 1983, 17(2): 185?194.
(編輯 劉錦偉)
Effect of Fe-Ni bimetal oxides with different element molar ratios on catalytic activity
AN Xiaoqian, ZHANG Gucheng, ZHANG Jing, WEI Chenmo, ZHOU Peng, XU Hao, YE Qian, ZHOU Guanyu, YANG Fuhua
(School of Architecture & Environment, Sichuan University, Chengdu 610065, China)
Bimetal Fe-Ni oxides (Fe-NiO) catalysts prepared by sol?gel method were synthesized to avoid the pollution caused by metal ions in homogeneous system. Different bimetal catalysts were prepared with different mole ratios of Fe and Ni, and the surface properties were characterized by X-ray diffraction (XRD) and X-ray photoelectron spectroscopy (XPS), scanning electron microscope (SEM) and Fourier transform infrared spectroscopy (FT?IR). The degradation rate of dimethyl phthalate (DMP) was measured as the target that revealed the activity of catalysts to activated O3, and the stability of bimetal catalysts was investigated after being used for 5 times. The results show that the prepared 5 catalysts work well and the degradation rates of DMP are 85.93%, 63.33%, 83.92%, 78.58% and 80.93% in 5 min, respectively. The O3decomposition rates have the similar trend, indicating that the degradation rate of DMP is almost caused by the decomposition of O3. Fe3O4, NiFe2O4and NiO are the main phases in the surface of Fe-NiOcatalysts. The average grain size of Fe-NiOcatalysts is in the range of 0.1?0.3 μm and many holes are generated with these grain assembled. There are hydroxyl groups (—OH) on the surface of catalysts. Therefore, it can be inferred that the catalytic process is possible due to the combined action of multi-valence of metal elements and —OH.
advanced oxidation process; heterogeneous catalysis; bimetal oxides; ozone
10.11817/j.issn.1672-7207.2018.05.011
X131.2
A
1672?7207(2018)05?1103?07
2017?05?28;
2017?07?18
國家自然科學基金資助項目(51508353);成都市科技惠民項目(2015-HM01-00279-SF) (Project(51508353) supported by the National Natural Science Foundation of China; Project(2015-HM01-00279-SF) supported by the Science and Technology Huimin Project of Chengdu)
張靜,博士,副教授,從事水深度處理研究;E-mail: zjing428@163.com

