氧源系數對內氧化法制備的Al2O3/Cu復合材料性能的影響
馬 帥 郭曙強 蘇 新 喬夢然 黃詩怡
(省部共建高品質特殊鋼冶金與制備國家重點實驗室、上海市鋼鐵冶金新技術開發應用重點實驗室和上海大學材料科學與工程學院,上海 200072)
隨著航空航天、機械電子等高新技術的快速發展,對材料性能的要求不斷提高[1- 2]。銅及銅合金具有高的導電性、導熱性及優良的加工性能,廣泛應用于電子、電力、通訊、宇航、交通等領域。但是純銅的室溫強度和高溫強度均較低,難以滿足實際應用的需要。因此,如何在保持較高電導率水平的前提下,大幅度地提高強度,己成為銅基材料研究和開發的中心任務。Al2O3彌散強化銅基復合材料是一種行之有效的強化方法,由于Al2O3顆粒硬度高,且在高溫下熱穩定性好及對Cu基體的不溶性,甚至在接近銅熔點的溫度下都能保持其原來的粒度和間距,所以Al2O3/Cu復合材料在高溫下能保持較高的硬度。同時,導電理論指出,固溶在銅基體中的溶質原子引起的點陣畸變對定向運動電子的散射作用較第二相顆粒引起的散射作用大。因此,Al2O3/Cu復合材料能保持銅基體的高導電性和導熱性[3- 6]。
內氧化彌散強化銅的研究在一些工業發達國家己經取得重大進展,如美國SCM公司在2001年就已達到日產20 t的生產規模[7]。但國內采用內氧化法制備Al2O3/Cu復合材料涉及加工環節多,影響性能的因素多,生產過程不穩定,成品率較低,規模化生產的廠家很少[8]。本文研究了等靜壓燒結成型過程中,等靜壓壓力對Al2O3/Cu復合材料的導電性和硬度的影響,以及氧源系數對內氧化產物和材料性能的影響,以期為內氧化彌散強化銅生產工藝的完善提供借鑒。
1 殘余鋁含量的計算
Cu- Al合金中Cu不發生氧化的臨界條件由方程式(1)決定。
2Cu+1/2O2=Cu2O,
(1)
反應達到平衡時,滿足條件ΔG1=0,即
(2)
式中:
(3)
因為Cu、Cu2O都為純凝聚態物質,因此αCu2 O=αCu=1,Pθ=101 kPa,將值代入式(3)得:
(4)
將式(1)和式(4)代入式(2),可得合金內氧化的上限氧分壓PO2:
(5)

2Al+3/2O2=Al2O3,
(6)
(7)
(8)
根據式(6)~式(8),可得:
2[Al]Cu+3[O]Cu=Al2O3,
(9)
當反應達到平衡時,
(10)
式中:
(11)
因為Al2O3為純凝聚態物質,故αAl2O3=1。aAl=fAl·[Al%],aO=fO·[O%],內氧化過程中[Al]、[O]濃度都很低,因此可以近似地認為fAl=fO=1,代入式(11)得[9- 10]:
K5=1/([Al%]2·[O%]3)
(12)
將式(9)和式(12)代入式(10)得:
[Al%]2·[O%]3=exp(44.9-161 994.8/T)
(13)
由式(13)可知,在一定溫度下,Cu- Al合金發生內氧化的臨界濃度積[Al]2·[O]3是一個常數。當反應(7)達到平衡時,即氧在銅基體中的溶解達到了平衡,滿足:
(14)
又因為:
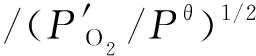
(15)
(16)
把式(13)代入再式(16)得:
(17)
當反應氧分壓等于上限氧分壓時,將式(5)代入式(17)并整理得:
(18)
試驗內氧化溫度為950 ℃,即1 223 K。若反應按上限氧分壓進行,計算得Al的殘余量[Al%]=8.20×10-19。可見在反應氧分壓等于上限氧分壓時,合金內氧化進行得很徹底。這就確保了固溶態的Al充分脫溶,合金中的Al元素基本被氧化為Al2O3顆粒。
2 試驗材料與方法
試驗采用湖南華邦粉末材料有限公司水霧化法生產的Cu- 0.4%(質量分數)Al合金粉末,粉末的粒徑小于48 μm。將粒徑小于45 μm的Cu2O粉末與該合金粉末分別以氧源系數1、1.1、1.2、1.3(Cu2O與合金粉末質量比分別為50∶1.6、50∶1.76、50∶1.92、50∶2.08)均勻混合。將混合好的粉末置于爐內,通入高純氮氣,在950 ℃內氧化處理0.5 h。然后將內氧化后的粉末置于高純氫中,900 ℃還原1 h,以還原掉未反應的Cu2O。將不同氧源系數內氧化粉末各取10 g,用濃度為30%(質量分數)的硝酸充分腐蝕,過濾,烘干,然后采用X射線進行分析,得到衍射圖譜。再將Al2O3/Cu粉末在相同的壓力和保壓時間下進行冷等靜壓成型,等靜壓壓力為325 MPa,保壓時間90 s。然后在氮氣保護下,950 ℃燒結1 h,隨爐冷卻至室溫。用線切割和機加工的方法制備試樣,然后采用四探針法測量試樣的電導率,采用顯微硬度儀測量硬度。
3 試驗結果與分析
3.1 不同氧源系數內氧化產物分析
圖1為4種萃取粉末的X射線衍射圖譜。對比可知,隨著氧源系數的增大,產物中CuAlO2含量逐漸增多。當氧源系數為1時,產物中沒有CuAlO2;當氧源系數為1.3時,只有CuAlO2而沒有氧化鋁。可知以Cu2O為氧化劑的內氧化過程發生如下反應:2Cu2O→4Cu+2[O](1);2[Al]+3[O]→Al2O3(2);Cu+Al2O3+[O]→CuAlO2(3)。當氧源系數較小時,只發生反應(1)和(2)。當氧源系數足夠大時,反應(1)、(2)和(3)都會發生。隨著氧源系數的增大,產物中γ- Al2O3先消失,α- Al2O3后反應完,因此Al2O3強化相中以α- Al2O3為主,γ- Al2O3含量較少,這與文獻[11]的報道相一致。
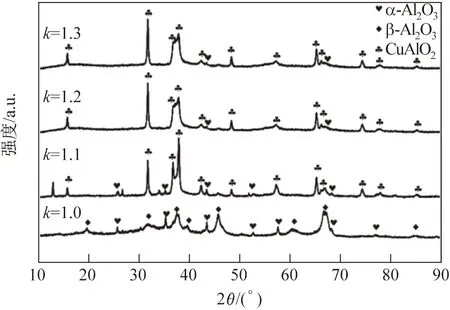
圖1 不同氧源系數內氧化萃取粉末的X射線衍射圖譜Fig.1 XRD patterns of extracted powders after internal oxidation with different oxygen source coefficients
將內氧化后的粉末置于高純氫氣中,900 ℃還原1 h,再用硝酸萃取粉末,產物的X射線衍射圖譜如圖2所示。由圖2可見,產物中只有氧化鋁,說明900 ℃還原1 h,4種粉末均完全還原。發生發應如下:Cu2O+H2→2Cu+H2O(4);2CuAlO2+H2→2Cu+Al2O3+H2O(5)。當氧源系數較小時,只發生反應(4),當氧源系數足夠大時,反應(4)和(5)都會發生。

圖2 不同氧源系數內氧化還原后萃取粉末的X射線衍射圖譜Fig.2 XRD patterns of extracted powder after internal oxidation and reduction with different oxygen source coefficients
3.2 氧源系數對材料顯微硬度和電導率的影響
將不同氧源系數的Cu- Al2O3粉末經冷等靜壓成型后燒結,再測量其電導率和顯微硬度,結果如表1所示。

表1 不同氧源系數復合材料的電導率及顯微硬度Table 1 Electrical conductivity and micro- hardness of composites prepared with different oxygen source coefficients
由表1可知,材料的電導率和顯微硬度在氧源系數為1.1時達到最大值,但當氧源系數繼續增大時,電導率基本不變,顯微硬度卻逐漸降低。這是因為當氧源系數從1增大到1.1時,略有過量的氧化劑Cu2O保證了合金足以發生內氧化的氧分壓,使得合金中的鋁能夠充分被氧化并脫溶,Al2O3顆粒對電子的散射遠小于固溶于銅基體中的Al,因此復合材料的硬度和導電性都會增加。由3.1節中反應(4)可知,多余的Cu2O被還原成無強化相的銅,因此當氧源系數繼續增大時會導致材料的硬度降低,而電導率基本不變。
3.3 復合材料彌散強化相的分布
圖3是以氧源系數為1.1配料,內氧化后再用高純氫氣還原后的Al2O3/Cu粉末的TEM圖。從圖中可以看出,Al2O3彌散顆粒的平均尺寸約為10~15 nm,呈球形或橢球形,顆粒間距約30 nm,說明此條件下內氧化法制備的Al2O3/Cu復合材料中的彌散顆粒還很細小。
圖4是氧源系數為1.1的復合材料棒材橫截面的掃描圖和面掃能譜圖。從圖4(a)中可以看出,950 ℃燒結1 h,粉末已經發生了充分的擴散和粘結。測得材料的密度為8.846 g/cm3,與純銅的密度8.900 g/cm3已經很接近,證明粉末已充分粘結。從圖4(b)~4(d)中可以看出, Al2O3均勻彌散地分布在銅基中。結合圖3可知,Al2O3顆粒細小且均勻彌散地分布在銅基中,由于Al2O3顆粒硬度高,且高溫下比較穩定, Al2O3的彌散分布對銅基中的位錯起釘扎作用,可以對材料起強化作用。固溶在銅基體中的溶質原子引起的點陣畸變對定向運動電子的散射作用較第二相顆粒引起的散射作用大,因此復合材料能保持較高的導電性。

圖3 氧源系數1.1下內氧化法制備、H2還原后的Al2O3/Cu粉末的TEM圖Fig.3 TEM image of Al2O3/Cu powders after internal oxidation and reduction with oxygen source coefficient of 1.1

圖4 銅棒橫截面SEM照片和元素分布能譜圖Fig.4 SEM and EDS images of the cross section of copper bar
4 結論
(1)采用內氧化法制備Cu- Al2O3復合材料粉末,冷等靜壓燒結成型,不進行任何其他后續處理,有利于控制變量,準確研究氧源系數對Cu- Al2O3復合材料導電性和硬度的影響。
(2)所制得的復合材料強化相以α- Al2O3為主,γ- Al2O3含量較少。氧化鋁彌散均勻地分布在銅基中,很好地提高了材料的強度硬度。
(3)復合材料的顯微硬度和電導率在氧源系數為1.1時分別到達最大值120.8 HV和82.4 %IACS;當氧源系數大于1.1后,隨著氧源系數的增大,硬度降低,而電導率基本不變。
[1] LEE D W, KIM B K. Nanostructured Cu- Al2O3composite produced by thermochemical process for electrode application[J]. Materials Letters, 2004, 58(3/4):378- 383.
[2] BESTERCI M, VELGOSOVO, LEKO A, et al. Microstructural parameters of Cu- Al2O3dispersion strengthened materials[J]. Materials Science Forum, 2003, 416- 418(1):35- 40.
[3] 程建奕,汪明樸,鐘衛佳,等.內氧化法制備的Al2O3- Cu合金的顯微組織與性能[J].材料熱處理學報, 2003, 24(1) : 23- 27.
[4] 李紅霞,田保紅,宋克興,等. 內氧化法制備Al2O3/Cu復合材料[J].兵器材料科學與工程, 2004, 27(5): 64- 69.
[5] JENA P K, BROCCHI E A, SOLOlRZNO I G, et al. Identification of a third phase in Cu- Al2O3nano- composites prepared by chemical routes[J]. Materials Science & Engineering A, 2004, 371(1/2):72- 78.
[6] SHEHATA F, FATHY A, ABDELHAMEED M, et al. Preparation and properties of Al2O3, nanoparticle reinforced copper matrix composites by in situ processing[J]. Materials & Design, 2009,30(7):2756- 2762.
[7] 國秀花,宋克興,郜建新,等.Al2O3彌散強化銅基復合材料的研究現狀與進展[J].材料開發與應用,2006,21(4):41- 46.
[8] 申玉田,崔春翔,孟凡斌,等.高強度高導電率Cu- Al2O3復合材料的制備[J].金屬學報,1999, 35(8): 888- 892.
[9] 申玉田, 崔春翔,申玉發,等. Cu- Al合金內氧化的熱力學分析——Ⅰ熱力學函數[J]. 稀有金屬材料與工程, 2004, 33(6):576- 579.
[10] SONG K X, XING J D, DONG Q M, et al. Internal oxidation of dilute Cu- Al alloy powers with oxidant of Cu2O[J]. Materials Science & Engineering A, 2004, 380(1):117- 122.
[11] ZHANG X H, LIN C G, CUI S, et al. Microstructure and properties of Al2O3disperion- strengthed copper fabricated by reactive synthesis process[J].Rare Metals,2014;33(2):191- 195.

