多參數高場強磁共振成像評估恒河猴急性腦梗死血栓-溶栓模型
張 默,吳 迪,何小奪,齊志剛,李坤成*,陳 健(.首都醫科大學宣武醫院影像科,北京 0005; .首都醫科大學宣武醫院中美神經科學研究所,北京 0005; .首都醫科大學宣武醫院神經外科,北京 0005)
腦血管病是危害人類生命健康的最常見疾病之一,其中缺血性腦血管病(ischemia cerebrovascular disease,ICVD)約占全部腦血管病的80%,具有死亡率和致殘率高的特點[1]。采用重組組織型纖溶酶原激活劑(rt-PA)進行溶栓治療是唯一被證實治療卒中的有效方法[2-3]。但是,在非人靈長類動物(nonhuman primates,NHPs)上模擬急性腦梗死發病、治療的模型鮮有報道。恒河猴與人類親緣關系密切,在器官代謝功能、體格特點及基因遺傳水平等許多生物學特性方面與人類較為接近,因此成為近年來各種藥物、疾病的病理生理機制研究的重要模型[4]。磁共振成像(magnetic resonance imaging,MRI)技術作為一種無創檢查技術,已成為腦梗死的重要檢查手段,甚至是首選檢查方案。其中常規掃描T2加權圖像(T2WI)可用于觀察病變;T2磁共振成像液體衰減反轉恢復序列(T2-FLAIR)可在T2WI中抑制腦脊液的高信號,使鄰近腦脊液、具有高信號(長T2)的病變得以顯示清楚;使用時間飛躍法血管成像技術(TOF-MRA)可無創得到大腦內血管圖像;彌散加權成像(diffusion-weighted imaging,DWI)等已經被較多地應用于腦梗死的研究之中[5]。本研究建立了大腦中動脈栓塞(middle cerebral artery occlusion,MCAO)模型,并對其進行溶栓治療,通過磁共振技術觀察梗死區域組織及血流變化,比較不同治療時長的療效,以期指導臨床治療。
1 材料和方法
1.1 實驗動物
成年雄性恒河猴8只,清潔級,平均年齡(8.2±1.2)歲,平均體重(9.4±1.0) kg,由中國人民解放軍軍事醫學科學院實驗動物中心提供[SCXK (軍) 2012-0019]。動物日常喂養在首都醫科大學實驗動物室[SYXK (京) 2014-0018],每只動物均單獨飼養,購買后喂養一個月以上方用于實驗。所用實驗動物經檢測排除結核、志賀氏菌、沙門氏菌、寄生蟲、B病毒感染等疾病。其中4只動物接受血栓注射(梗死組),其余4只動物接受溶栓治療(溶栓組)。實驗方案經首都醫科大學動物倫理委員會批準(AEEI-2016-174)。
1.2 主要試劑與儀器
所用麻醉藥品:丙泊酚(10 mL/100 mg,批號:320040,AstraZeneca UK Limited);氯胺酮(2 mL/0.1 g,批號:111207,江蘇恒瑞醫藥股份有限公司,中國);速眠新(批號:201403,廣州萊綠寵商貿有限公司,中國)。
實驗所用磁共振設備為Simens公司生產的Verio 3T超導磁共振掃描儀,搭配使用Simens 32通道頭部線圈;使用Simens Syngo后處理工作平臺對數據進行處理。其他器材包括微導絲(Traxcess 14,Microvention,美國);Rebar 18微導管(Micro Therapeutics,美國)。
1.3 實驗方法
1.3.1 恒河猴大腦中動脈栓塞模型的建立[6]
模型動物術前8 h禁水,2 h禁食,對實驗動物的生命體征全程監測,手術臺通過電熱毯輔助加熱,動物肛溫控制在37℃,肌內注射氯胺酮(2 mL)+速眠新(1 mL)誘導麻醉,丙泊酚0.3~0.4 mg/(kg·h)持續靜脈滴注麻醉。手術過程中,對體溫、心率、有創動脈壓、呼吸、血氧飽和度進行持續監測,間斷進行血氣分析。固定恒河猴于仰臥位,頭部正位。采用冠狀動脈造影用5 F動脈鞘組穿刺針、導引鋼絲、動脈鞘行經皮穿刺股動脈。在0.889 mm(0.035英寸)超滑導絲引導下,將5 F導引導管置入右側頸內動脈。退出導絲后,行右側頸內動脈正側位造影。使用微導,并將微導管頭端置入至右側M1段。退出微導絲,手推造影劑碘海醇2 mL,造影證實微導管頭端位于大腦中動脈(middle cerebral artery,MCA)近段。通過注射器將一根10 cm自體血栓打入微導管。局部腦缺血后2.5 h開始給予rt-PA溶栓治療。直視下縫合右側股動脈穿刺處,縫合皮下組織及皮膚,加壓包扎后將動物送回動物房。視動物術后狀態,靜脈滴注甘露醇等對癥治療,并給予保溫、營養等生命支持。
1.3.2 磁共振掃描方法
實驗前,對實驗對象進行磁共振掃描,排除病變之后,對8只恒河猴分別進行M1段梗死模型的制備。實驗分為兩組,梗死組不進行溶栓,溶栓組進行rt-PA溶栓治療。分別于術后4 h及24 h進行磁共振掃描,掃描序列包括T2WI(TR=4000 ms,TE=100 ms,FOV=180 mm),T2-FLAIR(TR=9000 ms,TE=96 ms,FOV=220 mm),TOF-MRA(TR=20 ms,TE=3.6 ms,FOV=220 mm),DWI(TR=6000 ms,TE=100 ms,FOV=220 mm)。分別在局部腦缺血后4 h和24 h進行MRI掃描。使用后,處理工作站計算4 h和24 h的梗死體積(包括T2WI,T2-FLAIR和DWI)。
1.4 統計學方法
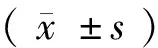
2 結果
2.1 大腦中動脈栓塞恒河猴表現
術后模型動物均恢復自主呼吸,出現對側神經功能受損,表現為對側上肢和下肢無力,僅能用正常側上肢進行抓取動作;對側上肢和下肢感覺功能障礙,對痛覺刺激無反應;模型動物在進食過程中均出現流涎癥狀。
2.2 評估大腦中動脈灌注情況
MRA顯示,注射血栓后4 h梗死組大腦中動脈主干閉塞,24 h梗死組大腦中動脈主干仍未再通(圖1)。經溶栓治療后,注射血栓后4 h溶栓組的大腦中動脈主干實現再通,24 h溶栓模型大腦中動脈主干仍為再通狀態。
2.3 梗死體積評估
T2WI序列顯示,梗死組4 h、24 h的梗死體積分別為(2665±1519) mm3和(14 693±5078) mm3,溶栓組4 h、24 h的梗死體積分別為(2738±958) mm3和(7648±3101) mm3;梗死組梗死體積增量為(12 027±5507) mm3,溶栓組梗死體積增量為(4910±2764) mm3;兩組4 h梗死體積比較,差異無顯著性;溶栓組24 h梗死體積及4~24 h增量低于梗死組,差異有顯著性。見圖1、圖2、圖3。
DWI序列顯示,梗死組4 h、24 h的梗死體積分別為(8017±3593) mm3和(17 515±6024) mm3,溶栓組4 h、24 h的梗死體積分別為(5988±3032) mm3和(10 842±3529) mm3;梗死組梗死體積增量為(9498±5226) mm3,溶栓組梗死體積增量為(4854±1792) mm3;兩組4 h梗死體積比較,差異無顯著性;溶栓組24 h梗死體積及4~24 h增量低于梗死組,差異有顯著性。見圖1、圖2、圖4。
3 討論
腦缺血動物模型是研究腦血管疾病損傷機制和防治措施的基礎,尤其是近期許多大腦保護藥物臨床III期的失敗,更顯示出適當的動物模型對于腦梗死研究的重要性。嚙齒類動物的腦梗死模型過于簡單,與人類之間有著巨大的種屬差異[7],不足以反映人類腦梗死的復雜性和動態變化。而非人靈長類動物在基因上非常接近于人類,其大腦的解剖結構,特別是大腦中動脈的分布區域與人類相似,而且腦的大小也適合進行MRI研究,因此美國卒中治療專業委員會建議,新的神經保護藥物進行臨床試驗之前,應該以非人靈長類動物梗死模型作為動物模型進行臨床前研究[8]。
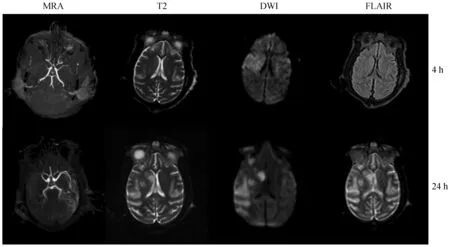
注:從左至右依次為TOF-MRA,T2WI,DWI,T2-FLAIR。圖1 梗死組4 h、24 h磁共振影像Note.From left to right, figures show TOF-MRA, T2WI, DWI, and T2-FLAIR images, respectively.Fig.1 MRI of the infarction group at 4 h and 24 h
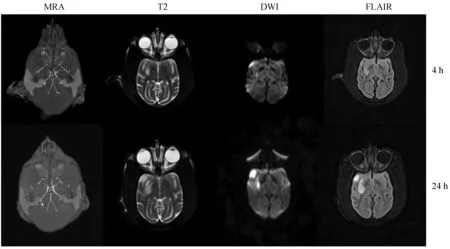
注:從左至右依次為TOF-MRA,T2WI,DWI,T2-FLAIR。圖2 溶栓組4 h、24 h磁共振影像Note.From left to right, figures show TOF-MRA, T2WI, DWI, and T2-FLAIR images, respectively.Fig.2 MRI of the thrombolysis group at 4 h and 24 h
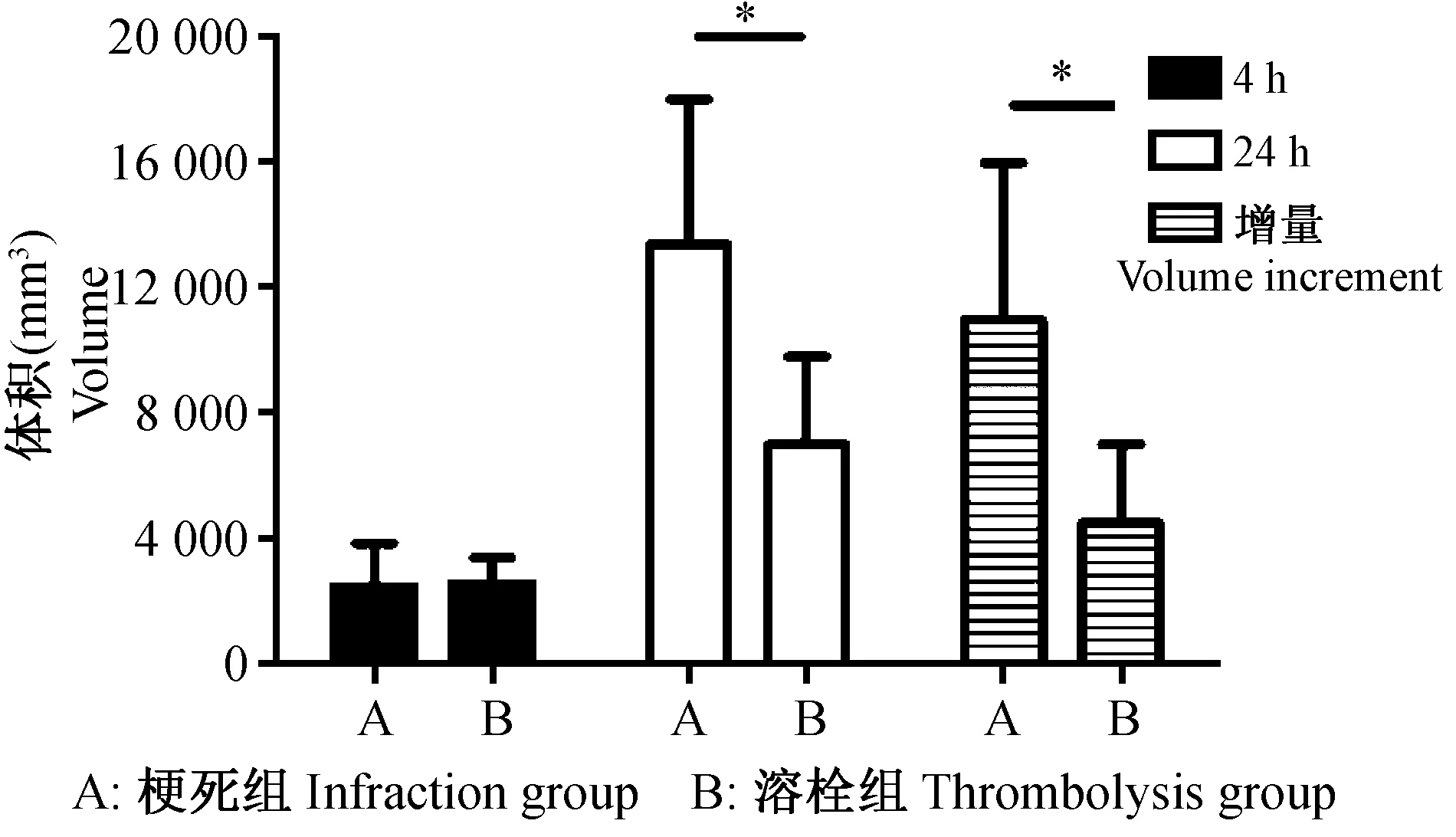
圖3 T2WI序列顯示梗死組和溶栓組在4 h、24 h的梗死體積及梗死體積增量Fig.3 Volume with increases of cerebral infarction by T2WI in the infarction group and thrombolysis group at 4 h and 24 h
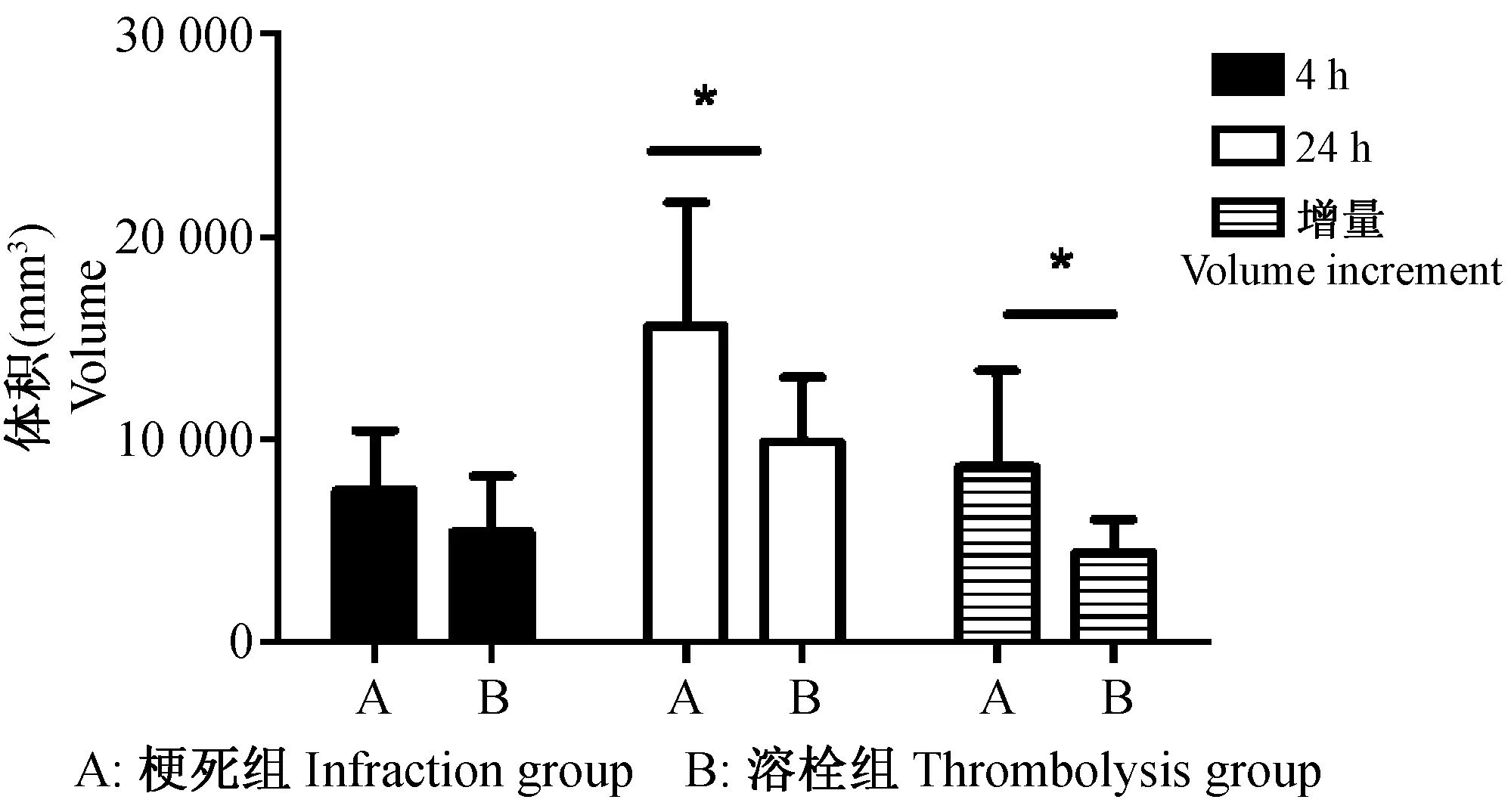
圖4 DWI序列顯示梗死組和溶栓組在4 h、24 h的梗死體積及梗死體積增量Fig.4 Volume with increases of cerebral infarction by DWI in the infarction group and thrombolysis group at 4 h and 24 h
大腦中動脈(MCA)是人類腦缺血的多發部位,絕大多數的腦缺血模型都是針對MCA展開的。非人靈長類動物局部腦缺血模型的建立方法可大致分為血管內介入方法和開顱手術方法,Marshall等[9]研究指出,恒河猴血栓-溶栓模型與卒中患者發病治療過程一致。在各種模型制作方法中,血管內介入方法的模型制備過程與腦卒中的發病過程非常相似,因此值得特別關注[10]。但是,由于技術等原因,采用血管內介入方法制備急性腦缺血模型的報道非常少。本實驗采取的血栓模型,同時模擬了血栓發生過程和干預治療的過程,更適合用來評估干預效果[11]。
目前,3T場強的高場強磁共振掃描儀用于診斷急性腦血管病及其并發癥,已經在臨床上得到了廣泛開展。非人靈長類動物體型與人類嬰幼兒相近,配合高通道數的32通道頭部線圈和GRAPPA并行采集技術的使用,可以在保持較高空間分辨率的情況下,同時大幅度縮短掃描時間,得到清晰準確的圖像,也允許在較短的時間窗內,獲得更多模態的MRI圖像[12]。通過TOF-MRA掃描,可以準確觀察到,在梗死模型制備并進行溶栓后,實驗側血管的再通情況以及與正常側血管形態的對比。在梗死模型制備后,實驗側的血流明顯減少,梗死組動物的實驗側血管于血栓位置截斷,4 h和24 h時遠端血管都不能顯示。溶栓組進行溶栓再通后,遠端血管恢復血流,4 h和24 h均保持可見,明確了溶栓操作的效果。
磁共振彌散加權成像(DWI)可以無創地檢測活體組織內的水分子自由擴散運動,在臨床上,主要應用于診斷超早期腦缺血,腦組織急性缺血后,因為腦供血不足,導致微循環灌注障礙,致使細胞缺氧,ATP生成減少,鈉鉀泵衰竭,導致K+外流,Na+、Cl-、Ca2+內流,細胞內滲透壓增高,大量水分子進入細胞,產生細胞毒性水腫,導致水分子自由擴散運動異常,DWI表現為病灶區域出現異常高信號。與常用FSE序列相比,可以更早地確定缺血病灶位置[13 - 14]。
通過工作站分別計算梗死組和溶栓組4 h、24 h不同時間點的T2WI以及DWI圖像中的梗死體積,可以發現梗死組與溶栓組于4 h時顯示的梗死面積并無較大差異,而24 h時,T2WI、DWI圖像顯示,兩組實驗動物的大腦血管狀態有明確的不同,梗死體積有顯著的差異。由此可以得出,通過多參數高場強磁共振成像,可以對梗死-溶栓模型的建立效果進行準確的評價。
隨著血管內介入方法制作血栓模型的開展,這種方法雖然有接近臨床發病和治療的優點,但是仍然存在血栓模型定位不夠精準,血栓延伸、血栓自溶等不確定因素[14],仍然需要建立一套完善的模型評價體系。而伴隨磁共振技術向著高場強及超高場強、高梯度性能和多種圖像對比的發展,為血栓梗死及溶栓模型的評價提供了豐富的信息,對于評價體系的建立有極大的幫助。今后的研究應采用更多的磁共振技術,如磁共振灌注成像PWI及磁共振磁敏感成像SWI等,在定性評價的同時還能定量地評價血栓模型。
近些年來,聯合動脈選擇性低溫灌注技術,在臨床上仍處于初步的研究階段。目前,已有研究人員應用于豬及犬等的動物模型上[15-16],取得了較為積極的治療效果。能否在非人靈長類動物模型中得到驗證,將是下一步研究的重點。
參考文獻:
[1] Feign VL, Lawes CM, Bennet DA, et al. Stroke epidemiology, a review of population based studies of incidence, prevalence, and case-fatality in the late 20th century [J]. Lancet Neurol, 2003, 2(1): 43-53.
[2] 魏衡, 余勇飛, 周瑞, 等. HAT、SEDAN評分及相關腦血管病危險因素預測急性缺血性卒中溶栓后出血性轉化臨床研究 [J]. 中國現代神經疾病雜志, 2015, 15(2): 126-132.
[3] Demaerschalk BM, Kleindorfer DO, Adeoye OM, et al. Scientific rationale for the inclusion and exclusion criteria for intravenous alteplase in acute ischemic stroke: a statement for healthcare professionals from the American Heart Association/American Stroke Association [J]. Stroke, 2016, 47(2): 581-641.
[4] 王迪潯, 金惠銘. 氧化應激與疾病//人體病理生理學 [M]. 第3版, 北京: 人民衛生出版社, 2008: 29.
[5] Elgouhari HM, Abu-Rajab Tamimi TI, Carey WD. Hepatitis B virus infection: understanding its epidemiology, course, and diagnosis [J]. Cleve Clin J Med, 2008, 75(12): 881-889.
[6] 趙博, 尚國偉, 陳健, 等. 彈簧圈置入法建立恒河猴可逆性大腦中動脈阻塞模型的初步研究 [J]. 中國腦血管病雜志, 2013, 10(3): 139-142.
[7] O’Collins VE, Macieod MR, Donnan GA, et al. 1026 experimental treatments in acute stroke [J]. Ann Neural, 2006, 59(3): 467-477.
[8] Fisher M, Feuerstein G, Howells DW, et al. Update of the stroke therapy academic industry roundtable preclinical recommendations [J]. Stroke, 2009, 40(6): 2244-2250.
[9] Marshall JW, Cross AJ, Jackson DM, et al. Clomethiazole protects against hemineglect in a primate model of stroke [J]. Brain Res Bull, 2000, 52(1): 21-29.
[10] Wu D, Chandra A, Chen J, et al. Endovascular ischemic stroke models in nonhuman primates [J]. Neurotherapeutics, 2018, 15(1): 146-155.
[11] Fukuda S, del Zoppo GJ. Models of focal cerebral ischemia in the nonhuman primate [J]. ILAR J, 2003, 44: 96-104.
[12] Lindholm TL, Botes L, Engman EL, et al. Parallel imaging: is GRAPPA a useful acquisition tool for MR imaging intended for volumetric brain analysis? [J]. BMC Med Imaging, 2009, 9: 15.
[13] Gao H, Liu Y, Lu S, et al. A reversible middle cerebral artery occlusion model using intraluminal balloon technique in monkeys [J]. J Stroke Cerebrovasc Dis, 2006, l5(5): 202-208.
[14] Lin W, Lee JM, Lee YZ, et al. Temporal relationship between apparent diffusion coefficient and absolute measurements of cerebral blood flow in acute stroke patients [J]. Stroke, 2003, 34(1): 64-70.
[15] Mattingly TK, Denning LM, Siroen KL, et al. Catheter based selective hypothermia reduces stroke volume during focal cerebral ischemia in swine [J]. J Neurointerv Surg, 2016, 8(4): 418-422.
[16] Furuse M, Preul MC, Kinoshita Y, et al. Rapid induction of brain hypothermia by endovascular intra-arterial perfusion [J]. Neural Res, 2007, 29(1): 53-57.

