正清風痛寧對骨關節炎動物模型ADAMTs-4、ADAMTs-5表達的影響
陳志軍,張大華(西安醫學院第一附屬醫院,西安 710077)
骨性關節炎是常見的退行性關節病變,主要病理改變為關節軟骨進行性變性破壞、邊緣骨贅形成和關節腔間隙狹窄,同時伴有不同程度的滑膜炎癥,臨床表現為膝關節疼痛和功能障礙,嚴重者可導致膝關節畸形甚至殘疾[1]。目前西醫治療骨關節炎以激素、非甾體類抗炎藥、手術等為主,尚缺乏完全治愈的有效方法,聯合中醫藥治療可延緩關節炎的病理進程,改善治療預后[2]。正清風痛寧是從中藥清風藤中提取的有效成分,主要藥用成分為鹽酸青藤堿,具有抗炎、鎮痛、免疫調節等多種作用,聯合非甾體類抗炎藥治療骨關節炎具有肯定療效,但其藥理研究多集中于抗炎消腫、抗T淋巴細胞增殖等方面,其藥理作用尚有待進一步研究探討[3 - 4]。研究[5]顯示,骨關節炎關節軟骨退化的主要病理改變為軟骨外基質降解和聚蛋白多糖的丟失,聚蛋白多糖酶家族是軟骨基質聚蛋白多糖的主要降解酶,與關節軟骨退變程度呈正相關,聚蛋白多糖酶-1和聚蛋白多糖酶-2均屬于凝血酶敏感蛋白基序去整聯蛋白域和金屬蛋白酶域蛋白(a disintegrin and metalloproteinase with thrombospondin motifs, ADAMTs)家族,故又分別命名為ADAMTs-4和ADAMTs-5。目前正清風痛寧對ADAMTs的影響目前尚未見報道,因此本實驗通過對正清風痛寧干預下實驗動物膝關節軟骨組織ADAMTs-4、ADAMTs-5的mRNA表達進行分析,旨在進一步探討正清風痛寧治療骨性關節炎的作用機制,現將結果報告如下。
1 材料和方法
1.1 實驗動物
普通級4月齡新西蘭兔48只,雌雄各半,體重2.5~2.7 kg,由西安交通大學醫學部實驗動物中心提供[SCXK (陜) 2017-0014],西安交通大學醫學部實驗動物中心[SYXK (陜) 2017-0102]分籠飼養,保持12 h晝夜節律,室溫(22±1)℃,自用飲水、攝食。并按實驗動物使用的3R原則給予人道的關懷,西安交通大學實驗倫理委員會批號:2017-0016。各組在兔齡、體重、飼養條件等一般資料方面差異均無顯著性(P> 0.05),具有可比性。
1.2 主要試劑與儀器
正清風痛寧(每片20 mg,湖南正清制藥集團股份有限公司);Trizol(美國Invitrogen公司);DHEA(Fluka公司);RevertAIDTMFirst strand cDNA Synthesis Kit(Fermentas公司);聚合酶鏈反應試劑(北京全式金生物技術有限公司);GAPDH內參和ADAMTs-4、ADAMTs-5引物由大連寶公司合成。石蠟包埋機(Sakura);LKB超薄切片機(Bio-Rad公司)。
1.3 實驗方法
1.3.1 動物分組
隨機取16只兔作為正常對照組不予處理,建模成功后將建模成功的兔隨機選取32只分為模型組和觀察組,每組16只,各組在兔齡、性別、體質量、飼養條件等一般資料方面差異均無顯著性(P> 0.05),具有可比性。
1.3.2 建立骨關節炎模型
采用膝關節制動造模方式[6]制造兔膝骨性關節炎模型,造模前實驗動物禁食10~16 h,3%戊巴比妥鈉溶液按30 mg/kg劑量耳緣靜脈注射麻醉,左后肢踝關節以上剪毛后牽拉膝關節處于伸直位,速干型石膏繃帶經熱水浸泡軟化后自腹股溝至趾頭固定,以膝關節伸直180°、踝關節背屈60°,固定后暴露出足趾觀察血液供應情況,石膏繃帶外用彈力醫用繃帶封好,防止實驗動物撕咬,制動時間6周,6周后拆除所有繃帶,隨機抽取一只實驗動物處死,取關節軟骨進行病理觀察。造模成功標準[7]:病變關節軟骨清表區粗糙或有炎性腫脹,產生裂隙,深達輻射區,深層細胞數目異常。
1.3.3 藥物干預
空白組給予10 mL生理鹽水灌胃。觀察組給予正清風痛寧治療,每片含生藥20 mg,成人用藥每日120 mg,根據Meeh-Rubner公式計算給藥劑量:成人按60 kg計算,體表面積=10.6 × (60 0002/3)/10 000=1.625 m2,每日應用劑量(g/m2)=120 mg/1.625 m2=73.85 mg/m2,3.0 kg兔體表面積=10.1 × (30002/3)/10 000=0.2101 m2,3.0 kg兔每日劑量(g)=0.2101 m2× 73.85 mg/m2=15.52 mg,每日取15.52 mg正清風痛寧溶于10 mL生理鹽水灌胃。模型組每日給予同等劑量生理鹽水灌胃。連續用藥4周。
1.3.4 大體觀察
藥物干預4周后,用3%戊巴比妥麻醉實驗動物,分離膝關節軟組織,暴露關節面,觀察關節形態、關節液、關節軟骨,關節軟骨分級標準[8]見表1。
1.3.5 光鏡觀察
大體觀察后取脛骨近端部分關節軟骨,經脫鈣、石蠟包埋、切片、HE染色后制成病理切片,光鏡下觀察,每張圖片取2個視野,按Mankin’s評分標準[9]對軟骨結構(0~3分)、軟骨細胞數量(0~3分)、潮線(0~3分)進行評分,得分越高說明病變越嚴重。
1.3.6 RT-PCR測定
取股骨內髁軟骨組織約10 mg至1 mL Trizol中勻漿,按說明書提取總RNA,PCR擴增,95℃預變性反應5 min,每個循環變性94℃ 45 s,最佳退火溫度45℃,鏈延伸72℃ 45 s反應,進行35個循環,最后72℃反應10 min,擴增產物在2%球脂糖凝膠電源,利用凝膠電源成像系統圖像采集和電源灰度測定,計算目的條帶和內參照條帶灰度值之比,進行半定量分析。GAPDH、ADAMTs-4、ADAMTs-5引物序列和退火溫度見表2。

表1 關節軟骨分級標準Tab.1 Grading standard of articular cartilage
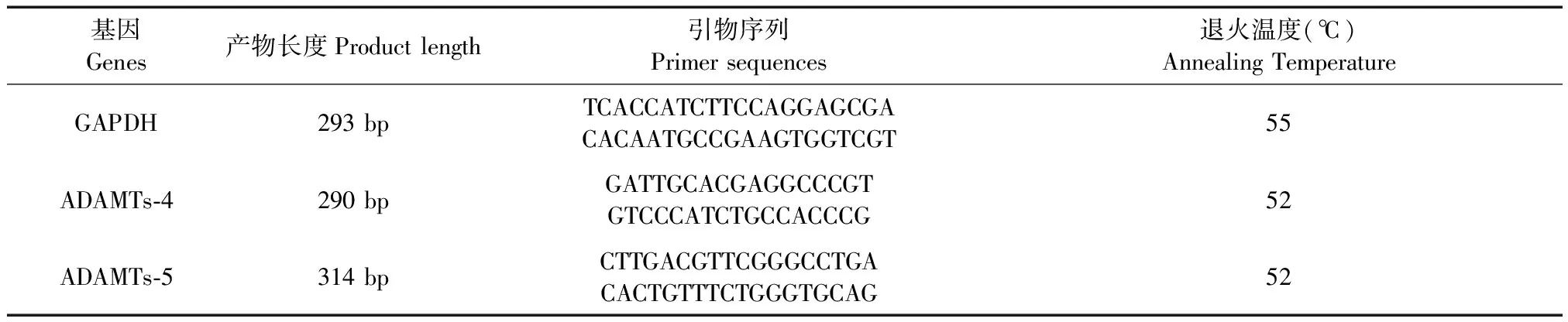
表2 GAPDH、ADAMTs-4、ADAMTs-5引物序列和退火溫度Tab.2 Primer sequences and annealing temperature of the GAPDH, ADAMTs-4 and ADAMTs-5
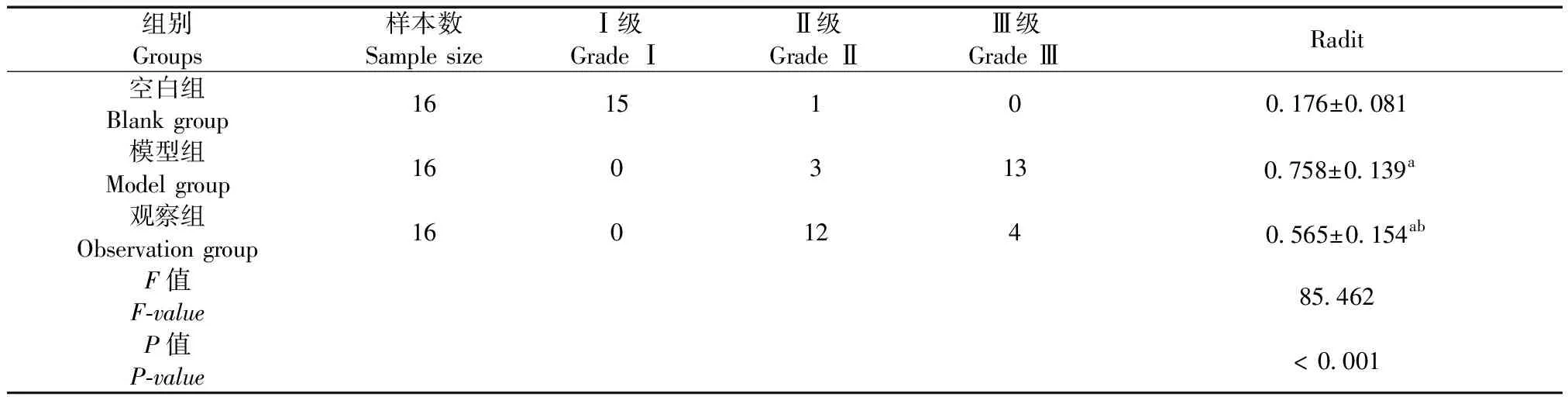
表3 三組關節軟骨分級比較Tab.3 Comparison of articular cartilage grading of the three groups
注:與空白組相比,aP< 0.05;與模型組相比,bP< 0.05。
Note.Compared with the blank group,aP< 0.05. Compared with the model group,bP< 0.05.
1.4 統計學方法
2 結果
2.1 大體觀察
空白組膝關節無腫大,關節表面光滑整齊,無滑膜增生、骨贅形成,關節軟骨透明,關節液量少,色淡黃清亮;模型組關節軟骨色澤變暗,關節軟骨磨損嚴重,部分骨質外露,軟骨邊緣有骨贅形成,關節液明顯增多,色澤渾濁;觀察組關節軟骨表面粗糙不平,未見明顯骨質外露,滑脈有不同程度增生,關節液有所增多,色澤渾濁。Radit分析顯示,空白組、模型組和觀察組關節軟骨分級相比較差異有顯著性(P< 0.05),見表3、圖1。
2.2 光鏡檢查
光鏡檢查結果和Mankin’s評分見表4,模型組Mankins’s評分高于空白組和觀察組,觀察組Mankin’s評分高于空白組,差異有顯著性(P< 0.05)。見表4、圖2。
2.3 三組ADAMTs-4和ADAMTs-5 mRNA表達相比較
模型組ADAMTs-4和ADAMTs-5 mRNA表達顯著高于觀察組和空白組,觀察組ADAMTs-4和ADAMTs-5 mRNA表達顯著高于空白組,差異有顯著性(P< 0.05)。見表5、圖3。
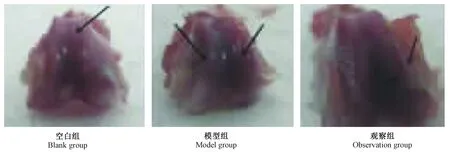
圖1 三組關節軟骨形態Fig.1 Articular cartilage morphology in the three groups
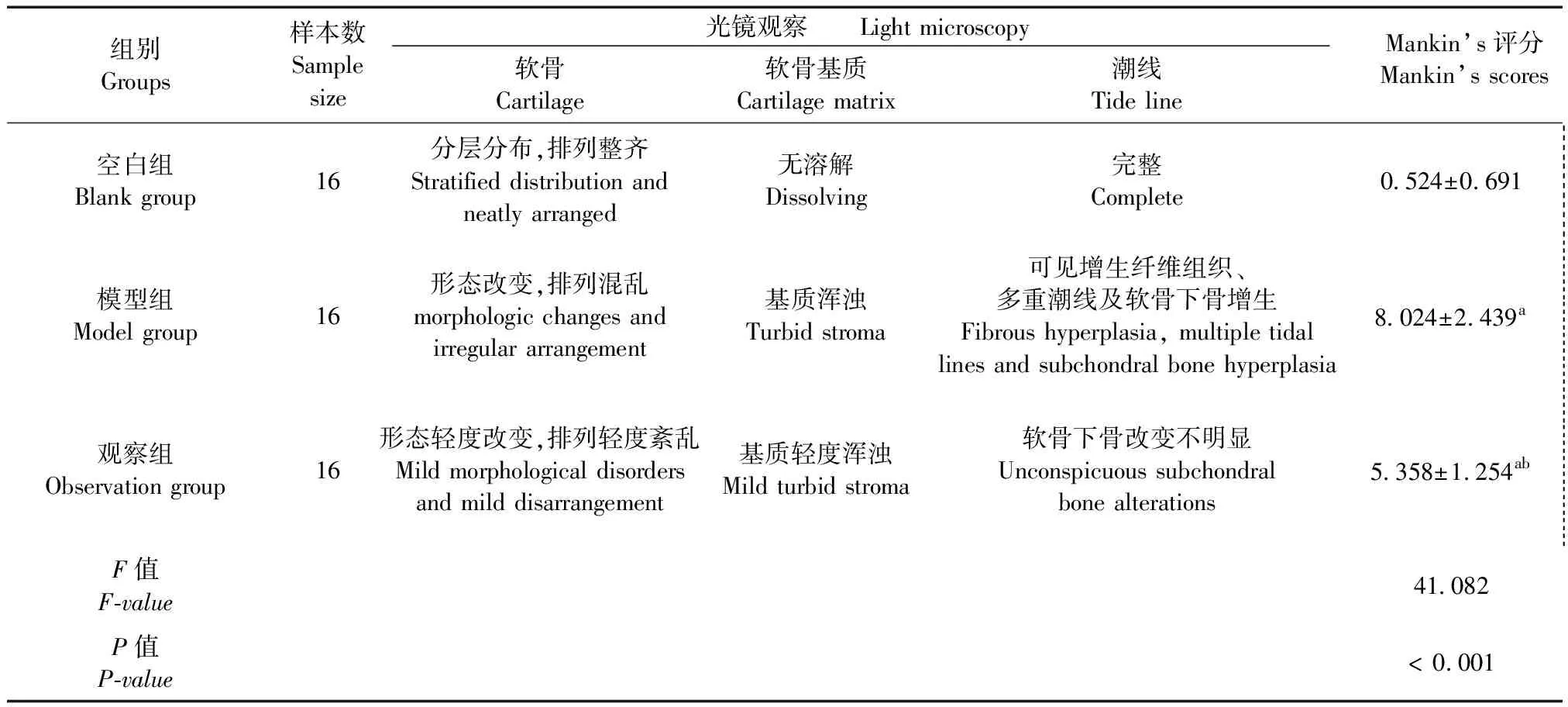
表4 三組光鏡檢查結果和Mankin’s評分相比較Tab.4 Comparison of light microscopic results and Mankin’s scores of the three groups
注:與空白組相比,aP< 0.05;與模型組相比,bP< 0.05。
Note.Compared with the blank group,aP< 0.05. Compared with the model group,bP< 0.05.

圖2 三組光鏡檢查結果Fig.2 Microscopic morphology of cartilages in the three groups
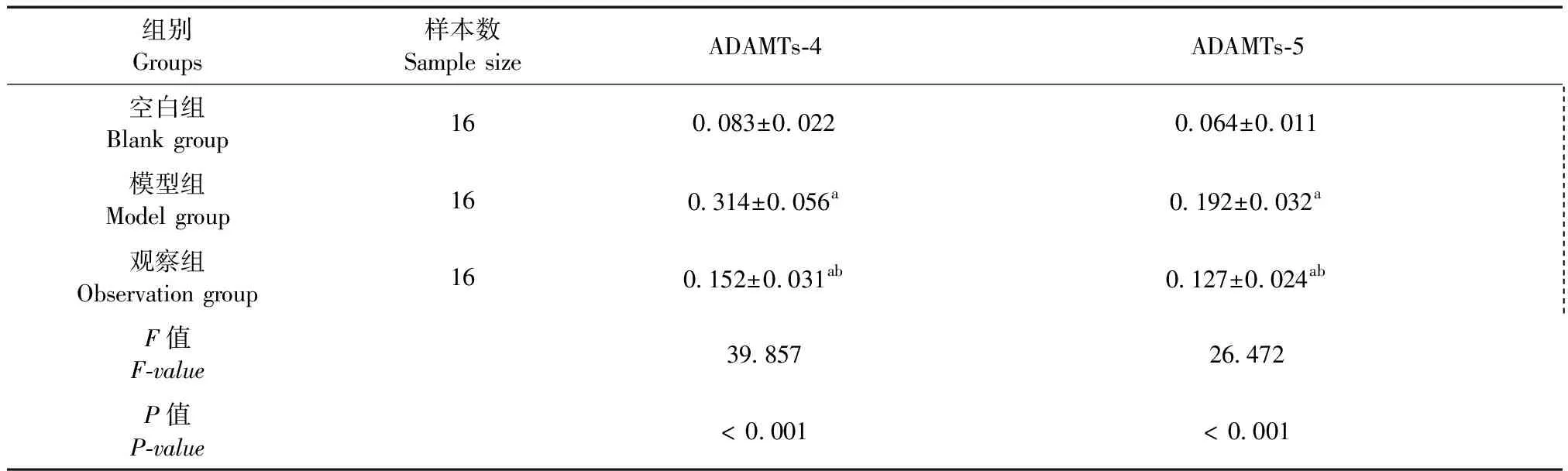
表5 三組ADAMTs-4和ADAMTs-5 mRNA表達相比較Tab.5 Comparison of expressions of ADAMTs-4 and ADAMTs-5 mRNA between the three groups
注:與空白組相比,aP< 0.05;與模型組相比,bP< 0.05。
Note.Compared with the blank group,aP< 0.05. Compared with the model group,bP< 0.05.
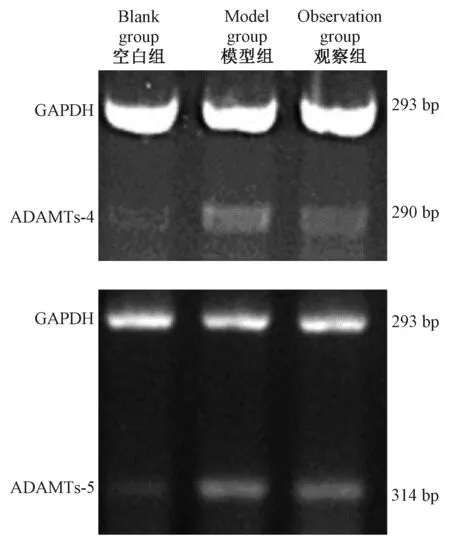
圖3 三組ADAMTs-4和ADAMTs-5 mRNA表達Fig.3 Expression of ADAMTs-4 and ADAMTs-5 mRNA in the three groups
3 討論
聚蛋白多糖擁有巨大分子量,被網在膠原蛋白網架中與散居其中的軟骨細胞共同構成關節軟骨,聚蛋白多糖丟失是軟骨破壞主要病理生理表現,引起蛋白聚多糖降解的原因很多,蛋白水解酶活性增高是主要因素[10]。既往研究認為基質金屬蛋白酶是降解聚蛋白多糖的主要酶類,近年來的顯示ADAMTs在聚蛋白多糖降解和骨關節炎發病中發揮更重要的作用,骨性關節炎不同時期關節液中ADAMTs-4和ADAMTs-5作用的降解產物ARGXX均高于基質蛋白酶降產物FFPGXX[11 - 12]。體外培養軟骨細胞的研究[13]顯示,抑制ADAMTs-4和ADAMTs-5水平可顯著減少聚蛋白多糖的降解,敲除ADAMs-5基因的實驗動物早期不會發生聚蛋白多糖丟失和軟骨破壞[14]。骨關節炎模型研究[15]顯示,早期階段僅存在ADAMTs降解產生的NTEGE新抗原表位,不存在基質蛋白酶降解產生的VDIPEN抗原,隨著ADAMTs對聚蛋白多糖的降解進展,可檢測到VDIPEN抗原表位,結果說明ADAMTs對聚蛋白多糖的降解貫穿于骨關節炎發病的各個時期,基質蛋白酶僅在骨關節炎的晚期才發揮作用。因此抑制ADAMTs活性可能是骨關節炎干預的新靶點。
骨關節炎屬中醫“骨痹”范疇,認為中年以后,腎氣漸衰精髓內虧,骨失所養,加之反復創傷勞損,風寒濕邪內侵,閉阻氣血,濕凝成痰,血停為瘀,進而深注骨骱,而致關節疼痛、強直、畸形,正虛邪實,相互為用,膠結難愈,因此風寒濕是導致本病的關鍵因素[16]。正清風痛寧為中藥清風藤的有效成分青藤堿,《本草綱目》曰:“清風藤治風濕流注,歷節鶴膝……”,具有祛風通濕、活血通絡、消腫止痛之功效,是治療風濕痹痛的常用中藥[17]。薈萃分析顯示,正清風痛寧無論是聯合用藥還是單獨應用治療骨性關節炎抑制血清IL-1β和TNF-α等炎性因子的效果均優于西藥,臨床療效優于西藥,但目前對正清風痛寧的研究多限于對炎性因子的表達的影響,其更多作用機制尚未明確,需要進一步研究[18]。
骨關節炎動物實驗和研究過程中,復制實驗動物模型是研究的關鍵點,鼠類模型關節結構與人類不同,且關節軟骨不含硫酸角質素,兔關節結構與人類接近,骨性關節炎動物模型軟骨生化指標與人類似,因此本研究試驗動物選擇兔骨性關節炎模型[19]。切斷前交叉韌帶和膝關節制動是誘導骨性關節炎的兩種常用方法,切斷前交叉韌帶可導致關節不穩,改變力學環境,導致關節退行性變,誘導骨性關節炎,關節制動在不損傷關節穩定性的情況下,通過長期固定關節,限制運動、肌肉、關節囊收縮,誘導關節軟骨的萎縮性變化和骨性關節炎[20 - 22]。二者均可成功制作膝關節骨性關節炎模型,但切斷前交叉韌帶模型造模時間較長(需6~8周),主要首動因素為基質分解,關節制動法造模時間短(需3~6周),關節軟骨損傷和基質分解為共同作用機制[23]。
因此,本研究采用關節制動法造成關節軟骨損傷,結果顯示,模型組肉眼及顯微鏡下均可關節軟骨改變,關節軟骨分級及Mankin’s評分均顯著高于空白組,ADAMTs-4和ADAMTs-5水平均顯著高于空白組,結果提示ADAMTs在骨關節炎的發病中發揮重要作用,與有關研究一致。本研究結果同時顯示,觀察組肉眼和光鏡下改變均優于模型組,關節軟骨分級及Mankin’s評分均低于模型組,ADAMTs-4和ADAMTs-5水平低于模型組,結果提示,正清風痛寧可通過抑制ADAMTs-4和ADAMTs-5抑制聚蛋白多糖降解,促進關節軟骨修復,從而達到治療骨關節炎的效果。
參考文獻:
[1] 張沖, 王恒樹, 闞秀蓮, 等. 傳統中藥補腎固筋方對膝關節炎IL-1、TNF-α的作用機制 [J]. 中國實驗動物學報, 2015, 23(3): 312-315.
[2] 陳益丹, 邱華平, 金肖青, 等. 不同針灸方法對膝骨炎模型細胞因子及基質金屬蛋白酶影響的比較研究 [J]. 中國比較醫學雜志, 2016, 26(1): 42-45, 64.
[3] 韋雋. 正清風痛寧腸溶片聯合雙氯芬酸鈉治療類風濕性關節炎效果觀察 [J]. 中國醫藥科學, 2013, 3(12): 197-198.
[4] 杜明瑞, 馮福海, 張靜. 正清風痛寧片聯合非甾體抗炎藥治療骨關節炎療效及安全性Meta分析 [J]. 中華臨床免疫和變態反應雜志, 2015, 9(2): 121-125.
[5] 史東, 董富強, 董金波, 等. ADAMTs-4、ADAMTs-5在骨關節炎患者滑膜中的表達和意義 [J]. 現代預防醫學, 2015, 42(6): 1061-1064, 1092.
[6] 高亮, 陳默, 岳萍, 等. 溫針灸對膝骨關節炎兔膝關節軟骨轉化生長因子β1和胰島素生長因子Ⅰ水平的影響 [J]. 針刺研究, 2015, 40(3): 229-232.
[7] 黃怡然, 金英利, 李娜, 等. 針刀、電針和圓利針對膝骨關節炎模型兔股直肌Bcl-2、Bax、Caspase-3蛋白表達的影響 [J]. 針刺研究, 2014, 39(2): 100-105, 123.
[8] 周效思, 周凱, 譚安雄, 等. 威靈仙對兔膝關節炎結構和功能的影響 [J]. 時珍國醫國藥, 2011, 22(10): 2454-2456.
[9] Mankin HJ, Dorfman H, Lippiello L, et al. Biochemical and metabolic abnormalities in articular cartilage from osteoarthritic human hips. Ⅱ. Correlation of morphology with biochemical and metabolic data [J]. J Bone Joint Surg Am, 1971, 53(3): 523-537.
[10] Durigova M, Nagase H, Mort JS, et al. MMPs are less efficient than ADAMTs5 in cleaving aggrecan core protein [J]. Matrix Biol, 2011, 30(2): 145-153.
[11] Verma P, Dalal K, Chopra M. Pharmacophore development and screening for discovery of potential inhibitors of ADAMTS-4 for osteoarthritis therapy [J]. J Mol Model, 2016, 22(8): 178.
[12] 張恩水, 閆新峰, 張明, 等. 聚蛋白多糖酶和基質金屬蛋白酶在骨關節炎不同時期關節液中的表達 [J]. 山東大學學報(醫學版), 2012, 50(7): 87-91.
[13] Song RH, Tortorella MD, Malfait AM, et al. Aggrecan degradation in human articular cartilage explants is mediated by both ADAMTs-4 and ADAMTs-5 [J]. Arthritis Rheum, 2007, 56(2): 575-585.
[14] Glasson SS, Askew R, Sheppard B, et al. Deletion of active ADAMTs5 prevents cartilage degradation in a murine model of osteoarthritis [J]. Nature, 2005, 434(7033): 644-648.
[15] van Meurs JB, van Lent PL, Holthuysen AE, et al. Kinetics of aggrecanase- and metalloproteinase-induced neoepitopes in various stages of cartilage destruction in murine arthritis [J]. Arthritis Rheum, 1999, 42(6): 1128-1139.
[16] 余慶陽, 黃巍. 膝骨關節炎從痹論治的病因與證候探討 [J]. 風濕病與關節炎, 2015, 4(3): 40-43.
[17] 熊力群, 余舒鵬, 李文龍, 等. 清風藤臨床應用研究概況 [J]. 亞太傳統醫藥, 2017, 13(5): 63-65.
[18] 楊潔, 曾慧, 鄭芳. 正清風痛寧與西藥對比治療膝骨性關節炎的薈萃分析 [J]. 中成藥, 2015, 37(6): 1197-1201.
[19] 乙軍, 周業庭, 徐丹, 等. 實驗性兔膝骨關節炎模型的建立 [J]. 臨床和實驗醫學雜志, 2012, 11(24): 1921-1923.
[20] 江捍平, 王大平. 骨關節炎動物模型 [J]. 中國現代醫學雜志, 2004, 14(6): 153-154, 156.
[21] 陳紫岳, 黃怡然, 李娜, 等. 電針和圓利針治療制動致膝關節功能障礙兔模型的治療效果 [J]. 世界中醫藥, 2017, 12(8): 1927-1932.
[22] 歐云生, 安洪. 鼠骨關節炎動物模型建立的現狀 [J]. 中國比較醫學雜志, 2004, 14(1): 41-44.
[23] 錢潔, 邢雪松, 梁軍. 大鼠膝關節骨性關節炎動物模型的兩種實驗方案 [J]. 實驗室研究與探索, 2014, 33(11): 23-27.

