不同病原菌刺激后仿刺參幼參體腔細胞中免疫相關酶的應答變化
陳 仲,蔣經偉,高 杉,孫紅娟,董 穎,周遵春
( 遼寧省海洋水產科學研究院,遼寧省海洋水產分子生物學重點實驗室,遼寧 大連 116023 )
仿刺參(Apostichopusjaponicus)是我國近海主要的增養殖品種之一[1]。近年來,由細菌導致的仿刺參病害頻發,造成了較大的經濟損失[2]。開展仿刺參免疫的分子機制和特性研究,將有助于利用免疫調控等手段提高仿刺參的免疫力,預防仿刺參病害發生[3]。
仿刺參屬于海洋無脊椎動物,為開管式循環系統,主要依靠體腔細胞介導的細胞免疫和體腔液上清介導的體液免疫抵御病原入侵和環境脅迫[4-5]。體腔細胞可表達多種免疫相關酶,以不同的方式參與仿刺參對病原的免疫應答。目前已鑒定出仿刺參體腔細胞中的免疫相關酶包括:堿性磷酸酶、酸性磷酸酶、酚氧化酶、超氧化物歧化酶和過氧化氫酶等。酸性磷酸酶是仿刺參吞噬細胞中溶酶體的標志酶和巨噬細胞中的重要水解酶。它可以消化細胞中由異物顆粒形成的吞噬體[6],增強對病原的吞噬作用,達到抑制或殺死病原菌的目的。堿性磷酸酶在堿性條件下可以水解病原表面的磷酸基團,達到殺死或抑制病原體的效果[7]。酚氧化酶是無脊椎動物免疫系統中的重要氧化酶,主要通過氧化酚類底物生成醌,再經非酶促反應生成黑色素[8],以直接凝集、抑制和殺傷病原,還可以促進吞噬、損傷修復等多種免疫反應[9-10]。超氧化物歧化酶是無脊椎動物體內重要的自由基清除劑,能夠清除機體吞噬病原體等過程中產生的過量活性氧,免除其對機體自身的損傷[11],同時還可以催化超氧陰離子,產生具有強殺菌活性的H2O2,直接參與抑菌、殺菌過程[12]。過氧化氫酶是無脊椎動物中重要的抗氧化酶,清除機體內的氧自由基,預防由活性氧積累而導致的氧化應激[11,13]。
筆者選用分離自仿刺參病參并被鑒定為仿刺參“腐皮綜合征”病原[14]的4株病原菌,通過追蹤不同病原菌刺激后仿刺參體腔細胞中多種免疫相關酶的活力變化,初步揭示仿刺參體腔細胞的免疫應答特點,為了解仿刺參的免疫特性、促進仿刺參的健康養殖提供科學依據。
1 材料與方法
1.1 材料
仿刺參幼參550只,體質量(6.4±1.1) g,來源于遼寧省海洋水產科學研究院引育種中心,鮮活樣品取回后于人工育苗池中常規條件暫養7 d。暫養期間不投餌,水溫16~18 ℃,pH 8.3~8.5,鹽度29。
試驗用燦爛弧菌(Vibriosplendidus)、假交替單胞菌(Pseudoalteromonasnigrifacien)、希瓦氏菌(Shewanellabaltica)和蠟樣芽孢桿菌(Bacilluscereus)的菌株信息見表1。上述菌株在150 r/min,28 ℃的條件下培養至對數生長期,4 ℃,9000 r/min離心 15 min,棄上清液,加適量無菌海水重懸,調整細菌終密度為107~108cfu/mL,用于仿刺參體腔注射。
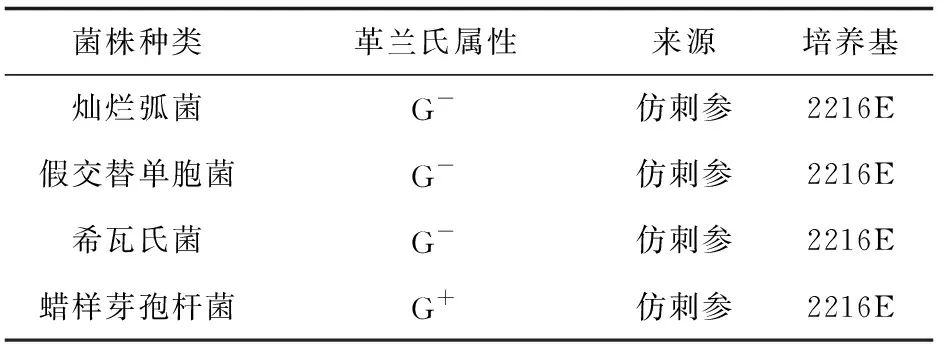
表1 試驗病原菌株信息
1.2 方法
試驗共分為5組,分別為對照組、燦爛弧菌組、假交替單胞菌組、希瓦氏菌組和蠟樣芽孢桿菌組。對照組中,用滅菌注射器通過腹部向每只仿刺參的體腔注射100 μL無菌海水,試驗組中,每只仿刺參體腔注射100 μL對應的細菌懸液,注射后仿刺參無明顯病癥。注射后0、4、12、24、48、72 h和96 h取樣,解剖獲得體腔液,4 ℃,3000 r/min 離心15 min,收集體腔細胞沉淀,用1 mL的磷酸鹽緩沖液重懸,超聲破碎儀破碎(間歇3 s 工作3 s,共10次),破碎后的體腔細胞在4 ℃、12 000 r/min條件下離心20 min,取上清液凍存于-20 ℃備用。每個試驗組每次取15只個體,平均分成3組。
酸性磷酸酶活力的測定按照對硝基苯基磷酸酯底物法[15]操作。將對硝基苯基磷酸酯溶于100 mmol/L、pH 4.5 的醋酸鈉—醋酸緩沖液中,制成2 mmol/L 的對硝基苯基磷酸酯溶液。100 μL樣品加入到對硝基苯基磷酸酯溶液中混勻,37 ℃ 30 min,再加入 2.9 mL 100 mmol/L的NaOH溶液,測定405 nm 波長下的吸光值。產生1 mg對硝基苯酚定義為1個酶活力單位(U)。
堿性磷酸酶活力測定中,將對硝基苯基磷酸酯溶于100 mmol/L,pH 9.5的甘氨酸—氫氧化鈉緩沖液,其他操作及酶活力單位定義同酸性磷酸酶[15]。
超氧化物歧化酶活力測定采用氯化硝基四氮唑藍法[16]。將50 μL 樣品加入到3 mL 反應溶液(50 mmol/L 磷酸鹽緩沖液,0.75 mmol/L 氯化硝基四氮唑藍,20 μmol/L核黃素,13 μmol/L 甲硫氨酸,pH 7.8)中混勻,30 ℃使用4000 lx 熒光照射 5 min,測定560 nm 波長下的吸光值。1 mL 反應液中超氧化物歧化酶抑制率達50%時定義為1個酶活力單位(U)。
采用多巴絡合物生成法測定酚氧化酶活力[17]。將100 μL樣品加入到2 mL左旋多巴溶液(15 mmol/L)中混勻,測定490 nm波長下的吸光值,每隔3 min測量一次,共測量10次,吸光值每分鐘增加0.001定義為1個酶活力單位(U)。
過氧化氫酶活力測定[6],將50 mmol/L, pH 7.5的磷酸緩沖液加入75 mmol/L濃度的H2O2中,直至240 nm波長吸光值達到0.04~0.06,用作底物緩沖液。將100 μL樣品加入到2.9 mL底物緩沖液中,混勻測定240 nm波長下的吸光值。每秒鐘轉化1 μmol H2O2定義為1個酶活力單位(U)。
采用考馬斯亮藍法測定蛋白質量濃度[18]。50 μL樣品與50 μL 0.15 mol/L NaCl溶液混勻,加入到1 mL 考馬斯亮藍測試液(25 mg 考馬斯亮藍G-250,25 mL 85%磷酸,12.5 mL 95% 乙醇,用超純水定容至250 mL)中,5 min后測定595 nm 波長下的吸光值。蛋白質量濃度標準曲線使用牛血清白蛋白繪制(mg/L)。
仿刺參體腔細胞的酶活力以比活力(1 mg蛋白樣品中所含有的酶活力單位)表示(U/mg)。
1.3 數據分析
所有酶活力檢測試驗均重復3次,結果以平均值±標準差表示,用SPSS 17.0進行單因素方差分析,P<0.05定義為顯著性差異。
2 結果與分析
2.1 試驗菌株刺激后仿刺參體腔細胞中酸性磷酸酶活力變化
試驗菌株刺激后12 h,仿刺參體腔細胞中的酸性磷酸酶活力均顯著高于對照組(P<0.05),其中蠟樣芽孢桿菌組活性急劇升高至約對照組的3倍。刺激后24 h,假交替單胞菌組仿刺參體腔細胞內酸性磷酸酶的活性顯著降低,其余3種試驗菌組酶活性仍高于對照組,差異顯著(P<0.05)。蠟樣芽孢桿菌組體腔細胞中的酸性磷酸酶活性始終高于對照組(圖1)。
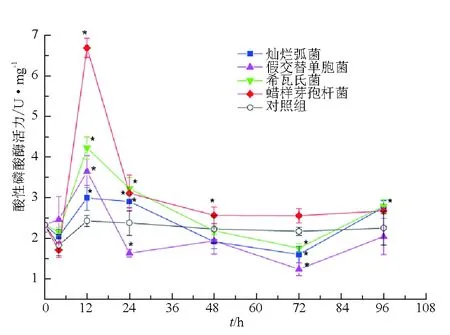
圖1 試驗菌株刺激后仿刺參體腔細胞中酸性磷酸酶活力的變化*表示與對照相比差異顯著.
2.2 試驗菌株刺激后仿刺參體腔細胞中堿性磷酸酶活力的變化
4種試驗菌株刺激在短時間(4、12 h)內均引起仿刺參體腔細胞中堿性磷酸酶活性急劇增加,其中希瓦氏菌刺激后4 h酶活力升高最明顯,比對照組高3.5 U/mg(圖2)。
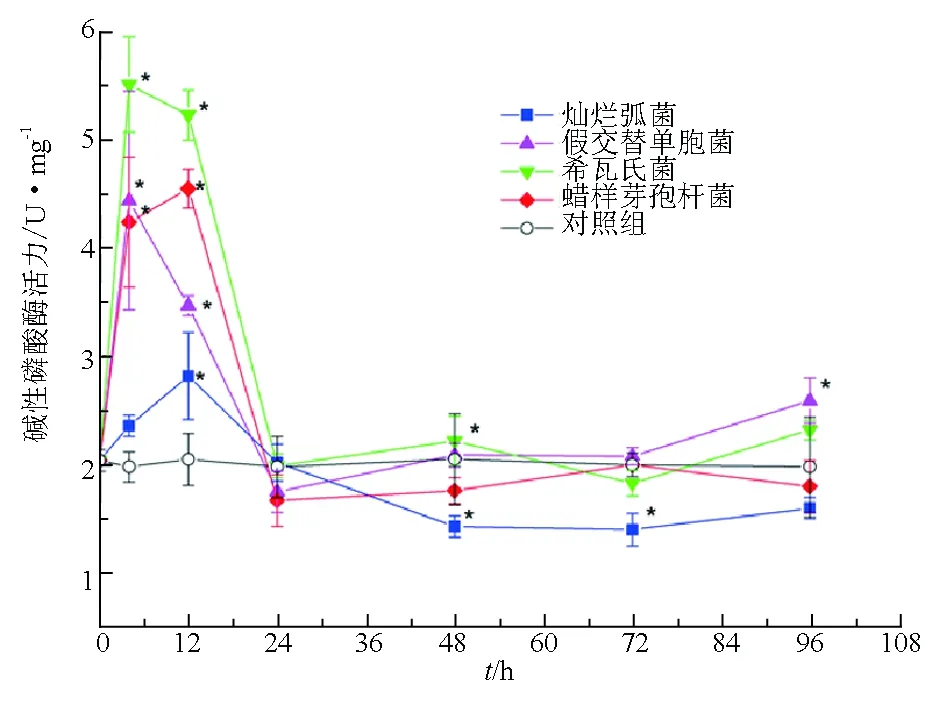
圖2 試驗菌株刺激后仿刺參體腔細胞中堿性磷酸酶活力的變化
2.3 試驗菌株刺激后仿刺參體腔細胞中酚氧化酶活力的變化
試驗菌株刺激后,仿刺參體腔細胞中酚氧化酶活力在短時間內就明顯下降,長時間保持在較低水平。其中假交替單胞菌刺激后4 h,體腔細胞中的酚氧化酶活力降低最為明顯,比對照組降低約6倍(圖3)。
圖3 試驗菌株刺激后仿刺參體腔細胞中酚氧化酶活力的變化
2.4 試驗菌株刺激后仿刺參體腔細胞中超氧化物歧化酶活力的變化
燦爛弧菌刺激后4 h,仿刺參體腔細胞中超氧化物歧化酶活力顯著高于對照組(P<0.05),之后持續下降,12 h與對照組持平,24 h后顯著低于對照組(P<0.05)。假交替單胞菌和蠟樣芽孢桿菌刺激后4 h,體腔細胞中超氧化物歧化酶活力均明顯低于對照組(P<0.05),但12 h明顯升高,其中蠟樣芽孢桿菌刺激后12 h體腔細胞中的超氧化物歧化酶活力比對照組高40 U/mg。希瓦氏菌刺激組體腔細胞中的超氧化物歧化酶活性始終低于對照組(圖4)。
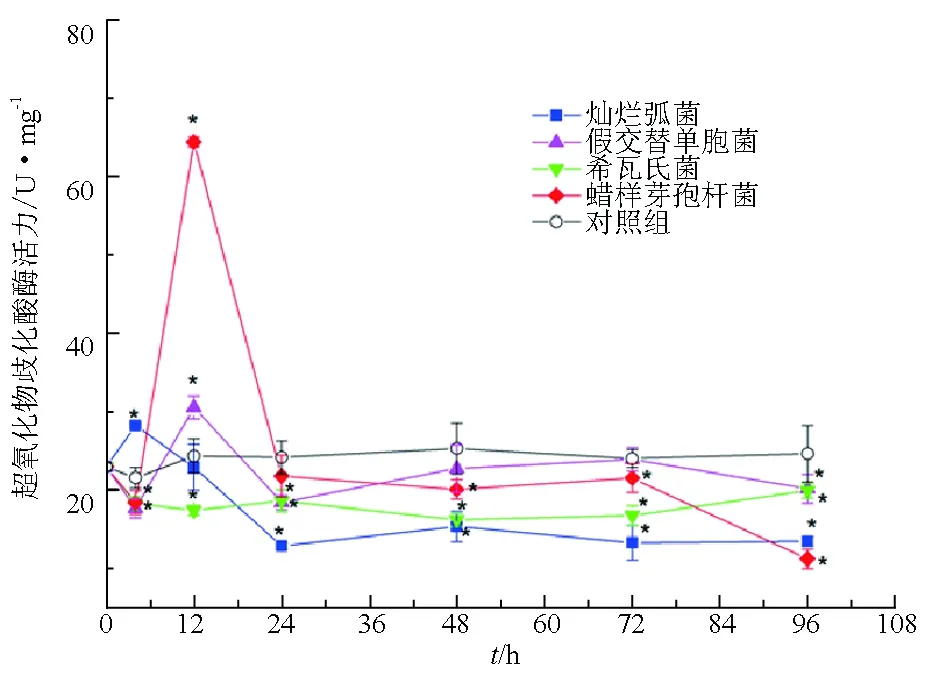
圖4 試驗菌株刺激后仿刺參體腔細胞中超氧化物歧化酶活力的變化
2.5 試驗菌株刺激后仿刺參體腔細胞中過氧化氫酶活力變化
受到試驗菌株刺激后,短時間內(4、12 h)仿刺參體腔細胞中過氧化氫酶活力均高于對照組。其中燦爛弧菌刺激后4 h酶活力達最高,其余菌株刺激后12 h酶活力達最高。蠟樣芽孢桿菌刺激后12 h,體腔細胞中過氧化氫酶活力提高最為明顯,是對照組的12.8倍(增加1847.4 U/mg)(圖5)。
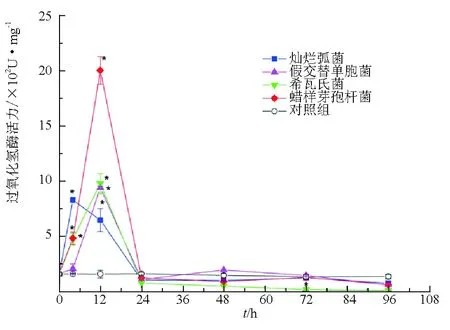
圖5 試驗菌株刺激后仿刺參體腔細胞中過氧化氫酶活力變化
3 討 論
體腔細胞是仿刺參非特異性免疫系統中細胞免疫的主要承擔者[5]。已有的報道表明,仿刺參體腔細胞中的多種免疫因子可有效應答病原菌的刺激[19-21]。然而,仿刺參體腔細胞中的免疫相關酶在不同病原菌刺激后的應答特性尚不明確。
3.1 磷酸酶免疫應答分析
本試驗表明,燦爛弧菌、假交替單胞菌、希瓦氏菌和蠟樣芽孢桿菌刺激后12 h,仿刺參體腔細胞中的酸性磷酸酶活力均顯著升高,表明體腔細胞中該酶可有效應答上述4種病原菌的入侵。然而,前期研究發現,假交替單胞菌和燦爛弧菌刺激后4 h,仿刺參體腔液上清中的酸性磷酸酶活力就顯著升高[22]。因此可以推測,在仿刺參應答燦爛弧菌和假交替單胞菌過程中,體腔細胞中酸性磷酸酶介入要晚于體腔液上清中的酸性磷酸酶,這與受大腸桿菌(Escherichiacoli)感染櫛孔扇貝(Chlamysfarreri)血細胞和血清中酸性磷酸酶活力變化相似[23]。體腔細胞中酸性磷酸酶活力的最高值出現在蠟樣芽孢桿菌(G+)刺激后,體腔液上清中酸性磷酸酶活力的最高值則出現在停乳鏈球菌(Streptococcusdysgalactiae)(G+)刺激后[22],表明仿刺參體內酸性磷酸酶可能在應對革蘭氏陽性菌的入侵中發揮重要免疫作用。4種病原菌刺激后4 h和12 h,仿刺參體腔細胞中堿性磷酸酶活力均顯著高于對照組,表明堿性磷酸酶在短時間內能積極有效參與仿刺參對上述4種細菌的免疫應答,這與燦爛弧菌刺激仿刺參后體腔液的免疫應答[22]和鰻弧菌(V.anguillarum)刺激青蛤(Cyclinasinensis)[24]的研究結果一致。
3.2 酚氧化酶免疫應答分析
受到病原刺激后,櫛孔扇貝[6]和斑節對蝦(Penaeusmonodon)[25]等水生無脊椎動物酚氧化酶快速產生了顯著變化。本實驗室前期研究也證明了酚氧化酶是仿刺參非特異性免疫系統中最敏感、高效的免疫因子之一[22]。4種病原菌刺激后,仿刺參體腔細胞酚氧化酶的活力均低于對照組,說明仿刺參體腔細胞中的酚氧化酶無法有效應答病原菌的入侵,這可能是4種細菌具有致病性的潛在原因之一。
3.3 抗氧化酶免疫應答分析
超氧化物歧化酶和過氧化氫酶是無脊椎動物體內重要的抗氧化酶[11,26],是衡量動物機體免疫能力的重要指標。本試驗中,仿刺參受燦爛弧菌刺激后4 h,超氧化物歧化酶活性顯著高于對照組,隨后開始下降;假交替單胞菌和蠟樣芽孢桿菌刺激后12 h,超氧化物歧化酶活力顯著高于對照組;希瓦氏菌刺激組體腔細胞中的超氧化物歧化酶活力始終低于對照組。上述結果表明,仿刺參體腔細胞中的超氧化物歧化酶可有效應答燦爛弧菌、假交替單胞菌和蠟樣芽胞桿菌的入侵,但其活力可能受到希瓦氏菌的抑制。雜色鮑(Haliotisdiversicolor)血淋巴中的超氧化物歧化酶活力受到大腸桿菌激活和副溶血弧菌(V.parahemolyticus)抑制[27]。以上結果說明超氧化物歧化酶對不同病原菌的免疫反應不同。仿刺參受到4種病原菌刺激后,短時間內過氧化氫酶的活力高于對照組,但隨著時間延長其免疫應答降低并恢復到正常水平,表明過氧化氫酶屬于急性應激蛋白,在病原菌的早期免疫應答中起重要作用,這與鰻弧菌、大腸桿菌激活櫛孔扇貝過氧化氫酶活力的結果一致[24,28]。
4 結 論
綜上所述,燦爛弧菌、假交替單胞菌、希瓦氏菌、蠟樣芽孢桿菌這4株試驗菌株刺激仿刺參后,短時間內體腔細胞中的兩種水解酶(酸性和堿性磷酸酶)都發揮了重要的免疫防御作用,其中酸性磷酸酶對革蘭氏陽性的蠟樣芽孢桿菌起到更有效的免疫應答。超氧化物歧化酶受到希瓦氏菌的抑制,酚氧化酶對4種病原菌均無法產生有效的免疫應答,表明這幾株病原菌對仿刺參的免疫系統具有一定的適應性,這可能是它們導致仿刺參病發的主要原因之一。
[1] 李樂,王宇辰,高磊,等. 影響仿刺參生長的主要因子研究進展[J]. 水產科學,2015,34(1):58-65.
[2] 張春云,陳國福,徐仲,等. 海參疾病學研究進展[J]. 水產科學,2011,30(10):644-648.
[3] 王淑嫻,葉海斌,于曉清,等. 海參的免疫機制研究[J]. 安徽農業科學,2012,40(25):12553-12555.
[4] Wang F Y,Yang H S,Gao F,et al. Effects of acute temperature or salinity stress on the immune response in sea cucumber,Apostichopusjaponicus[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology,2008,151(4):491-498.
[5] Ramírez-Gómez F,Aponte-Rivera F,Méndez-Castaner L,et al. Changes in holothurian coelomocyte populations following immune stimulation with different molecular patterns[J].Fish & Shellfish Immunol,2010,29(2):175-185.
[6] Xing J,Lin T,Zhan W. Variations of enzyme activities in the haemocytes of scallopChlamysfarreriafter infection with the acute virus necrobiotic virus (AVNV)[J]. Fish & Shellfish Immunology,2008,25(6):847-852.
[7] Zhang R Q,Chen Q X,Zheng W Z,et al. Inhibition kinetics of green crab (Scyllaserrata) alkaline phosphatase activity by dithiothreitol or 2-mercptoethanol[J]. Int J Biochem Cell Biol,2000,32(8):865-872.
[8] CereniusL,Lee B L,S?derh?ll K. The proPO-system:pros and cons for its role in invertebrate immunity[J]. Trends Immunol,2008,29(6):263-271.
[9] Hellio C,Bado-Nilles A,Gagnaire B,et al. Demonstration of a true phenoloxidase activity and activation of a ProPO cascade in Pacific oyster,Crassostreagigas(Thunberg)in vitro[J]. Fish & Shellfish Immunology,2007,22(4):433-440.
[10] Jiang J W,Zhou Z C,Dong Y,et al. Characterization of phenoloxidase from the sea cucumberApostichopusjaponicus[J].Immunobiology,2014,219(6):450-456.
[11] Pipe R K,Porter C,Livingstone D R. Antioxidant enzymes associated with the blood cells and hemolymph of the musselMytilusedulis[J]. Fish & Shellfish Immunology,1994,3(3):221-233.
[12] Holmblad T,S?derh?ll K. Cell adhesion molecules and antioxidative enzymes in a crustacean, possible role in immunity[J]. Aquaculture,1999,172(1):111-123.
[13] Zamocky M,Furtmüller P G,Obinger C.Evolution of catalases from bacteria to humans[J].Antioxid Redox Signal,2008,10(9):1527-1548.
[14] 李強,孫康泰,張顯昱. 刺參“腐皮綜合癥”研究進展[J]. 中國農業科技導報,2013,15(6):40-45.
[15] González F,Fárez-Vidal M E,Arias J M,et al. Partial purification and biochemical properties of acid and alkaline phosphatases fromMyxococcuscoralloidesD[J]. Journal of Applied Bacteriology,1994,77(5):567-573.
[16] Beauchamp C,Fridovich I. Superoxide dismutase:improved assays and an assays applicable to acrylamide gels[J]. Analytical Biochemistry,1971,44(1):276-287.
[17] S?derh?ll K. Fungal cell wall β-1, 3-glucans induce clotting and phenoloxidase attachment to foreign surfaces of crayfish hemocyte lysate[J]. Developmental & Comparative Immunology,1981,5(4):565-573.
[18] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[19] Chen Z,Zhou Z C,Yang A F,et al. Characterization and expression analysis of a complement component gene in sea cucumber(Apostichopusjaponicus)[J]. J Ocean Univ China,2015,14(6):1096-1104.
[20] 陳仲,楊愛馥,王擺,等. 仿刺參纖維膠凝蛋白基因的分子特征及表達分析[J]. 水產科學,2017,36(3):296-302.
[21] Yang A F,Zhou Z C,Pan Y J,et al. RNA sequencing analysis to capture the transcriptome landscape during skin ulceration syndrome progression in sea cucumberApostichopusjaponicus[J]. BMC Genomics,2016,17(1):459.
[22] 蔣經偉,叢聰,董穎,等. 不同細菌刺激后仿刺參體腔液中免疫相關酶的應答變化[J]. 動物學雜志,2015,50(6):947-956.
[23] 孫虎山,李光友. 大腸桿菌感染后櫛孔扇貝血淋巴中7種酶活力的變化[J]. 海洋科學,1999,23(5):40-44.
[24] 宋欣,張麗巖,高瑋瑋,等. 鰻弧菌(Vibrioanguillarum)侵染對青蛤(Cyclinasinensis)磷酸酶活性的影響[J]. 海洋與湖沼,2010,41(2):254-258.
[25] Radha S,Mullainadhan P,Arumugam M. Detection of two distinct types of hemolymphatic prophenoloxidase and their differential responses in the black tiger shrimp,Penaeusmonodon, upon infection by white spot syndrome virus[J]. Aquaculture,2013(376/379)(3):76-84.
[26] Roch P. Defense mechanisms and disease prevention in farmed marine invertebrates[J]. Aquaculture,1999,172(1/2):125-145.
[27] 王淑紅,王藝磊,張朝霞,等. 弧菌和大腸桿菌感染對雜色鮑無細胞血淋巴中幾種酶活力的影響[J]. 中國水產科學,2004,11(1):37-40.
[28] 樊甄姣,楊愛國,呂振明,等. 鰻弧菌注射對櫛孔扇貝免疫活性的影響[J]. 南方水產科學, 2007,3(6):52-55.

