咪唑類物質KK-42對日本沼蝦免疫功能的影響
王文鋒,關建義,寧黔冀
( 1.新鄉醫學院 生命科學技術學院,河南 新鄉 453003; 2.河南師范大學 生命科學學院,河南 新鄉 453003 )
日本沼蝦(Macrobrachiumnipponense)又名青蝦、河蝦,主要生活在江河、湖泊及池塘等淡水水域中,為我國重要的淡水養殖品種之一。但隨著養殖面積的擴大化,環境污染和病害問題也日趨嚴重,導致青蝦病害蔓延、產量降低[1]。其中,嗜水氣單胞菌(Aeromonashydrophila)是淡水養殖水體中一種重要的條件致病菌,當環境條件惡化時,養殖動物免疫機能隨之下降,可能會引起疾病的爆發。因此,如何提高蝦的抗病能力及免疫力以達到健康養殖,逐漸受到人們的重視。
日本沼蝦等甲殼動物缺乏真正的抗體,其主要依靠非特異性免疫方式實現其免疫[2],如體液免疫和細胞免疫。在機體內,諸多免疫因子參與了機體的免疫反應(抗菌肽、溶菌酶、血藍蛋白和超氧化物歧化酶等)[2-4]。研究表明,當甲殼動物受到外界病原等刺激時,則會引起呼吸爆發以及其他多種的免疫反應,這些反應均會引起大量活性氧的產生。但由于活性氧反應缺乏特異性,一是過量產生的活性氧殺滅入侵的病原微生物的同時,也會對宿主的細胞、組織和器官造成嚴重傷害[5-6]。但作為機體內的一些抗氧化酶則會及時消除機體內過量的活性氧,以維持機體的正常代謝,其中,超氧化物歧化酶就是抗氧化免疫防御途徑中一種極其重要的酶類[7]。超氧化物歧化酶分布廣泛,幾乎存在于各種需氧生物中[8]。另一種重要的免疫因子——血藍蛋白,是存在于軟體動物和節肢動物的血淋巴中的一種含銅蛋白,除基本的載氧功能外,它還是一種多功能蛋白,目前被尤為關注的是該蛋白所表現出的抗病毒、抗菌和抗血細胞凝集活性以及酚氧化物酶活性等免疫學功能[9-11]。在近年來的研究中,已將機體免疫基因的表達水平以及相應的活力大小作為衡量甲殼動物免疫水平的指標之一[7,12]。
作為一種昆蟲生長調節劑,KK-42也開始在甲殼動物方面有了一些應用[13]。如用適宜劑量的KK-42溶液浸泡凡納濱對蝦(Litopenaeusvannamei)體長0.6~0.8 cm蝦苗,不僅能加速蝦苗的生長速率[14],還可顯著提高幼蝦的成活率[15],但其作用機制尚不明確。鑒于此,考慮到日本沼蝦與凡納濱對蝦為不同的科屬,為研究KK-42對日本沼蝦是否具有同樣的作用并揭示其作用機理,筆者設計了水體常見致病菌——嗜水氣單胞菌的體內攻毒試驗,分析了KK-42處理前后日本沼蝦成活率的變化,以及免疫因子超氧化物歧化酶和血藍蛋白基因表達水平的變化,以評估KK-42對日本沼蝦免疫功能的影響,為KK-42更合理的廣泛應用提供理論基礎。
1 材料與方法
1.1 材料及試驗用蝦的養殖
KK-42由煙臺大學應用化學系提供(含量≥95%);嗜水氣單胞菌由該課題組分離并鑒定。
選取體長(45±0.5) cm蛻皮間期的健康蝦,飼養于流水養殖水槽(直徑800 mm,高1200 mm,上海海圣工貿有限公司),水溫(27±1) ℃,日投喂2次,1周后用于試驗。
1.2 日本沼蝦超氧化物歧化酶、血藍蛋白基因mRNA表達量的測定
取蛻皮間期的日本沼蝦120尾,隨機分為KK-42處理組和對照組。KK-42處理組用0.195 mmol/L的KK-42溶液浸泡處理1 min,取出后迅速控去水分,立刻投入到養殖水槽中,按正常方式飼養;對照組用不含KK-42的溶液處理,方法同上。分別提取處理后0、3、6、12、24、48 h的蝦肝胰腺總RNA,用RNase-Free DNase (Promega,USA)去除總RNA中殘留的基因組DNA。oligo (dT)18為引物反轉錄合成cDNA第一鏈,采用Real-time PCR進行時空表達分析。
根據日本沼蝦線粒體錳超氧化物歧化酶(HQ852225)、細胞質錳超氧化物歧化酶(HQ852226)、血藍蛋白(JF683437)和18S RNA(DQ531769.1)的cDNA序列,分別設計相對應目的基因引物mtSOD-F、mtSOD-R、 cytSOD-F、cytSOD-R、Hc-F、Hc-R和內參基因引物18S RNA-F、18S RNA-R。 Real-time PCR依照SYRB Premix Ex TaqTM(TaKaRa)試劑盒進行。20 μL體系中包括:cDNA模板2.0 μL,上、下游引物(10 μmol/L)各0.4 μL,SYRB Premix Ex TaqTM 1.0 μL, ROX Reference Dye 0.4 μL,ddH2O 6.8 μL。反應條件:95 ℃ 30 s,1 個循環;95 ℃ 5 s,60 ℃ 34 s,40個循環。每組樣品設3次重復,以18S rRNA作為內參基因,用2-△△ct來表示基因的相對轉錄量,結果表示為3個反應的平均值±標準差,利用SPSS 10.0軟件進行數據分析。
1.3 日本沼蝦超氧化物歧化酶活力的測定
采用超氧化物歧化酶測試盒(南京建成生物工程研究所)測定日本沼蝦肝胰腺超氧化物歧化酶活力。
1.4 日本沼蝦血藍蛋白含量的測定
血藍蛋白含量的測定參照Nickerson等的方法[16],并稍作改進。取血漿樣品100 μL,加入900 μL磷酸鹽緩沖液,在334 nm下測定光密度值OD334,按下式計算血藍蛋白質量濃度(mg/mL) :E334 nm= 2.30×OD334
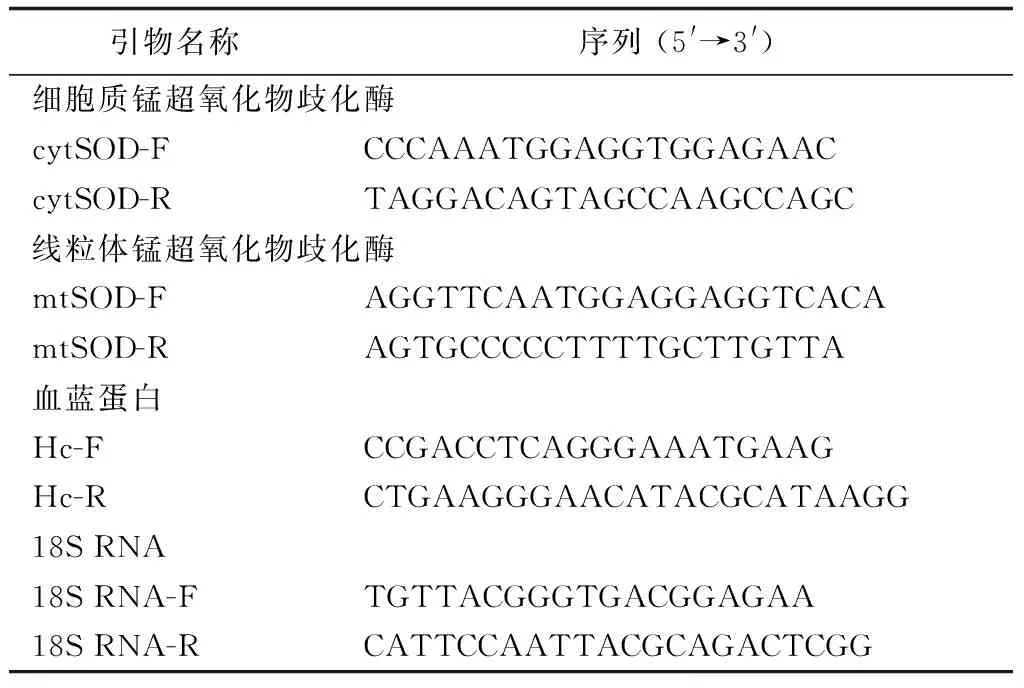
表1 試驗中所用引物
1.5 嗜水氣單胞菌急性感染試驗
選取日本沼蝦120尾,隨機分為對照組和KK-42處理組(各60尾)。KK-42處理組用KK-42溶液浸泡處理1 min,對照組用不含KK-42的溶液處理,方法同上。用KK-42預處理后12 h,分別向2組蝦腹部血竇注射密度為3.0×107個/mL的菌懸液20 μL,每組分別設3次重復。分別于注射后0、3、6、12、24、48 h 計算各組的死亡率。
2 結 果
2.1 KK-42對日本沼蝦肝胰腺錳超氧化物歧化酶表達的影響
對照組肝胰腺細胞質錳超氧化物歧化酶和線粒體錳超氧化物歧化酶mRNA的含量變化波動不大(圖1)。KK-42可明顯誘導細胞質錳超氧化物歧化酶和線粒體錳超氧化物歧化酶基因的表達,在處理后3 h均開始升高,6 h達到峰值,12 h開始下降,24 h恢復到正常水平。在處理后3、6、12 h,處理組與對照組相比,均出現顯著性差異(P<0.05)。
對照組中肝胰腺超氧化物歧化酶活力水平表現一定的波動性,但與0 h相比沒有統計學意義的差異;試驗組在KK-42處理后6 h和12 h 超氧化物歧化酶活力水平顯著升高,與相應的對照組相比具有顯著差異(P<0.05)(圖2)。
2.2 KK-42對日本沼蝦血藍蛋白基因表達及血藍蛋白含量的影響
KK-42處理能明顯誘導肝胰腺血藍蛋白基因的表達(圖3),與對照組相比,分別在KK-42處理后3、6、12 h,血藍蛋白基因的表達量均出現顯著性差異(P<0.05)。
對照組血淋巴中血藍蛋白含量變化波動不大。KK-42處理顯著提高血淋巴中血藍蛋白的含量,與對照組相比,處理后第3、6、12 h分別提高了60.2%(P<0.01)、54.2%(P<0.05)和76.9%(P<0.01)(圖4)。
2.3 KK-42對日本沼蝦感染嗜水氣單胞菌后的免疫保護
試驗期間,感染嗜水氣單胞菌后48 h內,對照組死亡率迅速上升,在24 h時升到最高點并趨向穩定;而KK-42處理組死亡率在12 h和24 h與對照組相比呈顯著性降低(圖5)。
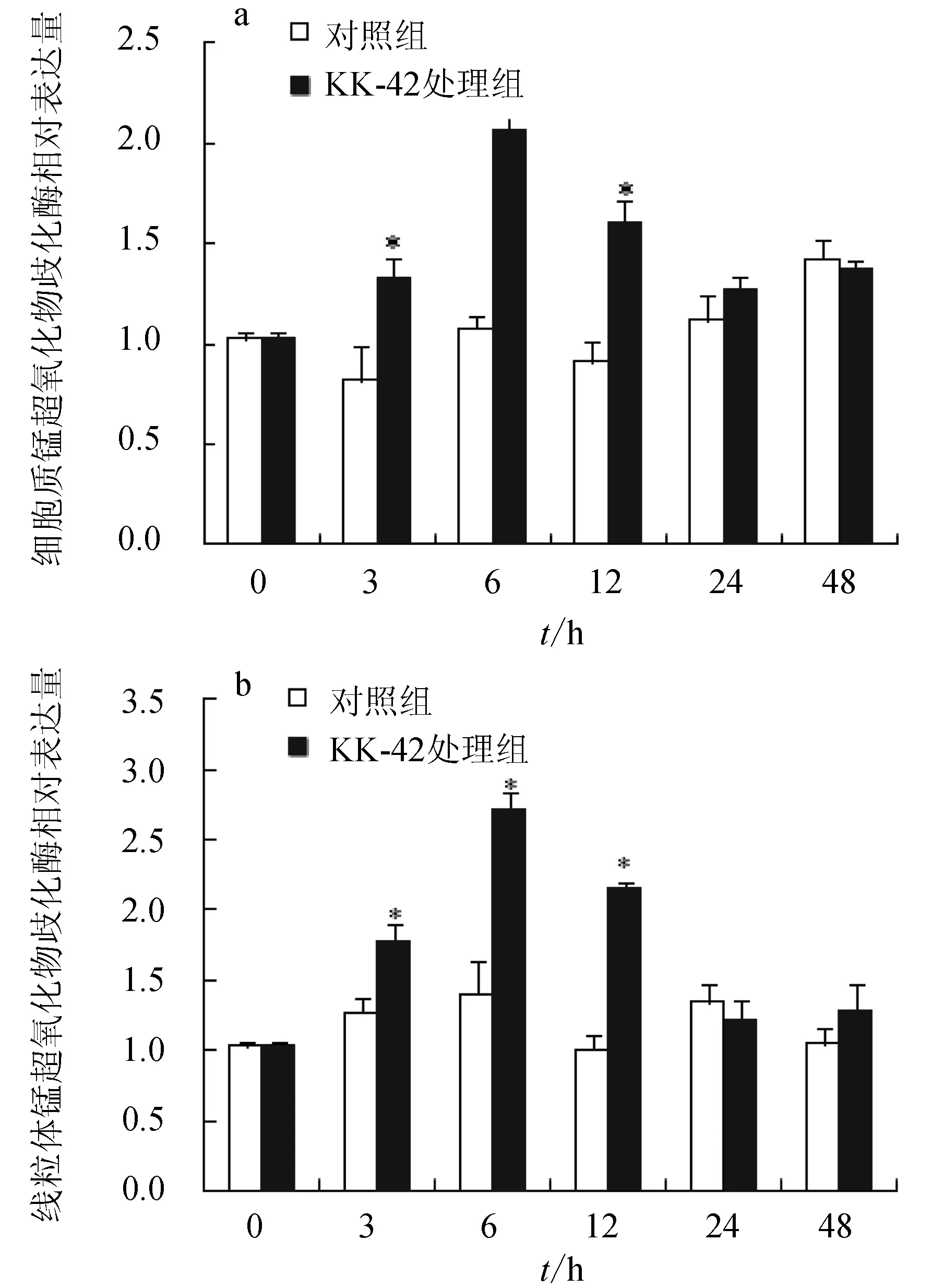
圖1 KK-42處理對日本沼蝦肝胰腺細胞質錳超氧化物歧化酶(a)和線粒體錳超氧化物歧化酶(b)基因表達的誘導“*”表示與相應對照組相比差異顯著(P<0.05).下同.
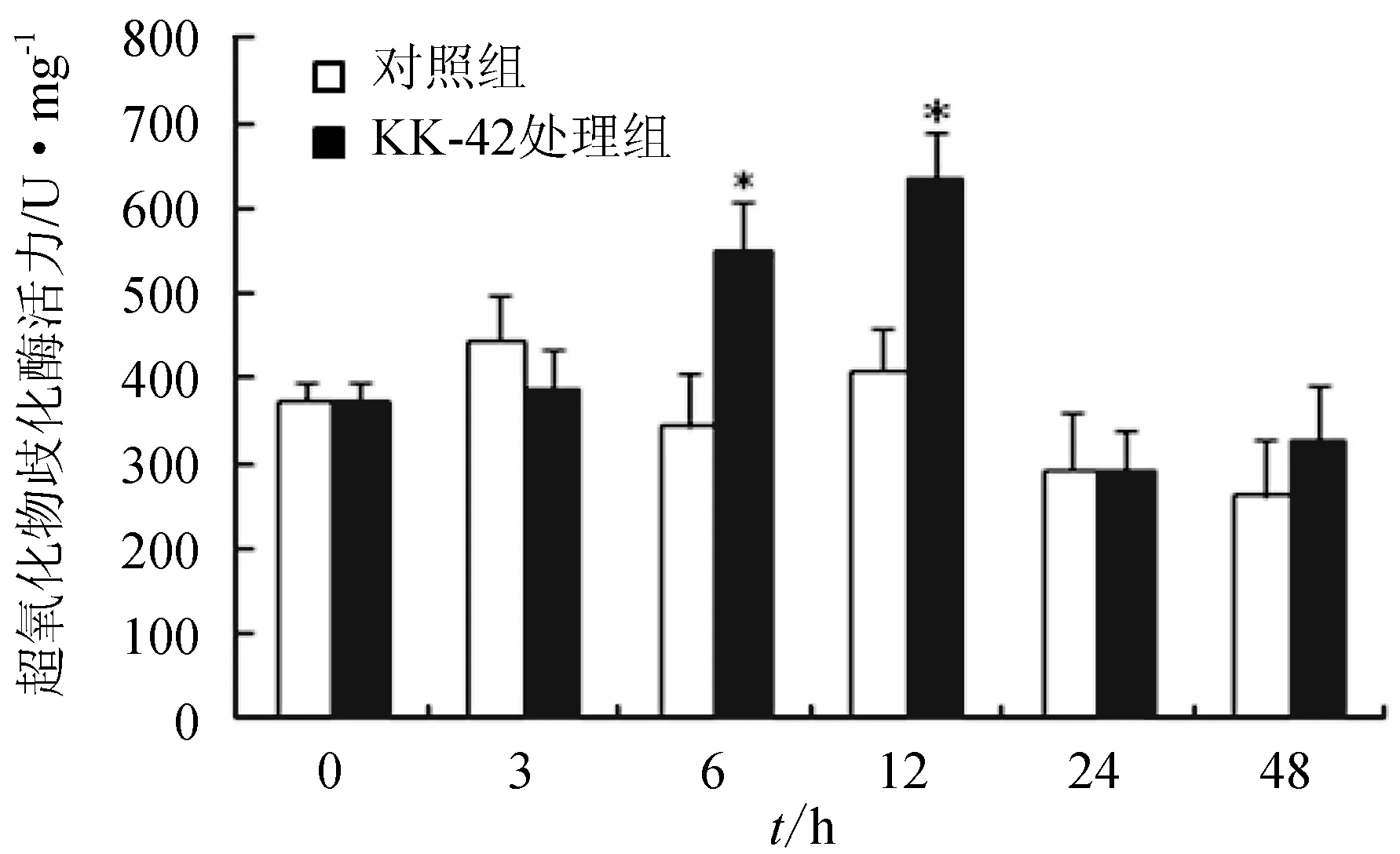
圖2 KK-42處理對日本沼蝦肝胰腺超氧化物歧化酶活力的影響

圖3 KK-42處理對日本沼蝦肝胰腺血藍蛋白基因表達的誘導
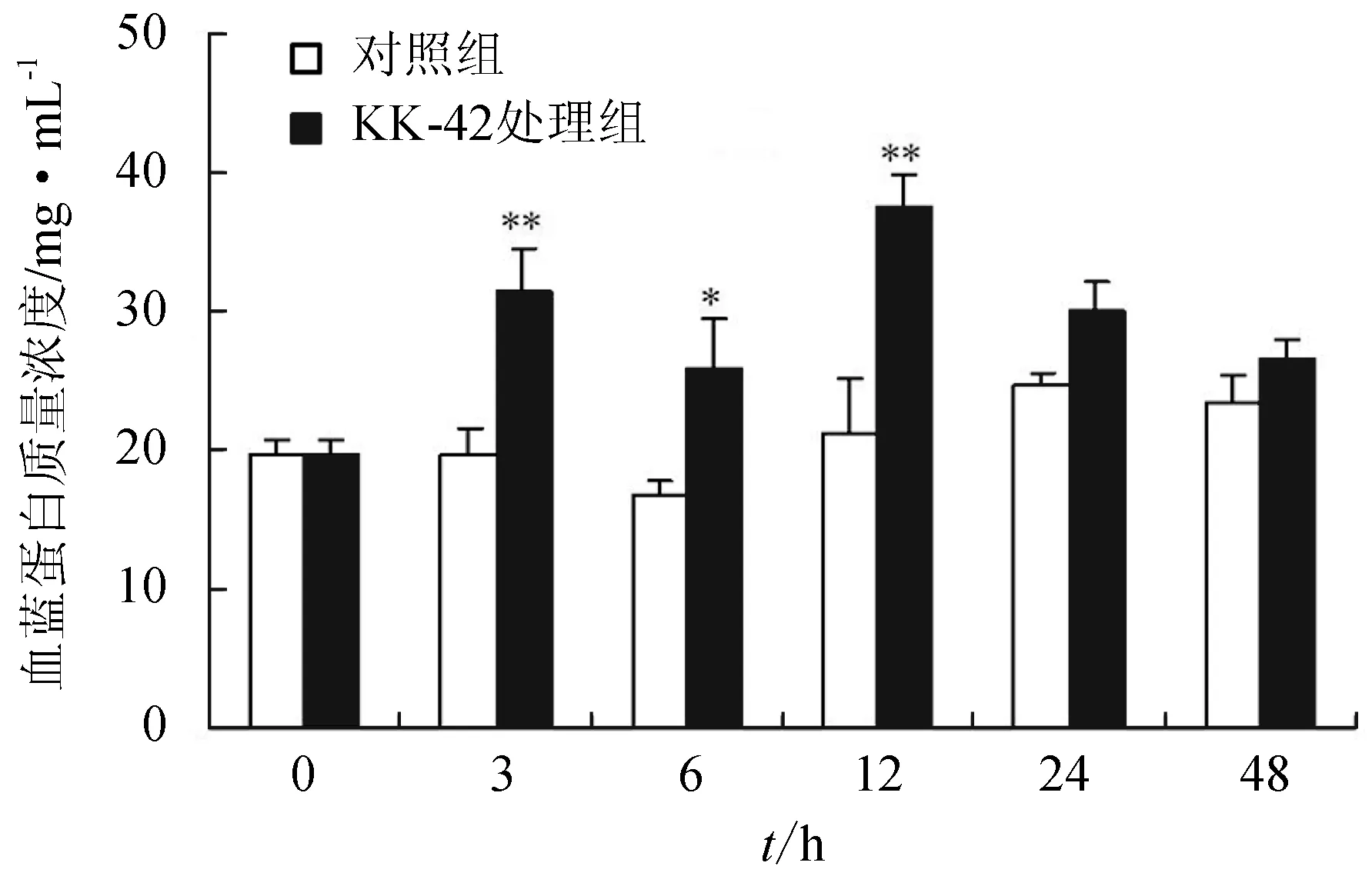
圖4 KK-42處理對日本沼蝦血藍蛋白質量濃度的影響“**” 表示與相應對照組相比有極顯著差異(P<0.01).下同.
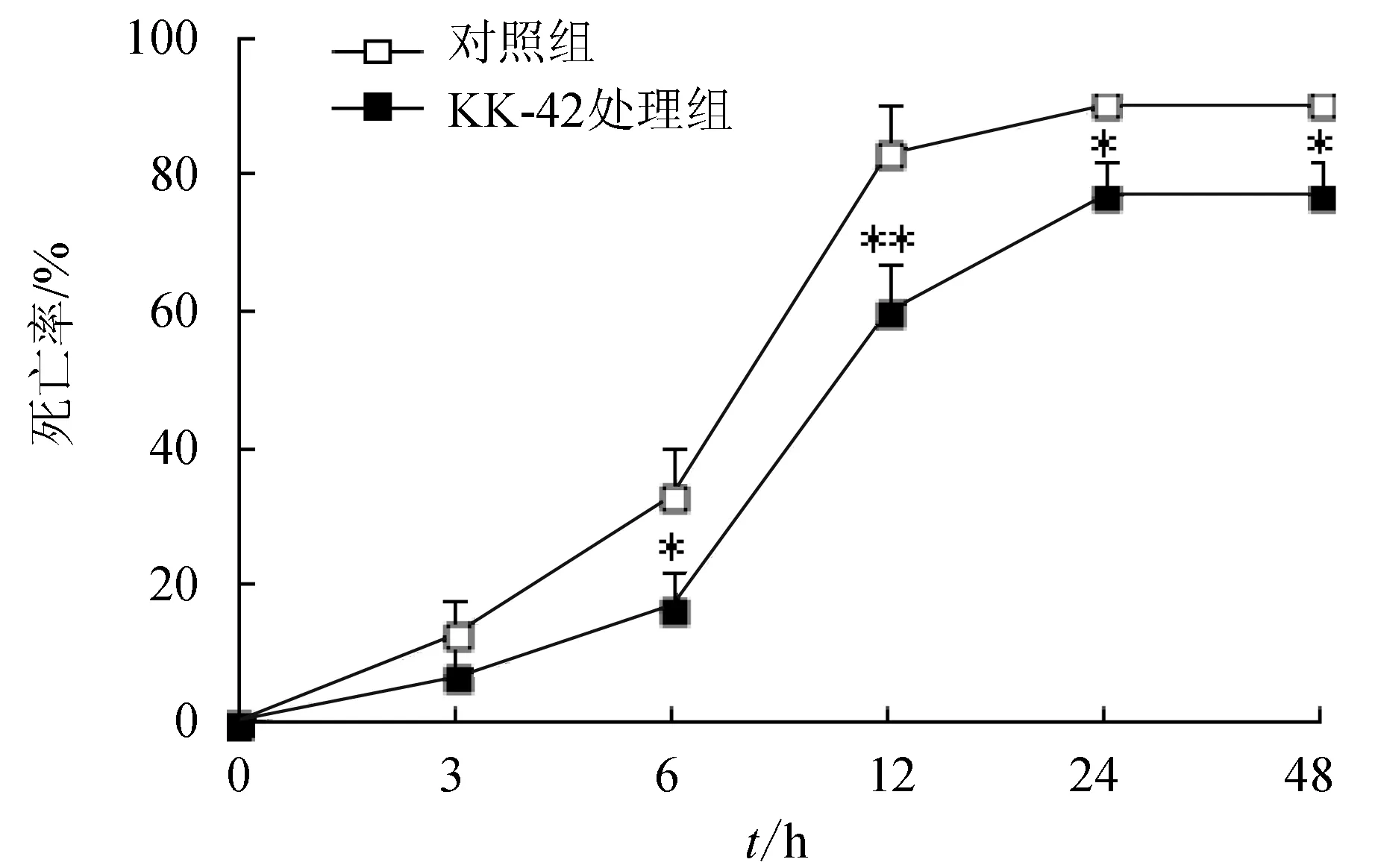
圖5 日本沼蝦感染嗜水氣單胞菌后死亡率與時間變化的關系
3 討 論
3.1 KK-42對日本沼蝦免疫相關基因表達的影響
KK-42是一種咪唑類物質,其主要是作為一種保幼激素拮抗物,如可以在蠶五齡中期適時噴施適當劑量的KK-42,可使五齡期延長,增加蠶的食桑量,也可擾亂昆蟲正常變態過程,促進幼蟲提前蛻皮,形成畸形小個體,使其脫水、饑餓而死,因這種殺蟲方法可以有效防止環境污染,因此KK-42曾廣泛用于害蟲抗性綜合治理[17-18]。鑒于目前KK-42在甲殼動物方面的研究進展[13-15],以及甲殼動物缺乏真正的抗體,主要靠非特異性的方式實現其免疫的特點,研究了KK-42對日本沼蝦一些重要免疫因子及其抗菌機能的影響,為其進一步的合理應用打下基礎。
在對甲殼動物的研究中,已將超氧化物歧化酶、酚氧化酶、溶菌酶和過氧化物酶等共同作為檢測甲殼動物免疫功能的指標酶[12]。鑒于肝胰腺在甲殼動物中執行著代謝、吸收和消化等重要生理功能,同時對環境變化也非常敏感,參與機體的免疫防御反應,因此筆者以肝胰腺為研究對象。研究結果顯示,KK-42處理可顯著誘導肝胰腺細胞質錳超氧化物歧化酶和線粒體錳超氧化物歧化酶兩個基因的表達,在處理后3 h基因表達水平明顯升高,6 h達到峰值。肝胰腺中超氧化物歧化酶活力的變化和基因表達基本一致。推測基因表達上調或者相應酶活力增高可能會減輕或避免過量活性氧對機體的傷害,從而提高了機體的免疫機能。也有前期試驗表明,KK-42可以誘導另一重要免疫相關基因——酚氧化酶及其活力的表達[19],推測KK-42誘導日本沼蝦相關免疫基因的表達有利于動物對不良環境的適應,增強其對致病菌和病毒的免疫能力,增強了動物體的耐受力。
血藍蛋白是構成甲殼動物免疫防御體系中重要的一員[9-11],其蛋白分子的N端可表現出酚氧化物酶活性, C末端產生的小分子具有抗菌肽的活性[9,20]。因前期試驗克隆得到了日本沼蝦血藍蛋白基因的全長cDNA序列,時空表達分析表明,其主要在肝胰腺中表達[20],故本研究以日本沼蝦肝胰腺中血藍蛋白基因表達水平和血淋巴中血藍蛋白含量的變化作為檢測指標,以期探討KK-42預處理對其表達的影響。結果表明,KK-42處理3 h后,可明顯誘導血藍蛋白基因的表達(圖3),血淋巴中血藍蛋白含量的變化趨勢與其基于表達基本一致(圖4),推測KK-42可以在轉錄和翻譯水平上調節血藍蛋白的表達,并通過某種途徑刺激血藍蛋白的釋放。增加的血藍蛋白除滿足呼吸等生理需求外,有可能更多地表現出一些免疫活性,如酚氧化酶活性,提高了動物對環境的適應性和對外來病原的抵抗性。
3.2 KK-42對日本沼蝦抗菌機能的影響
嗜水氣單胞菌是淡水養殖水體中一種常見的條件致病菌,其產生的外毒素,毒性較強,可引發黑鰓病和紅體病等,傳染性強,發病率高[21]。如環境條件惡化,養殖動物免疫機能隨之下降,則可能導致該疾病的爆發。為找到一種適宜的物質以提高日本沼蝦的抗菌機能,本研究以日本沼蝦的嗜水氣單胞菌進行體內攻毒試驗,結果表明,經KK-42預處理的日本沼蝦感染嗜水氣單胞菌后可以顯著降低其死亡率,同時,以往的研究表明[19], KK-42處理組還能顯著提高對嗜水氣單胞菌的清除率,提示KK-42預處理可以提高日本沼蝦的抗菌機能。
研究發現,KK-42處理可明顯誘導細胞質錳超氧化物歧化酶、線粒體錳超氧化物歧化酶和血藍蛋白免疫因子的表達和相應酶活力或者蛋白含量的提高,同時,體內嗜水氣單胞菌感染試驗表明,KK-42預處理能顯著降低日本沼蝦感染嗜水氣單胞菌后的死亡率以及對嗜水氣單胞菌的清除率。初步結果表明,KK-42預處理可以提高日本沼蝦的抗菌機能。當然,甲殼動物的免疫機制非常復雜,如細胞免疫和體液免疫,對引起的其他因子的反應尚需進一步的研究。
[1] Bachère E.Shrimp immunity and disease control [J]. Aquaculture, 2000,191(1):3-11.
[2] Chang C C, Rahmawaty A, Chang Z W. Molecular and immunological responses of the giant freshwater prawn,Macrobrachiumrosenbergii, to the organophosphorus insecticide, trichlorfon[J]. Aquat Toxicol, 2013,131(2):18-26.
[3] Lin Y C, Chen J C, Chen Y Y, et al. Crowding of white shrimpLitopenaeusvananmeidepresses their immunity to and resistance againstVibrioalginolyticusand white spot syndrome virus[J]. Fish & Shellfish Immunol, 2015,45(1):104-111.
[4] 王文鋒,關建義,呂黎, 等.日本沼蝦cytMnSOD和mtMnSOD全長克隆及表達分析[J].水產學報, 2012,36(3):49-56.
[5] Duan Y, Zhang J, Dong H, et al. Oxidative stress response of the black tiger shrimpPenaeusmonodontoVibrioparahaemolyticuschallenge[J]. Fish & Shellfish Immunol, 2015,46(2):354-365.
[6] Sun H, Xu X Y, Tian X L, et al. Activation of NF-kappaB and respiratory burst followingAspergillusfumigatusstimulation of macrophages[J]. Immunobiology , 2014, 219(1):25-36.
[7] Duan Y, Zhang J, Dong, H, et al. Effect of desiccation and resubmersion on the oxidative stress response of the kuruma shrimpMarsupenaeusjaponicus[J]. Fish & Shellfish Immunol, 2015,49(1):91-99.
[8] Xie X Q, Li F, Ying S H, et al. Additive contributions of two manganese-cored superoxide dismutases (MnSODs) to antioxidation, UV tolerance and virulence ofBeauveriabassiana[J]. PLoS One, 2012,7(1):e30298.
[9] Yan F, Zhang Y L, Luo H Q , et al. The phenoloxidase activity of hemocyanin from white leg shrimpLitopenaeusvannamei[J]. Fish Sci, 2008, 27(1):5-8.
[10] Lei K Y, Li F, Zhang M C, et al. Difference between hemocyanin subunits from shrimpPenaeusjaponicusin anti-WSSV defense[J]. Dev Comp Immunol, 2008, 32(7):808-813.
[11] Kunlaya S, Vorrapon C, Wang H C, et al. Proteomic analysis of differentially expressed proteins inPenaeusmonodonhemocytes afterVibrioharveyiinfection [J].Proteome Science, 2010, 8(1):39-50.
[12] Liu Y T, Chang C I, Hseu J R, et al. Immune responses of prophenoloxidase and cytosolic manganese superoxide dismutase in the freshwater crayfishCheraxquadricarinatusagainst a virus and bacterium[J]. Mol Immunol, 2013,56(1):72-80.
[13] 王佩,呂艷杰,呂黎,等. 咪唑類物質KK-42對日本沼蝦幾丁質酶基因表達的影響[J].水產科學,2014,33(12):777-781.
[14] Ning Q J, Fu S G, Xu X J, et al. A new and practical application of JH antagonist KK-42 to promoting growth of shrimpPenaeusschmitti[J]. Aquaculture, 2007, 270(1):422-426.
[15] 寧黔冀, 楊洪,程鴻軒. 保幼激素拮抗物溶液及其提高水產養殖甲殼動物成活率方法:中國,ZL200510017350.X [P]. 2008.
[16] Nickerson K W, Van Hold K E. A comparison of molluscan and arthopod hemocyanin in circular dichroism and absorption spectra[J]. Com Biochem Physiol, 1971, 39(4):855-872.
[17] Liu Y, Zhang Q, Denlinger D L. Imidazole derivative KK-42 boosts pupal diapause incidence and delays diapause termination in several insect species[J]. J Insect Physiol, 2015, 74(1):38.
[18] Kirane-Amrani L, Touiker S Y, Soltani-Mazouni N. Effect of imidazole derivative KK-42 on in vivo development and ecdysteroid levels in pupal stage of meal-worms[J]. Fresenius Environmental Bulletin, 2015,24(5):1856-1861.
[19] 王文鋒,關建義, 郭愛蓮, 等. 咪唑類物質KK-42提高日本沼蝦成活率機制的研究[J].中國免疫學雜志,2014,30(2):162-166.
[20] Fernando L, Garcia C, Keni C,et al. Phenoloxidase activity of hemocyanin in whiteleg shrimpPenaeusvannamei: conversion, characterization of catalytic properties, and role inPostmortemmelanosis[J]. Agric Food Chem, 2008, 56(15):6454-6459.
[21] 王文鋒, 夏西超, 王雪參, 等. 日本沼蝦血藍蛋白全長克隆及表達分析[J]. 解剖學報,2012,43(2):90-96.
[22] Sen K, Rodgers M. Distribution of six virulence factors inAeromonasspecies isolated from US drinking water utilities: a PCR identification [J]. J Appl Microbiol, 2004, 97(5):1077-1086.

