鈣蛋白酶介導 NF-κB/STAT3通路調控 巨噬細胞極化的分子機制
胡瓊依 王 強
(1復旦大學附屬中山醫院皮膚科 上海 200032; 2上海交通大學醫學院附屬瑞金醫院風濕免疫科 上海 200025)
巨噬細胞具有高度的異質性和可塑性,是器官和系統的重要調節和效應細胞,在炎癥反應中充當橋梁作用[1]。近年的研究表明,許多器官的巨噬細胞在胚胎發育期就定植于組織,并進行自我更新[2-3]。在各種微生物和其他環境因素刺激下,巨噬細胞向具有不同功能的亞型極化,通常分為經典激活的M1型巨噬細胞(classically activated macrophage,CAM)和替代激活的M2型巨噬細胞(alternatively activated macrophage,AAM)[4]。在Th1細胞分泌的干擾素-γ(interferon-γ,IFN-γ)、脂多糖(lipopolysaccharide,LPS)和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)的刺激下產生M1型巨噬細胞,分泌促炎因子如IL-12、IL-23和TNF-α,合成誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等;M2型巨噬細胞在IL-4刺激下分泌抗炎因子,如IL-10、轉化生長因子-β(transforming growth factor-β,TGF-β)及合成精氨酸酶-1 (arginase-1,Arg-1)等[5-6]。M1與M2型巨噬細胞之間的平衡對于維持免疫系統穩態具有重要作用,巨噬細胞極化中多種轉錄因子相互作用,核因子-κB(nuclear factor-kappaB,NF-κB)和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信號通路促進巨噬細胞向M1型極化;而信號轉導和轉錄活化蛋白3 (signal transducers and activators of transcription 3,STAT3)信號通路促進巨噬細胞向M2型極化[7]等。
鈣蛋白酶(calpain)屬于鈣離子依賴激活的中性半胱氨酸蛋白酶[8],廣泛表達于哺乳動物和其他多種生物。鈣蛋白酶家族有15個成員,其中廣泛表達且研究相對較多的是μ-calpain(calpain1)和 m-calpain(calpain2)。它們由兩個亞基組成,為異二聚體,分別由capn1和capn2基因編碼的大亞基即催化亞基(相對分子質量80 000)和capn4基因編碼的小亞基即調節亞基(相對分子質量28 000)組成。激活calpain1和calpain2分別需要約50和1 000μmol/L的鈣離子,其參與多種疾病的發生發展,包括肌肉功能障礙[9]、糖尿病[10]、心衰[11]等。我們團隊研究發現抑制calpain活性后,通過下調NF-κB信號通路而不是激活其上游的IKK(inhibitor of nuclear factor kappa-B kinase)活性,減輕了內毒素引發的心肌梗死的炎癥和心肌重建[12],從而改善了心肌缺血的現象[13]。
研究發現,對calpain的抑制可以直接減少小鼠心肌梗死模型中心肌組織M2的激活[14],對缺氧狀態下TGF-β刺激的巨噬細胞活化變弱[15];另外,激活calpain活性可以通過磷酸化STAT6而使M2激活[16],但既往研究均未對calpain調控巨噬細胞極化的作用和機制做深入探討;本研究以巨噬細胞RAW264.7為模型,通過細胞轉染技術對calpain進行干預,探索calpain通過NF-κB/STAT3通路調控巨噬細胞極化而發揮其誘導炎癥或抗炎癥的作用。
材 料 和 方 法
細胞和試劑巨噬細胞系RAW264.7由ATCC提供。Lipofectamine 2000 (美國Invitrogen公司),Opti-MEM(美國Invitrogen公司),脂多糖(Lipopolysaccharide,LPS)(美國Sigma公司),IL-4 (美國Peprotech公司),細胞質與細胞核蛋白提取試劑盒、BCA試劑盒(江蘇凱基生物技術股份有限公司),兔抗小鼠磷酸化p65單克隆抗體、兔抗小鼠磷酸化IKK單克隆抗體、兔抗小鼠p-JNK單克隆抗體、兔抗小鼠 STAT3單克隆抗體(美國CST公司),Trizol試劑盒、ECL顯影劑(美國Thermo Fisher Scientific公司),逆轉錄試劑盒、實時熒光定量PCR試劑盒(美國Takara公司),Transwell小室(濾膜直徑6.5 mm,美國Corning公司)。
細胞培養和體外誘導、鑒定巨噬細胞系RAW264.7培養采用含10% 胎牛血清、青霉素(100 U/mL)、鏈霉素(100 mg/L)的 DMEM培養基,在含5%CO2的37 ℃恒溫培養箱中培養。體外誘導用0.1μg/mL LPS培養 28 h,誘導出M1型巨噬細胞;采用0.02μg/mL IL-4培養28 h,誘導出 M2 型巨噬細胞[17]。
calpain1/2體外干擾通過Lipofectamine 2000將calpain1-siRNA和calpain2-siRNA分別轉染巨噬細胞(RAW264.7) 48 h后,分別誘導形成M1、M2型細胞。
qRT-PCR檢測mRNA水平利用Trizol法提取巨噬細胞總RNA,利用逆轉錄試劑盒合成 cDNA。引物設計與合成序列見表1。利用qRT-PCR試劑盒擴增,采用兩步法,第1步預變性:95 ℃ 60 s;第2步PCR反應:95 ℃ 5 s,60 ℃ 30 s,40個循環;第3步:溶解曲線分析。使用2-ΔΔCt法計算各樣本中相對mRNA量。

表1 qRT-PCR反應所用引物序列Tab1 The primers sequence of qRT- PCR
Westernblot檢測蛋白質水平提取細胞核總蛋白和細胞質蛋白,Western blot檢測巨噬細胞內calpain1、calpain2、p-IKK、p-JNK、p-p65和STAT3的蛋白質水平,顯影后的條帶用Image J 軟件分析灰度值。
Transwell遷移試驗巨噬細胞siRNA轉染48 h后,體外誘導為M1和M2型巨噬細胞,細胞用胰蛋白酶消化,制成細胞懸液鋪于Transwell上室,在Transwell下室加入含10%胎牛血清的DMEM培養基,上室加入細胞懸液,培養24 h后用棉簽小心擦去上室內的細胞,用Giemsa染色,在顯微鏡下觀察并拍照,平均取10個視野,計算遷移的細胞數。
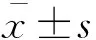
結 果
不同濃度LPS和IL-4刺激巨噬細胞后對calpain表達的影響與正常對照組相比,0.01~1.0μg/mL的LPS刺激24 h后,巨噬細胞內calpain1 mRNA水平降低,以0.01和0.1μg/mL較顯著(P<0.05);0.02~0.1μg/mL IL-4刺激24 h后,巨噬細胞內calpain1 mRNA水平明顯升高(P<0.05)。我們發現0.1和1.0μg/mL的LPS刺激24 h后,巨噬細胞內calpain2 mRNA水平均顯著升高(P<0.05);0.02和0.1μg/mL IL-4刺激24 h后,巨噬細胞內calpain2 mRNA水平降低,以0.02μg/mL最為明顯(P<0.05,圖1)。
M1、M2型巨噬細胞內calpainmRNA水平變化通過0.1μg/mL LPS或0.02μg/mL IL-4體外誘導M1、M2型巨噬細胞,qRT-PCR檢測M1相關的因子IL-23、TNF-α、iNOS和M2相關的因子IL-10、TGF-β、Arg-1的mRNA水平,結果表明M1、M2型巨噬細胞標志物存在著明顯的不同(圖2)。

A:Calpain1 mRNA expression level;B:Calpain2 mRNA expression level.(1)P<0.05.
圖1LPS和IL-4刺激巨噬細胞后calpainmRNA水平
Fig1CalpainmRNAexpressionlevelinmacrophageafterthestimulationofLPSandIL-4

A-C:M1-type macrophage;D-F:M2-type macrophage.(1)P<0.05.
圖2M1、M2型巨噬細胞各種標志物的mRNA水平
Fig2ThemRNAlevelsofmarkersinM1-typeandM2-typemacrophage
M1、M2型巨噬細胞內calpain蛋白質水平變化在M1型巨噬細胞內,calpain2蛋白質水平明顯升高(P<0.05);而在M2型巨噬細胞內,calpain 2蛋白質水平卻明顯降低(P<0.05)。calpain1蛋白質水平在M1型和M2型巨噬細胞雖有趨勢性升高,但差異均無統計學意義(圖3)。

A:M1-type macrophage;B:M2-type macrophage.(1)P<0.05.
圖3M1、M2型巨噬細胞內calpain蛋白質水平
Fig3ThecalpainproteinlevelsinM1-typeandM2-typemacrophage
Calpain干擾對巨噬細胞極化類型的影響利用siRNA技術體外構建calpain干擾的巨噬細胞,觀察calpain對巨噬細胞極化的影響(圖4)。在calpain1-siRNA組,LPS誘導巨噬細胞分泌的細胞因子IL-23、TNF-α和iNOS均減少(P<0.05);IL-4誘導巨噬細胞分泌的細胞因子TGF-β和Arg-1減少(P<0.05),而IL-10增加(P<0.05),推測calpain1可能影響巨噬細胞總數。在calpain2-siRNA組,LPS誘導巨噬細胞分泌的細胞因子IL-23、TNF-α和iNOS均減少(P<0.05);IL-4誘導巨噬細胞分泌的細胞因子TGF-β、Arg-1和IL-10均增加(P<0.05),推測calpain2可能促進巨噬細胞向M1型極化。
Calpain2干擾對巨噬細胞內NF-κB和STAT3的影響NF-κB、STAT3和JNK通路參與調控巨噬細胞極化,將巨噬細胞內calpain2干擾后再用LPS和IL-4刺激,利用Western blot觀察巨噬細胞內信號通路的變化。LPS刺激組calpain2受到干擾的細胞內總磷酸化IKK蛋白質水平降低;各組細胞總p-p65蛋白質水平無明顯差異,而calpain2受到干擾的細胞接受LPS刺激后與對照組相比胞質內p-p65蛋白質水平無明顯降低,說明p-p65核移位減少。此外,我們發現IL-4刺激后,calpain2-siRNA組與對照組相比,胞質內STAT3蛋白質水平降低,提示STAT3核移位增加。LPS刺激的對照組和calpain2干擾組細胞磷酸化JNK蛋白質水平差異無統計學意義。因此,我們推論calpain2可能通過促進NF-κB和抑制STAT3來促進巨噬細胞向M1型極化(圖5)。
Calpain影響巨噬細胞的遷移功能巨噬細胞具有遷移能力,除了calpain調控巨噬細胞極化類型,我們進一步研究了calpain對巨噬細胞移行功能的影響。利用Transwell遷移試驗,我們發現calpain1和calpain2干擾組巨噬細胞,包括M0、M1、M2的遷移能力均明顯下降(P<0.01,圖6)。
討 論
M1型巨噬細胞的刺激物有微生物產物LPS和Th1分泌的IFN-γ、TNF-α和 GM-CSF等。M1型巨噬細胞不僅分泌TNF-α、IL-1β和IL-6等細胞因子,還分泌趨化因子(C-X-C基序)配體 9[chemokine (C-X-C motif) ligand 9,CXCL 9]、CXCL10、CXCL5,促進Th1細胞免疫應答。M1型巨噬細胞合成環氧化酶2 (cyclooxygenase 2,COX-2)和iNOS,參與NO和活性氧的代謝,可以清除細菌、真菌、病毒,還可介導抗寄生蟲、抗腫瘤反應。M1型細胞持續激活導致組織損傷、炎癥并抑制修復[18-19]。

A-B:The screening results of calpain1-siRNA and calpain2-siRNA;C-D:The markers in M1-type macrophage;E-F:The markers in M2-type macrophage.(1)P<0.05.
圖4calpain-siRNA干擾后巨噬細胞極化類型
Fig4Thetypeofmacrophagepolarizationaftertheinterventionofcalpain-siRNA

A:The decrease in total protein level of p-IKK was induced by LPS;B:The decrease in plasmic protein level of STAT3 was induced by IL-4.Lane 1:Control-siRNA;Lane 2:Calpain2-siRNA.
圖5calpain干擾后信號通路活性變化
Fig5Activitychangeofsignalingpathwaybytheinterventionofcalpain

A:The results of migration of macrophages (×200);B:The calculation of migration of macrophages.(1)P<0.01.
圖6calpain干擾巨噬細胞遷移能力的變化
Fig6Changeofthemigrationinmacrophagebyinterventionofcalpain
M2型巨噬細胞分泌細胞因子TGF-β、CCL17、CCL22和CCL24等;合成和多胺代謝有關的Arg-1,多胺是膠原合成、細胞增生和組織纖維化的必需成份。M2型巨噬細胞的主要功能是抑制炎癥反應,導致組織纖維化,促進Th2免疫應答,清除寄生蟲,促進血管生成和組織修復,參與免疫調節,與過敏和哮喘有關[20]。
許多轉錄因子介導巨噬細胞極化,其中NF-κB的 p65 調控M1型細胞的極化,巨噬細胞表面Toll樣受體4 (toll-like receptor4,TLR4)與LPS結合,激活經典NF-κB通路,包括IKK磷酸化,IκBα磷酸化修飾后降解,NF-κB的p65/p50進入細胞核介導促炎因子的轉錄[21-22]。IL-10通過激活STAT3抑制NF-κB p65和STAT1,從而抑制M1型細胞極化[23]。本研究發現calpain1在M1型細胞內表達水平較 M2型低(P<0.05),而calpain2 在M1型細胞內表達水平與M2型相比明顯升高(P<0.05)。calpain2 通過抑制STAT3促進NF-κB核移位,從而促使巨噬細胞由M0型向M1型極化。calpain1、2還能影響巨噬細胞遷移能力,對calpain1、2進行下調干預后細胞的遷移能力明顯下降。
巨噬細胞受到LPS刺激后,胞質內NF-κB的p-p65減少,各組細胞總蛋白不變,意味著細胞核內p-p65增加;而巨噬細胞進行calpain2干擾后胞質內NF-κB的p-p65無明顯減少,各組細胞總蛋白不變,意味著細胞核內p-p65無明顯增加。NF-κB通路通過與其他轉錄因子相互作用介導M1型細胞極化[24],因此我們還檢測了JNK和STAT3通路,發現巨噬細胞受到LPS刺激后,無論calpain2是否受到干擾,巨噬細胞內JNK磷酸化無明顯差異;巨噬細胞受到IL-4刺激后胞質內STAT3減少,巨噬細胞calpain2受到干擾后胞質內STAT3進一步減少。本實驗中STAT3在IL-4刺激下也能激活,與文獻報道的主要通過IL-10刺激而激活的結果不同[25],其機制有待進一步研究。總之,calpain2可能通過NF-κB和 STAT3 信號通路促使巨噬細胞M0型向 M1型極化,并調控巨噬細胞的遷移。
參 考 文 獻
[1] GEISSMANN F,MANZ MG,JUNG S,etal.Development of monocytes,macrophages,and dendritic cells[J].Science,2010,327(5966):656-661.
[2] SCHULZ C,GOMEZ PERDIGUERO E,CHORRO L,etal.A lineage of myeloid cells independent of Myb and hematopoietic stem cells[J].Science,2012,336(6077):86-90.
[3] GUILLIAMS M,DE KLEER I,HENRI S,etal.Alveolar macrophages develop from fetal monocytes that differentiate into long-lived cells in the first week of life via GM-CSF[J].JExpMed,2013,210(10):1977-1992.
[4] GORDON S,MARTINEZ FO.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32(5):593-604.
[5] HAO NB,LU MH,FAN YH,etal.Macrophages in tumor microenvironments and the progression of tumors[J].ClinDevImmunol,2012,2012:948098.
[6] DING L,GU H,GAO X,etal.Aurora kinase a regulates m1 macrophage polarization and plays a role in experimental autoimmune encephalomyelitis[J].Inflammation,2015,38(2):800-811.
[7] ZHOU D,HUANG C,LIN Z,etal.Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways[J].CellSignal,2014,26(2):192-197.
[8] GOLL DE,THOMPSON VF,LI H,etal.The calpain system[J].PhysiolRev,2003,83(3):731-801.
[9] PAUL YM,ANGEBAULT-PROUTEAU C,DRIDI H,etal.ER stress disturbs SR/ER-mitochondria Ca2+transfer:implications in Duchenne muscular dystrophy[J].BiochimBiophysActa,2017,1863(9):2229-2239.
[10] ZHAO Y,CUI GM,ZHOU NN,etal.Calpain-calcineurin-nuclear factor signaling and the development of atrial fibrillation in patients with valvular heart disease and diabetes[J].JDiabetesRes,2016,2016:4639654.
[11] NI R,ZHENG D,WANG Q,etal.Deletion ofcapn4 protects the heart against endotoxemic injury by preventing atp synthase disruption and inhibiting mitochondrial superoxide generation [J].CircHeartFail,2015,8(5):988-996.
[12] MA J,WEI M,WANG Q,etal.Deficiency ofCapn4 gene inhibits nuclear factor-κB (NF-κB) protein signaling/inflammation and reduces remodeling after myocardial infarction[J].JBiolChem,2012,287(33):27480-27489.
[13] POTZ BA,SABE AA,ELMADHUN NY,etal.Calpain inhibition decreases inflammatory protein expression in vessel walls in a model of chronic myocardial ischemia[J].Surgery,2017,161(5):1394-1404.
[14] WAN F,LETAVERNIER E,LE SAUX CJ,etal.Calpastatin overexpression impairs postinfarct scar healing in mice by compromising reparative immune cell recruitment and activation[J].AmJPhysiolHeartCircPhysiol,2015,309(11):H1883-H1893.
[15] CUI W,ZHOU J,DEHNE N,etal.Hypoxia induces calpain activity and degrades SMAD2 to attenuate TGFβ signaling in macrophages[J].CellBiosci,2015,5:36.
[16] LIN YW,LEE B,LIU PS,etal.Receptor-interacting protein 140 orchestrates the dynamics of macrophage M1/M2 polarization[J].JInnateImmun,2016,8(1):97-107.
[17] BROWN KL,POON GF,BIRKENHEAD D,etal.Host defense peptide LL-37 selectively reduces proinflammatory macrophage responses[J].JImmunol,2011,186(9):5497-5505.
[18] MANTOVANI A,LOCATII M.Tumor-associated macrophages as a paradigm of macrophage plasticity,diversity,and polarization:lessons and open questions[J].ArteriosclerThrombVascBiol,2013,33(7):1478-1483.
[19] COLIN S,CHINETTI-GBAGUIDI G,STAELS B.Macrophage phenotypes in atherosclerosis[J].ImmunolRev,2014,262(1):153-166.
[20] MANTOVANI A,BISWAS SK,GALDIERO MR,etal.Macrophage plasticity and polarization in tissue repair and remodelling[J].JPathol,2013,229(2):176-185.
[21] KARIN M.Nuclear factor-kappa B in cancer development and progression[J].Nature, 2006,441(7092):431-436.
[22] WU XQ,YANG Y,LI WX,etal.Telomerase reverse transcriptase acts in a feedback loop with NF-kappa B pathway to regulate macrophage polarization in alcoholic liver disease[J].SciRep,2016,6:18685.
[23] JIANG J,JIA T,GONG W,etal.Macrophage polarization in IL-10 treatment of particle-induced inflammation and osteolysis[J].AmJPathol,2016,186(1):57-66.
[24] LAWRENCE T,NATOLI G.Transcriptional regulation of macrophage polarization:enabling diversity with identity[J].NatRevImmunol,2011,11(11):750-761.
[25] LI J,WANG X,ZHANG F,etal.Toll-like receptors as therapeutic targets for autoimmune connective tissue diseases[J].PharmacolTher,2013,138(3):441-451.

