經皮自膨脹式肺動脈瓣植入術的長期隨訪
龍愉良 潘文志 管麗華 張曉春 張 蕾 李明飛 周達新
(復旦大學附屬中山醫院心內科 上海 200011)
經皮肺動脈瓣植入術(percutaneous pulmonary valve implantation,PPVI)是治療法洛四聯癥外科根治術后肺動脈瓣中重度反流的重要手段。由于國外多采用帶瓣膜管道置換,而國內主要為跨肺動脈瓣補片術式,導致國內法洛四聯癥患者右室流出道-主肺動脈直徑往往偏大且形態多樣化,國外現有肺動脈瓣難以適用于我國患者[1]。Venus-P是針對國人設計,擁有自主知識產權,全球首個進入臨床試驗的自膨脹式肺動脈瓣。自2013年5月復旦大學附屬中山醫院在國內完成首例PPVI[2],國內數家中心相繼完成Venus-P的植入。使用Venus-P瓣膜的初步經驗及早期隨訪結果已經被報道[2-7],但目前尚無該膜瓣長期隨訪的數據報道。本研究旨在評估Venus-P的長期療效、并發癥發生率及瓣膜耐久性,為我國法洛四聯癥外科根治術后肺動脈瓣中重度反流患者治療方案的制定提供參考。
資 料 和 方 法
一般資料本研究納入2013年5月至2015年11月于復旦大學附屬中山醫院行PPVI并完成1年以上隨訪的患者共14例,男3例,女11例。除1例為單純右室流出道擴大術,其余均為右室流出道重建加跨肺動脈瓣補片術,所有患者術后并發慢性肺動脈瓣反流(2例為中度,12例為重度)。14例患者中首次接受外科矯正術年齡最小為3歲,最大為43歲,中位數11.5歲;接受PPVI與外科根治術時間間隔最短為1年,最長為35年,中位數19年,具體數據見表1。患者的入選標準及排除標準詳見我們既往發表的文獻[4],所有患者均為法洛四聯癥外科根治術后肺動脈瓣反流中、重度及以上,達到PPVI手術適應證[8],且解剖學上適合PPVI,無明顯的手術禁忌[8],本研究通過本院倫理委員會批準,所有患者均在術前簽署研究相關知情同意書。
手術方法與主要器械手術方法參考文獻[2,4],主要手術器材為Venus-P自膨脹式肺動脈瓣及其輸送系統(輸送鞘管直徑14-22F,杭州啟明醫療器械有限公司)。Venus-P瓣膜由自膨脹式鎳鈦合金支架、豬心包制成的三葉式瓣膜及覆膜組成,其支架兩側雙喇叭口設計(圖1),釋放瓣膜過程無需預先置入支架固定,且瓣環適用范圍廣(16~32 mm)。
隨訪時間及研究終點隨訪時間點為術后30天、3個月、6個月及1年,此后每年1次。主要安全終點為術后隨訪期內全因死亡。次要安全終點為隨訪期間內嚴重的心血管不良事件:人工瓣膜移位及 脫落、人工瓣膜支架斷裂、冠狀動脈壓迫、心臟或血管手術、心力衰竭、感染性心內膜炎、肺栓塞、惡性心律失常等。
表1入組患者基線資料
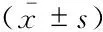

ProgramNumerical valueAge (y)35.80±7.80Female [n(%)]11 (73.3)BMI (kg/m2)20.94±2.45Age of radical surgery (y)17.47±13.43Time after radical surgery (y)17.93±10.23Pulmonary arterial diastolic pressure (mmHg)4.93±3.37NYHA class Ⅲ/Ⅳ[n(%)]4 (26.7)QRS duration (ms)169.93±21.346-minute walk distance (m)475.00±55.06Echocardiogram Diameter of pulmonary annulus (mm)23.50±5.03 Diameter of main pulmonary artery (mm)24.36±4.89 Length of main pulmonary artery (mm)38.50±9.86 Diameter of right ventricular outflow tract (mm)30.01±6.33 Severe regurgitation of pulmonary valve [n(%)]13 (86.7) Tricuspid regurgitation [n(%)]14 (93.3) Pulmonary transvalvular pressure difference (mmHg)26.92±16.38 Left ventricular ejection fraction (%)64.67±6.80Cardiac magnetic resonance images Right ventricular ejection fraction (%)47.14±9.73 Right ventricular end-diastolic volume (mL/m2)139.29±18.21
1 mmHg=0.133 kPa.
主要療效終點為患者術前與術后6個月右心室舒張末容積(由心臟磁共振測量)的改變。次要療效終點為紐約心臟病協會(NYHA)心功能分級、6分鐘步行實驗距離、超聲心動圖評價瓣膜功能(即肺動脈瓣反流程度、三尖瓣反流程度、左心室射血分數及肺動脈瓣跨瓣壓差等)、心電圖QRS波寬度、計算機斷層血管造影(computed tomography angiography,CTA)分析肺動脈支架位置及完整性。
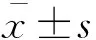
結 果
圍手術隨訪結果植入瓣膜共計14枚,其中26 mm瓣膜6枚,28 mm瓣膜4枚,30 mm瓣膜1枚,32 mm瓣膜3枚,手術成功率為100%。無患者死亡,所有患者瓣膜完全釋放后位置滿意,未出現移 位,瓣膜植入后右心導管檢查復測肺動脈舒張壓明顯升高[(4.93±3.37) mmHgvs. (11.47±4.61) mmHg,P<0.05,1 mmHg=0.133 kPa,下同]。1例患者術后1天出現發熱,經抗感染及激素治療后好轉。無患者出現冠脈壓迫、心力衰竭,惡性心律失常等其他并發癥。

A:Pulmonary regurgitation disappeared after valve implantation;B and C:The pulmonary artery CTA was checked at 6 months post operation and no valve displacement,valve stent fracture was observed.
圖1瓣膜植入術中造影及術后CT隨訪
Fig1IntraoperativeangiographyandpostoperativeCTfollowup
安全終點患者平均隨訪(2.3±0.8)年(1.0~3.5年)。隨訪3年及以上3人(20%),隨訪2~3年10人(66.7%)。1例術后4個月不明原因猝死(6.7%)。1例術后3個月出現房撲,電復律后好轉。無患者出現心衰惡化、感染性心內膜炎、惡性心律失常、再次手術等并發癥。超聲心動圖、肺動脈CTA(圖1B、C)及X線胸片顯示所有患者瓣膜位置固定,無患者出現瓣膜脫落、移位及瓣膜支架斷裂。
療效終點所有患者(包括1名猝死患者)術后6分鐘步行距離較術前均有顯著增加(圖2),術后1年6分鐘步行距離與術前相比顯著提高[(475.00±55.06) mvs. (594.23±194.51) m,P<0.05]。術后1年患者NYHA心功能較術前提升1~2個等級(Ⅰ~Ⅲ級4人,Ⅰ~Ⅱ級10人),患者術后隨訪心電圖提示QRS波寬度較術前有縮短趨勢,其中術后1個月及3個月較術前差異有統計學意義[(169.93±21.34) msvs. (159.87±24.4) ms及(160.00±27.07) ms,P均<0.05,圖3]。術后6個月隨訪心臟核磁共振顯示右心室舒張末容積較術前明顯下降[(139.29±18.21) mL/m2vs. (83.00±21.00) mL/m2,P<0.05,n=11,圖4]。隨訪中,所有患者無明顯瓣周漏或輕度及以上瓣膜反流,無右室流出道破裂或梗阻,術后1年超聲心動圖測得肺動脈瓣跨瓣壓差為(20.85±4.45) mmHg。

(1)P<0.05.
圖2PPVI6分鐘步行試驗距離
Fig2Distanceof6-minutewalktestafterPPVI

The QRS duration was decreased after PPVI,especially at 1 month [(169.93±21.34) msvs. (159.87±24.40) ms ] and 3 months [(169.93±21.34) msvs.(160.00±27.07) ms] after PPVI.(1)vs.Preoperation,P<0.05.
圖3PPVI術后心電圖示QRS波寬度
Fig3QRSdurationdetectedbyelectrocardiogafterPPVI

Six months postoperatively,right ventricular end diastolic volume measured by cardiac nuclear magnetic resonance was significantly reduced [(139.29±18.21) mL/m2vs.(83.03±20.00) mL/m2,P<0.05).The blue line in the picture represented the mean.
圖4PPVI術后6個月右心室舒張末期容積
Fig4Rightventricularend-diastolicvolumeat6monthsafterPPVI
討 論
本中心是國內最早開展PPVI的中心,本研究納入國內首批接受PPVI的患者,是目前國內樣本量最大、隨訪時間最長的關于PPVI的研究。研究使用的是針對國人設計的國產自膨脹式肺動脈瓣(Venus-P)。
自Bonhoeffer等[9]在2000年完成世界上首例PPVI,其遠期生存率及并發癥就受到密切關注。國外報道PPVI術后遠期患者死亡較為少見,且死亡原因往往為相關的合并癥而非PPVI手術本身,PPVI術后1年、2年及4年隨訪,需要再次接受介入治療的比例分別占10%、20%和30%[1,10-12],術后5年需要外科手術治療的占10%[13],高位因素包括PPVI術后右室流出道狹窄[1,14]和瓣膜支架相關并發癥[11],支架斷裂是目前已知報道最多的遠期并發癥,發生率高達30%[15-16]。支架斷裂的高危因素包括患者年齡偏小、瓣環壓縮比過大及瓣膜位于胸骨后等[11,15,17]。雖然預先置入支架可以有效減少支架斷裂風險,并可以作為瓣膜置入的定位標志,但卻額外增加手術次數及輻射照射時間[18]。
國外報道PPVI術后每年感染性心內膜炎的發生率為2.4%[18],其中多數發生于自身瓣膜而非人工肺動脈瓣。感染性心內膜炎可以造成瓣膜移位[1,19],需要植入瓣中瓣[18],嚴重者可致膿毒血癥甚至死亡[18],但絕大部分通過抗生素可以治愈,無 需再次介入或者外科手術[18]。一項關于心臟核磁共振評價患者PPVI術后左、右心功能的研究隨訪4年結果顯示,PPVI術后患者右心室舒張末容積顯著下降的同時,左心室每搏輸出量及射血分數均顯著增加[20]。
表2術前及術后6個月的主要臨床數據對比
Tab2Themainclinicaldatabeforeand6monthsafterPPVI


ProgramBaseline6 months postoperativelyPtNYHA class III/IV [n(%)]40--6-minute walk distance (m)475.0±55.1652.61±117.1<0.05-4.950QRS duration (ms)172.3±20.2162.6±21.20.2441.194LVEF%65.36±6.4965.08±3.800.8830.136RVEDV (mL/m2)139.29±18.2183.0±21.0<0.057.033
RVEDV:Right ventricular end-diastolic volume;LVEF:Left ventricular ejection fraction.
本中心隨訪[平均(2.3±0.8)年(1.0~3.5年)]結果顯示:國產自膨脹式肺動脈瓣膜(Venus-P)耐久性良好,無支架斷裂發生,瓣膜功能良好且持久,無明顯瓣周瘺及瓣膜反流,無明顯跨瓣壓差,隨訪期間無患者因為手術相關并發癥再次入院、接受心臟及血管手術等,有效性和安全性均優于國外現有瓣膜。本研究隨訪期間所有患者無心衰惡化,無感染性心內膜炎、肺栓塞、惡性心律失常等嚴重并發癥,術后心功能和6分鐘步行距離明顯提高,QRS波縮短,術后6個月右心室舒張末容積明顯下降,但左心室射血分數并無顯著差異,療效終點不劣于國外現有瓣膜。但本研究也存在入選患者人數較少、觀察時間相對較短的局限。
綜上所述,使用Venus-P治療慢性肺動脈瓣反流具有較好的長期療效和較低的并發癥發生率,該瓣膜耐久性較為良好,但還需更大的樣本量以及更長時間的隨訪研究來進一步的證實。
參 考 文 獻
[1] LURZ P,COATS L,KHAMBADKONE S,etal.Percutaneous pulm-onary valve implantation:impact of evolving technology and learning curve on clinical outcome[J].Circulation,2008,117(15):1964-1972.
[2] 周達新,潘文志,管麗華,等.經皮肺動脈瓣置入二例報道[J].中國介入心臟病學雜志,2013,21(5):332-334.
[3] 萬俊義,陸敏杰,張戈軍,等.經皮肺動脈瓣植入術后患者心功能的變化8例分析[J].中國循環雜志,2016,31(7):683-686.
[4] 潘文志,張蕾,張曉春,等.經皮自膨脹肺動脈瓣植入的初步經驗[J].中國醫學前沿雜志:電子版,2016,8(7):65-68.
[5] HUSAIN J,PRAICHASILCHAI P,GILBERT Y,etal.Early European experience with the Venus P-valve?:filling the gap in percutaneous pulmonary valve implantation[J].Eurointervention,2016,12(5):e643-e651.
[6] PROMPHAN W,PRACHASILCHAI P,SIRIPORNPITAK S,etal.Percutaneous pulmonary valve implantation with the Venus P-valve:clinical experience and early results[J].CardiolYoung,2016,26(4):698-710.
[7] CAO Q,KENNY D,ZHOU D,etal.Early clinical experience with a novel self-expanding percutaneous stent-valve in the native right ventricular outflow tract[J].CatheterCardiovascInterv,2014,84(7):1131-1137.
[8] 周達新,潘文志,葛均波.經皮肺動脈瓣置入術中國專家建議[J].中國醫學前沿雜志:電子版,2016,8 (10):20-24.
[9] BONHOEFFER P,BOUDJEMLINE Y,SALIBA Z,etal.Percutaneous replacement of pulmonary valve in a right-ventricle to pulmonary-artery prosthetic conduit with valve dysfunction[J].Lancet,2000,356(9239):1403-1405.
[10] MCELHINNEY DB,HELLENBRAND WE,ZAHN EM,etal.Short- and medium-term outcomes after transcatheter pulmonary valve placement in the expanded multicenter US melody valve trial[J].Circulation,2010,122(5):507-516.
[11] MCELHINNEY DB,CHEATHAM JP,JONES TK,etal.Stent fracture,valve dysfunction,and right ventricular outflow tract reintervention after trans-catheter pulmonary valve implantation:patient-related and procedural risk factors in the US Melody Valve Trial[J].CircCardiovascInterv,2011,4(6):602-614.
[12] VEZMAR M,CHATURVEDI R,LEE KJ,etal. Percutaneous pulmonary valve implantation in the young:2-year follow-up[J].JACCCardiovascInterv,2010,3(4):439-448.
[13] BORIK S,CREAN A,HORLICK E,etal.Percutaneous pulmonary valve implantation:5 years of follow-up.does age influence outcomes? [J].CircCardiovascInterv,2015,8(2):e001745.
[14] CHEATHAM JP,HELLENBRAND WE,ZAHN EM,etal.Clinical and hemodynamic outcomes up to 7 years after transcatheter pulmonary valve replacement in the US melody valve investigational device exemption trial[J].Circulation,2015,131(22):1960-1970.
[15] NORDMEYER J,KHAMBADKONE S,COATS L,etal.Risk stratification,systematic classification,and anticipatory management strategies for stent fracture after percutaneous pulmonary valve implantation[J].Circulation,2007,115(11):1392-1397.
[16] NORDMEYER J,LURZ P,KHAMBADKONE S,etal.Pre-stenting with a bare metal stent before percutaneous pulmonary valve implantation:acute and 1-year outcomes[J].Heart,2011,97(2):118-123.
[17] MCELHINNEY DB,BERGERSEN L,MARSHALL AC.In situ fracture of stents implanted for relief of pul- monary arterial stenosis in patients with congeni-tally malformed hearts[J].CardiolYoung,2008,18(4):405-414.
[18] MCELHINNEY DB,BENSON LN,EICKEN A,etal. Infective endocarditis after transcatheter pulmo-nary valve replacement using the Melody valve:combined results of 3 prospective North American and European studies[J].CircCardiovascInterv, 2013,6(3):292-300.
[19] EICKEN A,EWERT P,HAGER A,etal.Percutaneous pulmonary valve implantation:two-centre expe-rience with more than 100 patients[J].EurHeartJ,2011,32(10):1260-1265.
[20] SECCHI F,RESTA EC,CANNAPM,etal. Four-year cardiac magnetic resonance (CMR) follow-up of patients treated with percutaneous pulmonary valve stent implantation[J].EurRadiol,2015,25(12):3606-3613.

