海參膠原低聚肽對抗結核藥物性肝損傷改善效果
陳 婭,蔡 靜,李 勇,馬愛國
(1青島大學公共衛生學院,山東青島 266021;2北京大學公共衛生學院,北京 100191)
肝毒性藥物,包括非甾體類抗炎藥、抗感染藥物、抗腫瘤藥物、激素類藥物、某些生物制劑等[1]。利福平和異煙肼作臨床治療肺結核的一線藥物,具有潛在的肝毒性。在我國,水飛薊賓已作為包括藥物性肝損傷在內的多個指南的推薦用藥[2]。由于藥物性肝損傷的機制復雜,多是多種機制共同作用的結果,且保肝藥物本身也會有不良反應,可能會加重肝臟的負擔,因此對臨床的保肝治療爭議不斷[1-3]。
近年來,營養干預越來越受到人們的關注,已有大量的研究表明,天然食品的成分中具有抗氧化、免疫、抗炎等功效。肽的市場前景非常大,截至2016年2月,美國食品和藥物管理局(FDA)批準了60多種多肽藥物[4],超過400種肽療法在臨床前或臨床試驗階段[5]。目前已經可以從動物、植物、微生物中提取具有生物活性的肽。海參是一種豐富的海洋資源,海參干體壁含有多種生物活性物質和營養物質[6-7],它還含有多種維生素(維生素A、B1、B2、B3)和礦物質(尤其是鈣、鎂、鐵、鋅等)[7]。海參肽是一種經生物酶解得到的以小分子短鏈肽為主、多種功效成分共存的蛋白質水解產物,具有使用穩定性好、便于機體的消化吸收、毒副作用小、使用安全等優點,且具有抗氧化、免疫調節、抗菌抗腫瘤等生物活性[8-9]。已有研究表明,海參提取物對非藥物性肝損傷具有一定的保護作用,但未見其對藥物性肝損傷作用的相關研究。本研究擬通過利福平和異煙肼灌胃建立大鼠肝損傷模型,探討補充海參膠原低聚肽對利福平和異煙肼所致大鼠肝損傷的作用,為開發海參膠原低聚肽的臨床應用奠定基礎。
1 材料與方法
1.1 材料及儀器
海參膠原低聚肽(SCCOPs),淡黃色粉末,利用生物酶解技術從海參中提取的小分子生物活性肽,由吉林肽谷生物工程有限責任公司提供,使用時按濃度以蒸餾水配制溶液進行灌胃。
利福平膠囊和異煙肼片,沈陽紅旗制藥有限公司;超氧化物歧化酶、丙二醛試劑盒、過氧化氫酶試劑盒、谷胱甘肽試劑盒、考馬斯亮藍蛋白定量測試試劑盒,南京建成生物工程研究;3K30型低溫離心機,美國Sigma公司;ELx808型酶標儀,美國BioTek公司;7 500cx型電感耦合等離子質譜儀,ICP-MS,美國Agilent公司;7600型全自動生化分析儀,日本日立公司;普通光學顯微鏡,日本Olympus公司。
1.2 實驗方法
1.2.1 動物及分組 SPF 級Wistar雄性大鼠72只,4w齡,體質量200±20g,購自山東魯抗醫藥股份有限公司,動物合格證號:SCXK (魯)20140007。
大鼠適應性喂養1w后,按體質量隨機分為6組,每組12只,分別為正常對照組(A)、模型組(B)、陽性對照組(C)、海參肽低劑量組(D)、海參肽中劑量組(E)和海參肽高劑量組(F)。除A組給予0.9%生理鹽水(20mg/kg)外,其余5組分別給予異煙肼+利福平各50 mg/kg·BW,2h后,A、B組給予灌胃等體積生理鹽水,C組給予水飛薊賓22.1mg/kg·BW,D組給予SCCOPs 346 mg/kg·BW,E組給予SCCOPs 692 mg/kg·BW,F組給予SCCOPs 1 038 mg/kg·BW。實驗周期為4w,所有組都喂養普通飼料和清水,保持籠內環境整潔。每周稱量體質量,并觀察大鼠生存情況。
1.2.2 樣品采集與處理 于適應性喂養1w后,禁食12 h,斷尾取血,3 000 r/min離心10 min分離血清,-80 ℃冰箱保存備用。實驗2w后,再次禁食12 h,斷尾取血,3 000 r/min離心10 min分離血清,-80 ℃冰箱保存備用。4w實驗結束,禁食12 h,3%戊巴比妥鈉0.3 mL/kg腹腔麻醉,腹主動脈取血,3 000 r/min離心10 min分離血清和血漿,-80 ℃冰箱保存備用。完整分離肝臟并稱重,計算肝臟指數。取肝臟大葉組織進行固定用于觀察形態結構,剩余組織于-80 ℃冰箱保存備用。
1.2.3 血清ALT、AST、ALP測定 用全自動生化分析儀測量每組大鼠血清中的谷氨酸氨基轉氨酶(ALT)、天冬氨酸氨基轉氨酶((AST)、堿性磷酸酶(ALP)。
1.2.4 肝臟組織形態結構觀察及組織學評分 采用HE染色法,將肝臟用10%中性甲醛固定后,常規石蠟包埋,切片,脫蠟,HE染色,中性樹膠封片,光學顯微鏡(×200)下觀察各組大鼠肝臟組織形態結構改變。組織病理學評分標準參考文獻[10-11]。
1.2.5 肝臟系數 完整分離動物肝臟后,用生理鹽水沖洗表面血污,濾紙吸干,稱重,計算肝臟指數。
肝臟指數(%)=肝重(g)/體重(g)×100
(1)
1.2.6 大鼠肝組織中氧化應激指標測定 采用考馬斯亮藍法測定肝組織蛋白濃度、用丙二醛(MDA)試劑盒測定大鼠肝勻漿脂質過氧化情況、用超氧化物歧化酶(SOD)試劑盒測定大鼠肝勻漿抗氧化能力、用過氧化氫酶(CAT)試劑盒測定大鼠肝勻漿抗氧化能力、用谷胱甘肽(GSH)試劑盒測定大鼠肝勻漿抗氧化能力。
1.3 統計分析
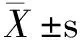
2 結果與分析
2.1 血清ALT、AST、ALP測定
4w實驗后,各組大鼠血清ALT、AST、ALP變化情況見表1。與正常對照組相比,模型組的血清ALT和ALP水平均升高(P<0.05),分別升高了6.46%和17.70%,而AST水平也有升高,但無顯著差異(P>0.05);與模型組相比,海參低聚肽各劑量組和水飛薊賓組的ALT水平分別降低了28.89%、27.77%、18.56%和25.36%,ALP水平分別降低了14.84%、24.78%、21.08%和21.00%,差異均有顯著性(P<0.05),而各干預組的血清AST水平也都有所下降,但無顯著性(P>0.05)。
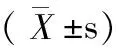
表1 各組實驗大鼠血漿ALT、AST和ALP水平
注:a與A組比較,P<0.05;b與B組比較,P<0.05
2.2 肝臟組織形態結構觀察及組織學評分
4w實驗后,HE染色結果顯示,在相同放大倍數光學顯微鏡下觀察發現,正常對照組大鼠肝臟組織無損傷改變,肝索排列整齊,無炎性浸潤;與正常對照組相比,模型組大鼠肝臟組織以中央靜脈周圍的中度和重度肝細胞變性為特征,呈現大部分肝細胞濁腫變性,分界不清;肝小葉排列不齊,肝竇道受壓變窄;肝臟組織脂肪變性廣泛,伴有炎性細胞浸潤。與模型組相比,海參低聚肽組與水飛薊賓組干預能顯著改善上述病變,肝細胞損傷明顯減輕,肝小葉結構也有所恢復,肝竇道排列整齊,部分可見脂肪變性(附圖)。

附圖 各組實驗大鼠肝臟組織病理學變化(HE染色,×200)A正常對照組;B模型組;C水飛薊賓組;D海參肽低劑量組;E海參肽中劑量組;F海參肽高劑量組
通過光學顯微鏡下觀察,對肝組織切片進行數值分級,評估肝組織損傷的病理學程度。在組織病理學檢查中,可通過觀察肝細胞壞死、脂肪變性、透明變性、氣球樣變性、Kupffer細胞和淋巴細胞浸潤的范圍來評估損傷程度(表2)。
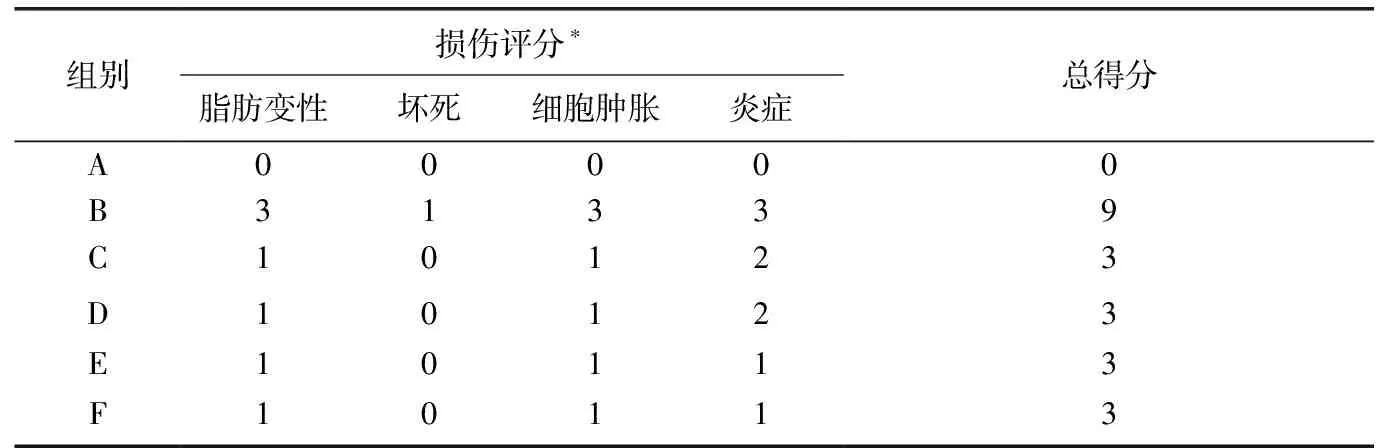
表2 各組實驗大鼠肝臟組織損傷評分
注:*肝損傷通過光鏡觀察進行評分:0分=無可見細胞損傷、1分=灶性肝細胞損傷小于25%的組織、2分=肝組織中25%~50%的局灶性肝細胞損傷、3分=廣泛但局限性肝細胞病變、4分=肝細胞整體壞死
2.3 肝臟指數
4w實驗后,正常對照組、模型組、陽性藥物組及低、中、高劑量組大鼠肝臟指數分別為2.86%±0.25%、3.28%±0.15%、2.86%±0.23%、2.98%±0.29%、2.83%±0.21%、2.92%±0.27%,組間有差異(P<0.01)。進一步兩兩比較發現,與正常對照組相比,模型組大鼠的肝臟指數升高(P<0.05);與模型組相比,中高劑量組和陽性藥物組的肝臟指數降低(P<0.05)。
2.4 大鼠肝組織中氧化應激指標測定
4w實驗后,與正常對照組相比,模型組大鼠肝勻漿MDA平均含量升高了25.17%(P<0.05),SOD活性降低了5.44%(P<0.05),CAT、GSH活性也有降低,但無顯著差異(P>0.05)。與模型組相比,海參低聚肽各劑量組和水飛薊賓組MDA含量有所降低,但無顯著性(P>0.05);水飛薊賓組的SOD、GSH活性顯著增強(P<0.05),分別上升了14.14%、12.70%,但是中高劑量的海參低聚肽SOD活性卻降低(P<0.05),海參低聚肽各劑量組CAT和GSH活性有所上升,但無顯著性(P>0.05)(表3)。
3 討論
抗結核藥物引起的肝毒性具有嚴重的毒副作用,且利福平和異煙肼聯用對藥物性肝損傷具有協同作用[12-14]。
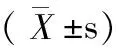
表3 各組實驗大鼠肝組織MDA含量、SOD活性、CAT活性、GSH活性
注:a與A組比較,P<0.05;b與B組比較,P<0.05。MDA:丙二醛;SOD:總超氧化物氣化酶;CAT:過氧化氫酶;GSH:谷胱甘肽
本研究擬通過利福平和異煙肼灌胃建立大鼠肝損傷模型,給藥劑量參考Baskaran[15],利福平和異煙肼的給藥劑量均定為50mg/(kg·d)。這與肺結核患者接受治療時服藥劑量相近,灌胃的方法與人類通常給藥方式相同,持續4w。
血清ALT、AST和ALP是肝損傷最常用的生化標志物。血清轉氨酶活性一直被認為是肝損傷的敏感指標。肝細胞的損傷改變了它們的運輸功能和肝細胞膜通透性,導致肝細胞內的酶被釋放到血液循環中。因此,血清中高表達的AST和ALT表明肝細胞膜受到損害。所以肝損傷的生化結果表現為ALT、AST和ALP水平升高。本實驗中,模型組大鼠血清ALT、AST和ALP含量高于正常對照組,表明大鼠藥物性肝損傷模型建立成功,且模型組大鼠的肝臟出現了病理損傷;與模型組相比,陽性藥物組和海參低聚肽各劑量組的血清ALT、ALP含量均有所下降。可見大鼠肝功能有所改善,海參低聚肽表現出一定的活性。這一結果與王寅等[16]研究結果一致。
HE染色結果以及組織學評分顯示,機體長期聯合用抗結核藥物可引起肝損傷,而海參低聚肽組能改善上述病變,如肝細胞腫脹、炎細胞浸潤、脂肪變性等。上述結果表明,海參低聚肽通過保護肝細胞和減少潛伏性、漸進性炎癥損傷而抑制利福平和異煙肼聯用引起的藥物性肝損傷。同時,肝臟指數作為反應肝組織腫脹嚴重程度的指標,與正常對照組相比,模型組大鼠的肝臟指數升高;與模型組相比,中高劑量組和陽性藥物組的肝臟指數降低,說明海參低聚肽能減輕藥物性肝損傷。這與國內外學者研究結果一致。Esmat等[17]研究發現,海參提取物能夠降低大鼠硫代乙酰胺中毒引起的血清轉氨酶升高,病理切片結果也顯示有所改善。王丹等[18]也發現,海參提取物對脂肪肝具有保護作用。
另外,肝細胞具有許多抗活性自由基的酶防御機制,抗氧化酶活性的測定是評價抗氧化防御狀態的一種間接方法[19]。研究發現,利福平和異煙肼聯用,對通過損傷細胞膜、增加脂質過氧化作用的內源性酶促氧化-抗氧化失衡、增強CYP2E1介導的生物活化機制而導致的肝毒性有協同作用,能降低SOD、CAT和GSH的活性,生成包括MDA在內的脂質過氧化產物,導致嚴重后果[20-21]。因此,抗氧化酶在解毒方面也起著重要的作用。本次試驗中,與正常對照組相比,模型組的MDA含量升高,SOD、CAT、GSH活性降低,這說明利福平和異煙肼能引起細胞脂質過氧化增強,細胞清除自由基的能力下降,細胞氧化與抗氧化系統失衡。與模型組相比,水飛薊賓組與海參低聚肽各組的SOD、CAT、GSH、MDA水平均有改善的趨勢,但是改變并不顯著,仍需進一步的實驗證實。
綜上所述,海參膠原低聚肽可以改善利福平和異煙肼聯用所致的藥物性肝損傷,為藥物性肝損傷治療中的潛在臨床應用提供科學依據。但是有關海參肽對人體保健作用的研究還比較少,其具體機制和功能學評價還需進一步實驗探討。◇
[1]中華醫學會肝病學分會藥物性肝病學組.藥物性肝損傷診治指南 [J]. 中華肝臟病雜志,2015,23(11):1752-1769.
[2]邵爽,劉春燕,高沿航.水飛薊賓治療藥物性肝損傷的研究進展 [J]. 臨床肝膽病雜志,2017,33(6):1179-1182.
[3]錢錫芬,馬雪蓮.不同保肝藥物預防性治療對抗結核藥所致肝損傷的影響 [J]. 實用臨床醫藥雜志,2016,20(17):67-70.
[4]Fosgerau K,Hoffmann T.Peptide therapeutics:current status and future directions [J]. Drug Discovery Today,2015,20(1):122-128.
[5]Ghosh S.Peptide therapeutics market:advancements in the field of Synthetic Peptides and emergence of prominent biopharmaceutical companies are fuelling the growth:global industry analysis and opportunity assessment,2015—2025[J].Future Market Insights,2016.
[6]Oliveracastillo L P Rezvega J G Mezruiz J á,et al.Release of bioactive peptides by simulated gastrointestinal digestion of sea cucumber protein (Isostichopus Badionotus)[J]. 2011.
[7]Sara B,Farooq A,Nazamid S.High-value components and bioactives from sea cucumbers for functional foods--a review [J]. Marine Drugs,2011,9(10):1761-1805.
[8]何麗霞,李勇.海參肽生物學功能研究進展 [J]. 食品科學,2015,36(9):215-218.
[9]Chen J,Ren Y,Wang G,et al.Dietary supplementation of biofloc influences growth performance,physiological stress,antioxidant status and immune response of juvenile sea cucumber Apostichopus japonicus (Selenka)[J]. Fish & Shellfish Immunology,2018,72:143-152
[10]French S W,Miyamoto K,Ohta Y,et al.Pathogenesis of experimental alcoholic liver disease in the rat [J]. Methods & Achievements in Experimental Pathology,1988,13(13):181-207.
[11]Kieiner D E.The histopathological evaluation of drug-induced liver injury[J]. Histopathology,2017,70(1):81-93.
[12]Vidyasagar R,Aithal G P.Hepatotoxicity related to anti-tuberculosis drugs:mechanisms and management [J]. Journal of Clinical & Experimental Hepatology,2013,3(1):37-49.
[13]Metushi I G,Cai P,Zhu X,et al.A fresh look at the mechanism of isoniazid-induced hepatotoxicity [J]. Clinical Pharmacology & Therapeutics,2011,89(6):911-914.
[14]Nakajima A,Fukami T,Kobayashi Y,et al.Human arylacetamide deacetylase is responsible for deacetylation of rifamycins:Rifampicin,rifabutin,and rifapentine [J]. Biochemical Pharmacology,2011,82(11):1747-1756.
[15]Baskaran U L,Sabina E P.The food supplement coenzyme Q10 and suppression of antitubercular drug-induced hepatic injury in rats:the role of antioxidant defence system,anti-inflammatory cytokine IL-10 [J]. Cell Biology & Toxicology,2015,31(4-5):211-219.
[16]王寅,李園園,郝海波,等.干酪乳桿菌對利福平和異煙肼聯用所致大鼠肝損傷的保護作用 [J]. 中國防癆雜志,2017,39(6):614-619.
[17]Esmat A Y,Said M M,Soliman A A,et al.Bioactive compounds,antioxidant potential,and hepatoprotective activity of sea cucumber (Holothuria atra)against thioacetamide intoxication in rats [J]. Nutrition,2013,29(1):258-67.
[18]王丹,丁琳,董平,等.海參皂苷對脂肪肝大鼠膽固醇代謝的調節作用 [J]. 營養學報,2016,38(1):67-70.
[19]Dakrory A I,Fahmy S R,Soliman A M,et al.Protective and curative effects of the sea cucumber holothuria atra extract against DMBA-induced hepatorenal diseases in rats [J]. Biomed Research International,2015.
[20]Dai N,ZOou Y,Zhu L,et al.Antioxidant properties of proanthocyanidins attenuate carbon tetrachloride (CCl4)-induced steatosis and liver injury in rats via CYP2E1 regulation [J]. Journal of Medicinal Food,2014,17(6):663-69.
[21]Shih T Y,Young T H,Lee H S,et al.Protective effects of kaempferol on isoniazid- and rifampicin-induced hepatotoxicity [J]. Aaps Journal,2013,15(3):753-762.

