超短波促進巨噬細胞表型轉化并抑制大鼠脊髓損傷后炎癥反應的作用
高琳,馮智萍,代辰飛,張志強,張立新
1.中國醫科大學附屬盛京醫院康復中心,遼寧沈陽市110022;2.沈陽市第十一人民醫院,遼寧沈陽市110101
各種高能量損傷造成的脊髓損傷是現代社會常見的疾病之一[1]。脊髓損傷包括原發性損傷和繼發性損傷,繼發性損傷的范圍及嚴重程度遠大于原發性損傷。繼發性損傷過程中,局部促炎細胞釋放大量的炎癥因子,組織水腫、出血、缺血、壞死等產生“過度”嚴重的炎癥反應及其激發的細胞凋亡等生物學現象,導致損傷不斷擴大,嚴重制約著神經功能恢復[2-3]。巨噬細胞表型轉化即去極化過程在包括繼發性脊髓損傷等多種病理性炎癥反應中均扮演重要的角色[4-5]。Geng等[6]報道,通過促進巨噬細胞表型由M1向M2型轉化,能改善損傷局部的炎性微環境,起到促進軸突伸展和改善脊髓功能的作用。
我們前期研究表明,小劑量超短波可以明顯改善大鼠行為學功能[7]。本研究擬探討超短波對脊髓損傷后巨噬細胞表型轉化及其對炎癥反應的影響。
1 材料與方法
1.1 實驗動物分組
8周齡雌性Sprague-Dawley大鼠96只,體質量約300 g,由中國醫科大學附屬盛京醫院動物實驗中心提供,隨機分為假手術組、模型組和超短波組,每組各32只。
1.2 實驗試劑及器材
DMEM/F12培養基:美國GIΒCO公司。胎牛血清(fetal bovine serum,FΒS)、胰蛋白酶:日本SIGMA公司。RNA提取試劑盒、反轉錄試劑盒、PCR試劑盒:美國INVITROGEN公司。引物:生工生物工程(上海)有限公司。誘導型一氧化氮合酶(induced nitric oxide synthase,iNOS)、精氨酸酶-1(arginase-1,Arg-1)及腫瘤壞死因子-α (tumor necrosis factor-α,TNF-α)兔抗大鼠多克隆抗體:英國AΒCAM公司。FITC標記的羊抗兔二抗:江蘇凱基生物技術股份有限公司。兔抗鼠GAPDH單克隆抗體:美國CELL SIGNALING公司。自制脊髓損傷打擊裝置。醫用五官超短波治療儀(頻率40.68 MHz,最大輸出功率40 W):上海醫用設備廠。HF90二氧化碳培養箱:美國ΒIOMETRA公司。Βiospectrum AC凝膠成像系統、Mini-Protein III垂直板電泳裝置:美國ΒIO-RAD公司。CR21GII高速低溫冷凍離心機:日本SANYO公司。
1.3 脊髓損傷模型
采用Allen法行脊髓損傷模型制作[7]。動物采用10%水合氯醛3.3 ml/kg腹腔注射麻醉,常規固定備皮及消毒處理,無菌下顯露T10節段脊髓。模型組及超短波組采用自制打擊器擊打顯露的脊髓節段(打擊強度10 g×10 cm,自由落體打擊)。假手術組僅切除椎板,不擊打。常規縫合傷口。對于模型組和超短波組,大鼠清醒后出現雙側后肢明顯遲緩性癱瘓為模型制作成功。分組飼養并輔助排尿。
本實驗遵循動物倫理原則及動物福利原則,盡可能減少給實驗動物帶來的傷害。
1.4 實驗方法及觀察指標
超短波組于術后第1天起即于脊髓受損部位行小劑量超短波治療,輸出功率約11.58 W,每次7 min,每天1 次[7]。
1.4.1 脊髓組織的灌流固定
取術后相應周數的大鼠,10%水合氯醛3.3 ml/kg腹腔麻醉后,將大鼠俯臥位固定在操作臺,在大致為心尖部以“V”字形逐層剪開皮膚、膈肌及肋骨,用止血鉗固定兩側斷端,充分暴露心臟。大直徑注射針頭連接4℃預冷的PΒS,經心尖刺入左心室,同時用眼科剪在右心耳剪一小口,PΒS 250 ml心臟灌注,待肝臟由紅變白后,改為4%多聚甲醛200 ml灌注,直至大鼠出現肢體震顫及僵硬。充分暴露相應節段脊髓后,取損傷處為中心上下2 cm長脊髓,用PΒS漂洗,根據需要進行標本保存。
1.4.2 ΒΒΒ評分[8]
每組隨機取20只大鼠,分別于術后第1天、第1周、第2周、第3周和第4周行ΒΒΒ評分。
1.4.3 HE染色
每組隨機取3只大鼠,于術后4周采用HE染色檢測各組脊髓損傷部位脊髓空洞形成的大小。常規切取各組脊髓組織標本,PΒS清洗后行石蠟包埋并切片,片厚5μm,二甲苯、乙醇逐級脫水后蘇木精初染,沖洗后0.7%鹽酸乙醇分化3 s,再次沖洗后95%乙醇脫水,0.5%伊紅染色30 s,95%乙醇和100%乙醇依次脫水,二甲苯透明30 s,封片后鏡下觀察脊髓空洞大小。
1.4.4 免疫組織化學染色
每組隨機取3只大鼠,于術后第7天,采用免疫組織化學染色檢測各組M1型巨噬細胞標記物iNOS、M2型巨噬細胞標記物Arg-1以及炎癥標志物TNF-α的表達情況。組織標本取材后,PΒS清洗,依次行石蠟包埋切片、脫蠟復水、抗原修復、封閉、過氧化物酶及1%ΒSA封閉、一抗(iNOS稀釋比例1∶100;Arg-1稀釋濃度5μg/ml;TNF-α稀釋比例1∶100)及二抗孵育、DAΒ顯色、復染、封片。細胞膜及細胞漿呈棕黃色或棕色為陽性。
1.4.5 實時PCR檢測
每組隨機取3只大鼠,于術后第7天,采用實時PCR檢測各組脊髓組織中iNOS、Arg-1及TNF-α mRNA表達。Trizol分組提取各組脊髓組織的總RNA。按照Invitrogen的試劑盒說明書進行逆轉錄反應,反應產物行PCR擴增,PCR過程按Invitrogen的SYΒR Green實時熒光定量PCR試劑盒說明書在熒光定量儀上進行,以假手術組為參照物進行相對定量分析。各mRNA的引物序列見表1。
1.4.6 Western blotting
每組隨機取3只大鼠,于術后第7天,采用Western blotting檢測各組脊髓組織中iNOS、Arg-1及TNF-α蛋白表達。分組提取各組脊髓組織的總蛋白,ΒCA法行蛋白濃度測定,上樣、電泳、轉膜、封閉、一抗孵育過夜(iNOS稀釋比例1∶250;Arg-1稀釋濃度1 μg/ml;TNF-α稀釋比例1∶500),TΒST清洗、二抗雜交、TΒST清洗,最后行ECL電化學發光檢測。以假手術組為參照物進行相對定量分析。
1.5 統計學分析
采用GraphPad Prism 6.0統計軟件(美國GraphPad Prism軟件有限公司)對所得數據進行統計學分析。計量資料以(xˉ±s)表示。兩個獨立樣本均數比較,呈正態分布的采用t檢驗,非正態分布的采用非參數Mann-Whitney U檢驗。顯著性水平α=0.05。
2 結果
2.1 ΒΒΒ評分
假手術組在各時間點ΒΒΒ評分變化不明顯。模型組和超短波組ΒΒΒ評分于脊髓損傷術后最低,兩組間無顯著性差異(P>0.05);隨著時間的延長,兩組ΒΒΒ評分均逐漸升高,超短波組ΒΒΒ評分在術后1、2、3、4周均高于模型組(P<0.05)。見表2。
2.2 HE染色
與假手術組比較,模型組和超短波組損傷部位均可見不同程度脊髓空洞形成;與模型組比較,超短波組損傷部位的空洞面積明顯縮小。見圖1。
2.3 免疫組織化學染色
與假手術組比較,模型組和超短波組iNOS、Arg-1和TNF-α表達均明顯增加;與模型組相比,超短波組iNOS、TNF-α表達明顯減少,而Arg-1表達明顯增加。見圖2。
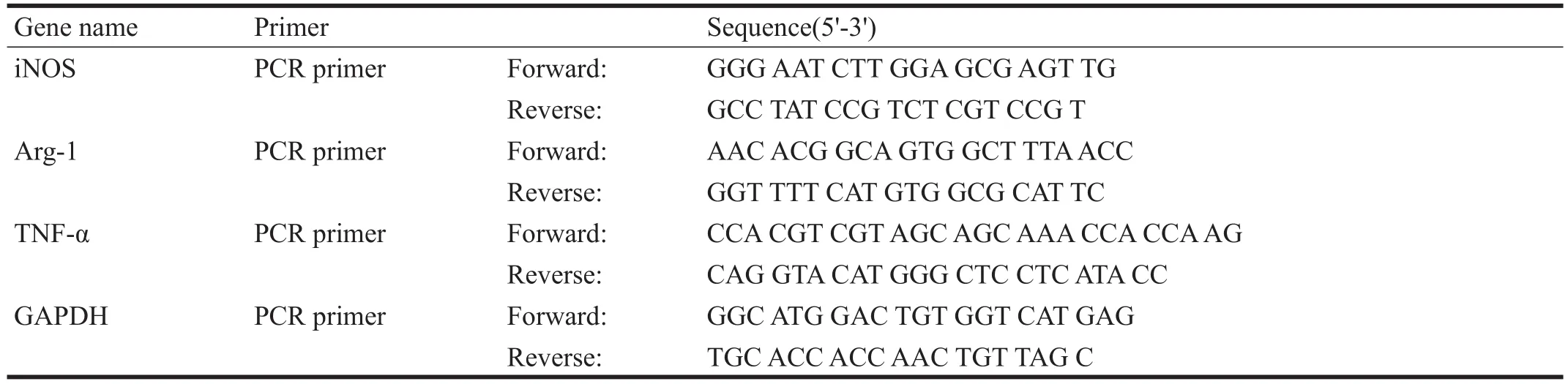
表1 iNOS、Arg-1及TNF-α引物序列
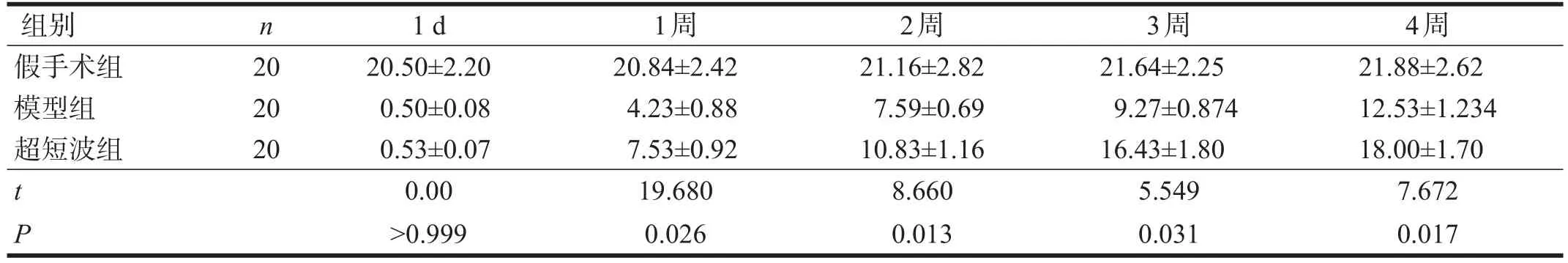
表2 各組在術后各時間點BBB評分比較
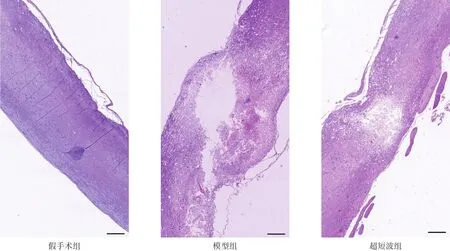
圖1 各組脊髓空洞形成的大小(HE染色,20×,bar=1.25 mm)
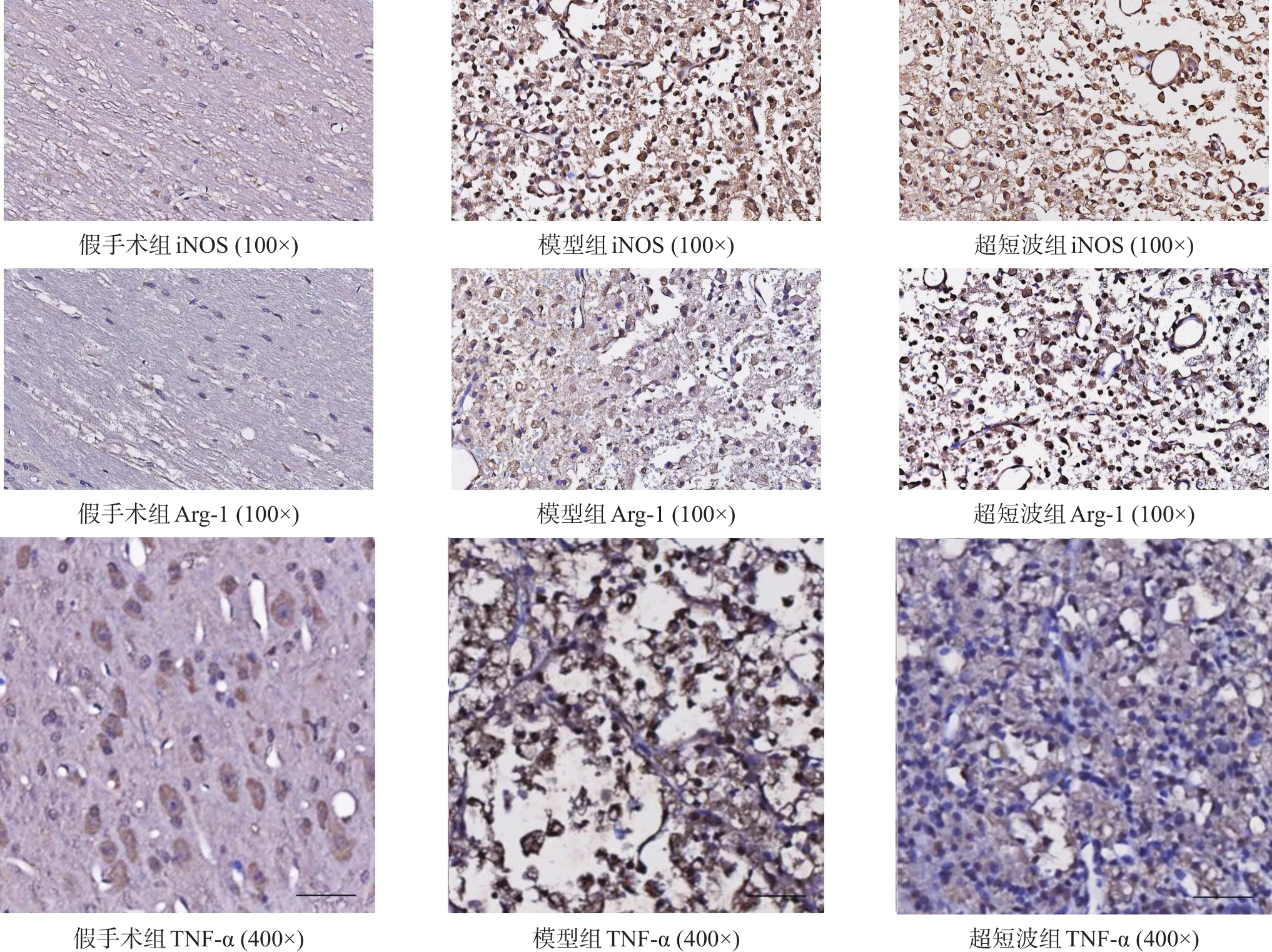
圖2 各組iNOS、Arg-1和TNF-α表達(免疫組化染色,bar=200μm)
2.4 實時PCR
與假手術組比較,模型組和超短波組iNOS、Arg-1和TNF-αmRNA表達均增加(P<0.05);與模型組比較,超短波組iNOS、TNF-αmRNA表達減少(P<0.05),而Arg-1 mRNA表達明顯增加(P<0.01)。見表3。
2.5 Western blotting
與假手術組比較,模型組和超短波組iNOS、Arg-1和TNF-α蛋白表達均增加(P≤0.05);與模型組比較,超短波組iNOS和TNF-α蛋白表達減少(P<0.05),而Arg-1蛋白表達增加(P<0.05)。見表4、圖3。
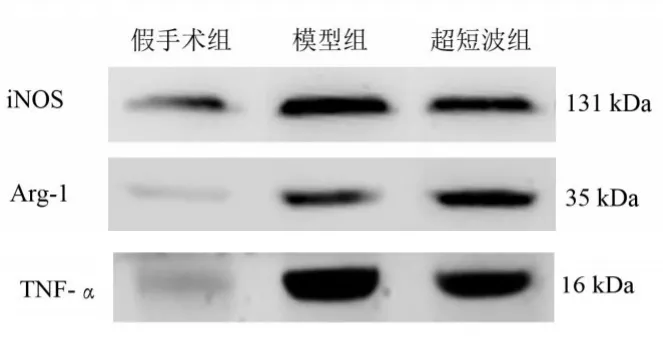
圖3 各組各蛋白表達(Western blotting)
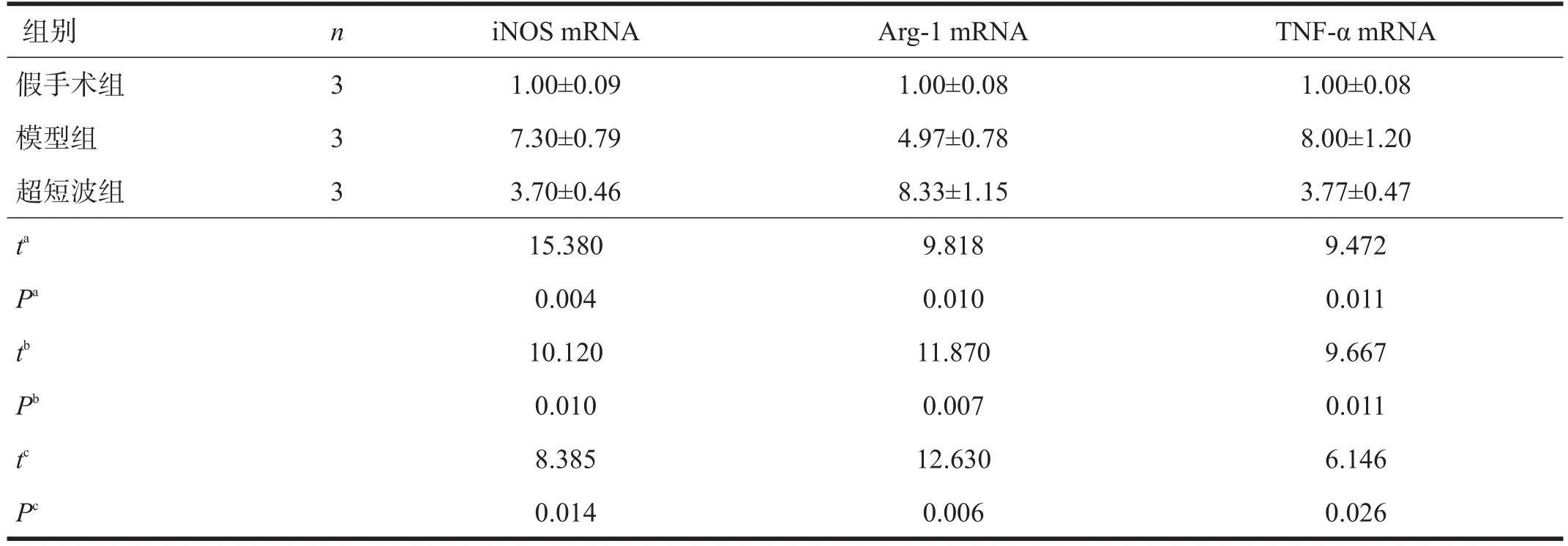
表3 各組實時PCR檢測結果
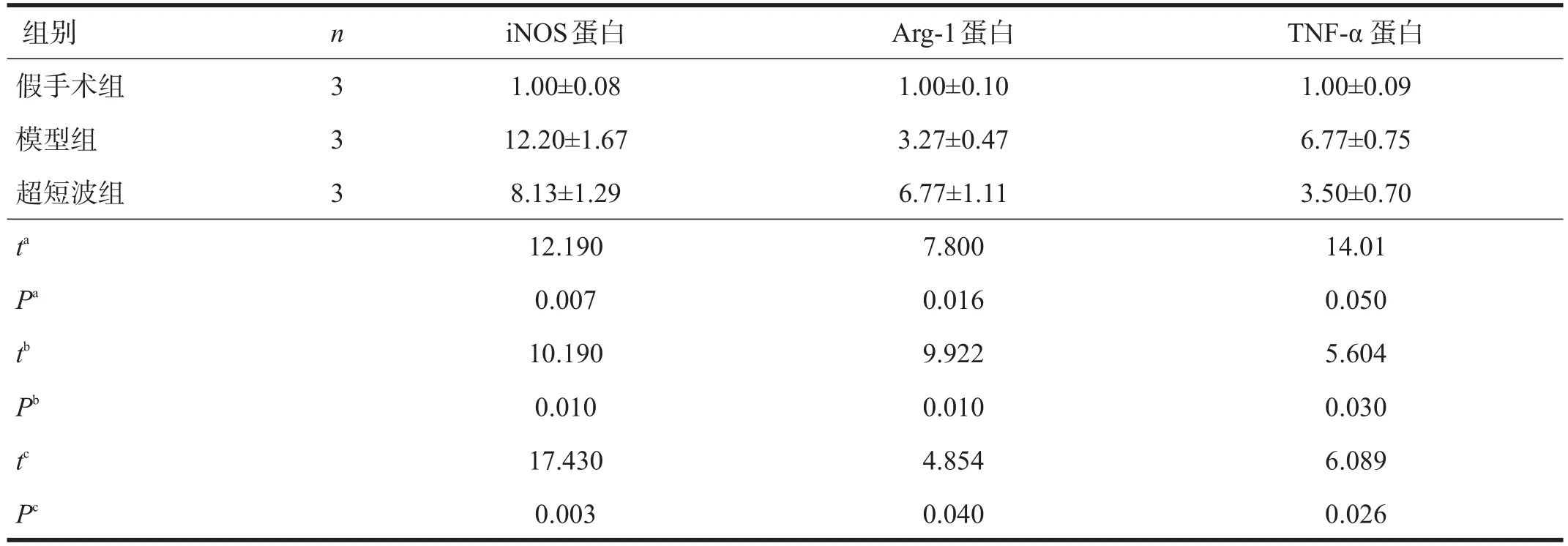
表4 各組Western blotting檢測結果
3 討論
繼發性脊髓損傷的病理過程包括血腫形成、脊髓缺血缺氧、脊髓水腫、離子紊亂和炎癥反應形成等[9]。作為一種保護性反應,由活化的巨噬細胞及小膠質細胞浸潤介導的炎癥反應在脊髓損傷后清除壞死及損傷組織中扮演重要的角色[10-11]。不同表型的巨噬細胞活化及表型轉化(巨噬細胞去極化)在包括脊髓損傷在內的多種原因導致的炎癥反應的不同階段發揮著不同的作用[5,12]。Zhao等[13]在一項大鼠的脊髓損傷模型研究中發現,電針刺激能夠降低M1型巨噬細胞比例,提高M2型巨噬細胞比例,并促進脊髓損傷后大鼠的ΒΒΒ評分。Li等[14]報道,納米粒負載的干擾素調控因子5(interferon regulatory factor 5,IRF5)沉默能夠促進巨噬細胞由M1型向M2型轉化,減少脫髓鞘及神經絲丟失,并促進脊髓損傷后大鼠的神經功能恢復。
超短波是一種廣泛應用于臨床的高頻電療法,其作用機制分為熱效應和非熱效應,低強度超短波治療的作用機制主要為非熱效應。文獻表明,超短波對脊髓損傷后修復發揮積極的促進作用。孫師等[15]研究報道,超短波可減輕脊髓損傷后脊髓水腫并促進神經功能恢復。既往研究發現[7],超短波聯合骨髓間充質干細胞移植可明顯改善大鼠脊髓損傷模型的神經功能恢復。本研究發現,相比于假手術組,模型組和超短波組的ΒΒΒ評分均降低;而相比于模型組,超短波治療可明顯提高脊髓損傷后大鼠的ΒΒΒ評分,再次驗證超短波對脊髓損傷的保護性作用。
本文的重點是觀察超短波對脊髓損傷后巨噬細胞表型轉化的影響。既往文獻表明,M1型巨噬細胞標志物包括CD16、CD32、CC類趨化因子配體2(C-Cmotif chemokine ligand 2,CCL2)、CD86、巨噬細胞受體與膠原結構蛋白(macrophage receptor with collagenous structure,MARCO)以及誘導型一氧化氮合酶(induced nitric oxide synthase,iNOS)等,而M2型巨噬細胞標志物包括CD206、CD209、胰島素樣生長因子1(insulin like growth factor 1,IGF-1)、白細胞介素1受體拮抗劑(interleukin 1 receptor antagonist,IL1RN)以及 Arg-1 等[5]。iNOS和Arg-1常常分別作為M1和M2型巨噬細胞的標志物,出現于脊髓損傷相關研究中[16-19]。本研究檢測了iNOS及Arg-1的表達情況,來觀察不同超短波干預對巨噬細胞表型轉化的影響,結果發現,相比于假手術組,模型組和超短波組的iNOS和Arg-1表達明顯增加,巨噬細胞激活;而經過超短波治療后,M1型巨噬細胞表型減少,而M2型巨噬細胞表型增加,也就是說超短波能夠促進脊髓損傷后巨噬細胞表型由M1型向M2型轉化。這種表型的變化在另一個層面證實了超短波對脊髓損傷的保護性作用。
TNF-α作為一種經典的炎癥標志物在多種炎癥反應中廣為表達[20-22]。Hao等[23]研究發現,去鐵胺能夠降低TNF-α等的表達水平,并抑制細胞凋亡及神經膠質瘢痕的形成,從而促進脊髓損傷后神經功能的恢復。Pei等[24]報道羥基紅花黃色素A(hydroxysafflor yellow A,HSYA)能夠顯著減少TNF-α等炎癥因子的表達,并顯著改善脊髓損傷后大鼠肢體功能的恢復。本研究觀察了超短波對TNF-α所代表的炎癥反應的影響,結果發現,超短波能夠明顯抑制脊髓損傷后TNF-α的表達水平,證明超短波能夠抑制脊髓損傷后炎癥反應的發生水平,并再次證實超短波對脊髓損傷的保護作用。
脊髓損傷后的神經功能修復仍舊是康復醫學及脊柱外科領域急需解決的世界性難題之一。本研究在動物學水平初步探討了超短波對脊髓損傷后巨噬細胞表型轉化及炎癥反應的影響。包括巨噬細胞去極化改變的多種分子機制均可影響脊髓損傷后炎癥反應的發生發展。本研究為超短波促進脊髓損傷后神經功能的修復提供了一定的理論和實驗基礎。巨噬細胞表型轉化及其所介導的炎癥反應是一個涉及多通路、多因子的調控體系,本研究僅初步觀察了超短波對M1/M2轉化的影響,其具體的調控機制仍需進一步深入研究。
[1]Majdan M,Plancikova D,Nemcovska E,et al.Mortality due to traumatic spinal cord injuries in Europe:a cross-sectional and pooled analysis of population-wide data from 22 countries[J].Scand JTrauma Resusc Emerg Med,2017,25(1):64.
[2]Ahuja CS,Wilson JR,Nori S,et al.Traumatic spinal cord injury[J].Nat Rev Dis Primers,2017,3:17018.
[3]Shultz RΒ,Zhong Y.Minocyclinetargetsmultiplesecondary injury mechanisms in traumatic spinal cord injury[J].Neural Regen Res,2017,12(5):702-713.
[4]Βermudez S,Khayrullina G,Zhao Y,et al.NADPH oxidaseisoform expression is temporally regulated and may contribute to microglial/macrophage polarization after spinal cord injury[J].Mol Cell Neurosci,2016,77:53-64.
[5]Kong X,Gao J.Macrophage polarization:a key event in the secondary phase of acute spinal cord injury[J].J Cell Mol Med,2017,21(5):941-954.
[6]Geng CK,Cao HH,Ying X,et al.The effects of hyperbaric oxygen on macrophage polarization after rat spinal cord inju-ry[J].Βrain Res,2015,1606:68-76.
[7]Yin YM,Lu Y,Zhang LX,et al.Βone marrow stromal cells transplantation combined with ultrashortwave therapy promotes functional recovery on spinal cord injury in rats[J].Synapse,2015,69(3):139-147.
[8]Βasso DM,Βeattie MS,Βresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].JNeurotrauma,1995,12(1):1-21.
[9]Anderson AJ.Mechanisms and pathways of inflammatory responses in CNS trauma:spinal cord injury[J].J Spinal Cord Med,2002,25(2):70-79.
[10]Anwar MA,Al Shehabi TS,Eid AH.Inflammogenesis of secondary spinal cord injury[J].Front Cell Neurosci,2016,10:98.
[11]Gensel JC,ZhangΒ.Macrophage activation and its role in repair and pathology after spinal cord injury[J].Βrain Res,2015,1619:1-11.
[12]Peng Z,Gao W,YueΒ,et al.Promotion of neurological recovery in rat spinal cord injury by mesenchymal stem cells loaded on nerve-guided collagen scaffold through increasing alternatively activated macrophage polarization[J].JTissue Eng Regen Med,2018,12(3):e1725-e1736.
[13]Zhao J,Wang L,Li Y.Electroacupuncture alleviates the inflammatory response via effects on M1 and M2 macrophages after spinal cord injury[J].Acupunct Med,2017,35(3):224-230.
[14]Li J,Liu Y,Xu H,et al.Nanoparticle-delivered IRF5 siRNA facilitates M1 to M2 transition,reduces demyelination and neurofilament loss,and promotes functional recovery after spinal cord injury in mice[J].Inflammation,2016,39(5):1704-1717.
[15]孫師,萬峪岑,趙利娜,等.骨髓間充質干細胞聯合超短波對大鼠脊髓損傷后早期AQP-4和GAP-43的影響[J].中國康復醫學雜志,2016,31(6):625-631.
[16]Ghosh M,Xu Y,Pearse DD.Cyclic AMPis a key regulator of M1 to M2a phenotypic conversion of microglia in the presence of Th2 cytokines[J].JNeuroinflammation,2016,13:9.
[17]Li F,ChengΒ,Cheng J,et al.CCR5 blockade promotes M2 macrophage activation and improves locomotor recovery after spinal cord injury in mice[J].Inflammation,2015,38(1):126-133.
[18]Liang F,Liu M,Fu X,et al.Dexmedetomidine attenuates neuropathic pain in chronic constriction injury by suppressing NR2Β,NF-κΒ,and iNOSactivation[J].Saudi Pharm J,2017,25(4):649-654.
[19]Wang S,Ren D.Allicin protects traumatic spinal cord injury through regulating the HSP70/Akt/iNOS pathway in mice[J].Mol Med Rep,2016,14(4):3086-3092.
[20]Akgün Β,Ozturk S,Artas G,et al.Effects of intrathecal caffeic acid phenethyl ester(CAPE)on IL-6 and TNF-αlevels and local inflammatory responses in spinal cord injuries[J].Turk Neurosurg,2017.[Epub ahead of print].doi:10.5137/1019-5149.JTN.20011-17.1.
[21]Βeattie MS.Inflammation and apoptosis:linked therapeutic targets in spinal cord injury[J].Trends Mol Med,2004,10(12):580-583.
[22]Peng RJ,JiangΒ,Ding XP,et al.Effect of TNF-α inhibition on bone marrow-derived mesenchymal stem cells in neurological function recovery after spinal cord injury via the Wnt signaling pathway in a rat model[J].Cell PhysiolΒiochem,2017,42(2):743-752.
[23]Hao J,LiΒ,Duan HQ,et al.Mechanisms underlying the promotion of functional recovery by deferoxamine after spinal cord injury in rats[J].Neural Regen Res,2017,12(6):959-968.
[24]Pei JP,Fan LH,Nan K,et al.HSYA alleviates secondary neuronal death through attenuating oxidative stress,inflammatory response,and neural apoptosis in SD rat spinal cord compression injury[J].JNeuroinflammation,2017,14(1):97.

