大鼠脊髓損傷后胃腸動力的X線研究
蔡暢,李建軍,高峰,楊明亮,杜良杰,楊德剛,劉長彬,李大鵬,張文豪,徐珮珮
1.首都醫科大學康復醫學院,北京市100068;2.中國康復研究中心北京博愛醫院,脊柱脊髓神經功能重建科,北京市100068;3.北京腦重大疾病研究院神經損傷與修復研究所,北京市100068;4.北京市神經損傷與康復重點實驗室,北京市100068
脊髓損傷可造成嚴重的軀體感覺、運動功能障礙,還可引起泌尿系統、消化系統等內臟功能紊亂,導致嚴重并發癥[1-2]。超過30%的脊髓損傷患者認為神經源性腸功能障礙(neurogenic bowel dysfunction,NΒD)比膀胱功能障礙和性功能障礙更嚴重[3]。NΒD主要癥狀包括大便失禁、便秘和排便障礙[4],對患者的社會活動和生活質量產生極其嚴重的影響[5]。然而目前關于NΒD的研究報道較少,且沒有關于脊髓損傷后腸道功能動態變化的相關研究。
本研究嘗試建立大鼠脊髓損傷模型,并參考Cabezos等[6-8]使用的X線造影方法,在清醒的大鼠中觀察脊髓損傷前后胃腸道傳輸功能的動態變化,探索NΒD腸道功能變化的新方法并初步探討NΒD的發生、發展規律,為進一步豐富和完善NΒD發生發展過程及制定有效的治療方法提供必要的方法學依據和實驗基礎。
1 材料與方法
1.1 實驗動物
24只SPF級健康雌性Sprague-Dawley大鼠,由北京維通利華公司提供,許可證號SCXK(京)2009-0017,體質量(220±10)g。在標準透明籠(60×40×20 cm)中單籠飼養,室內溫度23℃左右,濕度35%~45%,置于12 h光照/12 h黑暗循環的環境中。所有大鼠均定時定量進食,自由飲水,各種試驗干預措施均符合首都醫科大學動物倫理協會的要求,倫理審查號AEEI-2015-079。
1.2 主要試劑與儀器
青霉素:華北制藥股份有限公司。硫酸鋇:青島紅蝶新材料有限公司。數字X線設備:西門子公司。Image-lab圖像分析系統:美國伯樂公司。
1.3 分組和造模
將大鼠分為對照組(n=12)和脊髓損傷組(n=12),飼養2周后開始制作脊髓損傷模型。
術前禁食不禁水12 h。大鼠異氟烷氣體吸入麻醉,誘導麻醉濃度3%~4%,維持麻醉濃度1%~2%,流量0.2~0.3 L/min。大鼠全身肌肉松弛,鉗夾肢體無回縮時麻醉成功。大鼠背部備皮,俯臥位將四肢固定于手術操作臺,以突出的第10胸椎作為骨性標志定位至T10節段脊髓(對應T8),行后正中切口,長約2 cm,分離椎旁肌肉后暴露T7~T9棘突,剪斷兩側的韌帶,小心咬除T8棘突及椎板,暴露硬膜囊并保證其完整,垂直于脊髓縱軸緩慢置入動脈瘤夾(標定力為70 g),待動脈瘤夾橫跨脊髓后松開止血鉗并釋放動脈瘤夾,鉗夾脊髓持續60 s后取出動脈瘤夾[9],被鉗夾處脊髓表面充血、水腫或出血,大鼠尾巴立即痙攣性擺動,雙下肢強直陣攣,麻醉蘇醒后大鼠雙下肢弛緩性癱瘓,證明所制作的脊髓損傷模型成功,間斷分層縫合。
對照組僅暴露硬脊膜后關閉傷口。
術后每天予青霉素40萬U皮下注射,連續3 d。每12小時進行一次膀胱按壓,輔助排尿,擠壓直腸輔助排出大便,同時按摩和被動活動雙下肢防止壓瘡和血栓形成。
1.4 檢測方法
1.4.1 腸道傳輸功能測定
造模前和造模后4周,每只大鼠予硫酸鋇懸浮液(2 g/ml,22℃)2.5 ml灌胃。將大鼠放置在可調整的自制透明塑料管內并將其固定于俯臥位,此塑料管大小適中,可使其不能移動、轉身或逃脫。在造影劑給藥后即刻、1 h、2 h、4 h、6 h、8 h和24 h,使用數字X線設備(60 kV,7 mA)獲得腸道的平面X光片并用Image-lab圖像分析系統進行圖像分析,曝光時間0.06 s。
在實驗開始之前訓練大鼠適應X光室,使其不會因為環境改變而出現明顯的胃腸動力改變。為了減輕密閉環境所造成壓力,每次X線造影后立即釋放大鼠(固定持續2~3 min)。
根據圖像定量評分方法分析胃腸運動功能。見表1。每個器官(胃、小腸、盲腸和結直腸)最高分12分,每一分項最高4分。

表1 胃腸功能評分[6]
1.4.2結腸HE染色
造模后4周,將大鼠麻醉(方法同前)后,仰臥固定,剪開胸骨,暴露縱膈,經左心室插穿刺針至升主動脈后,剪開右心耳,0.9%NaCl液250 ml經穿刺針快速滴注5 min,待右心耳流出液清亮;40 g/L多聚甲醛經穿刺針灌注固定30 min。大鼠肢體僵硬后,停止灌注,將腹部切開,距盲腸2~3 cm處迅速切取結腸,沿縱軸切開,生理鹽水洗滌腸內容物。放入10%福爾馬林中固定,石蠟包埋,連續切片,片厚4μm,常規HE染色。光學顯微鏡觀察。
1.5 統計學分析
采用SPSS 22.0統計軟件進行統計分析。計量資料采用(xˉ±s)描述。采用獨立樣本t檢驗比較兩組腸道鋇餐評分的差異性。顯著性水平α=0.05。
2 結果
2.1 一般情況
所有實驗大鼠均未出現死亡。術后約10 d傷口愈合。對照組精神狀態佳,自主活動良好,飲食和大小便正常。脊髓損傷組雙下肢癱瘓,活動量明顯減少;除尿潴留外,大便排出困難,干結糞便嵌頓在直腸內,需擠壓直腸輔助排便。
2.2 脊髓損傷前胃腸運動功能變化
脊髓損傷前,胃在灌入造影劑后立即開始排空,灌胃4 h后已經基本完全排空。小腸0 h開始顯影,在灌入造影劑后1 h時顯影更充分。結腸在灌入造影劑后1~2 h開始顯影,并且在4 h左右完全顯影。在某些情況下,在灌胃4 h時可見糞便顆粒,6 h時糞便顯影更為明顯。在24 h時,胃、小腸以及結腸顯影均不再明顯。見圖1。對大鼠造模前所得X線圖像進行定量評分,所得結果見圖2。
2.3 脊髓損傷后4周胃腸道運動功能變化
大鼠脊髓損傷后4周的X線圖像見圖3。各器官在不同時間點均有不同程度的排空減慢。
2.3.1 胃
與對照組相比,脊髓損傷組胃排空速度減慢(P<0.05)。鋇餐灌胃后4 h,脊髓損傷組胃排空明顯延遲,且胃排空時間從6 h延遲至8~24 h。見圖4。
2.3.2 小腸
兩組均在灌胃鋇餐后1 h觀察到小腸中的最大顯影強度。鋇餐灌胃后6 h,脊髓損傷組小腸排空速度顯著減慢(P<0.001)。且小腸排空時間從8 h延遲至8~24 h完全排空。見圖5。
2.3.3 盲腸
兩組均在灌胃后1 h開始顯影,2 h達到最大評分。脊髓損傷組盲腸排空速度小于對照組,對照組大鼠在24 h基本完成盲腸排空,而脊髓損傷組在灌胃后24 h還能未完全排空(P<0.001)。見圖6。
2.3.4 結直腸
兩組均在灌胃后2 h開始顯影,4 h達到最大評分。脊髓損傷組結直腸的排空速度小于對照組,對照組大鼠在24 h基本完成結直腸排空,而脊髓損傷組在灌胃后24 h還能未完全排空(P<0.001)。見圖7。
2.4 結腸HE染色
脊髓損傷組腸壁萎縮,黏膜糜爛、水腫。炎性細胞大量浸潤,腺體減少,肌層較薄以及輕度間質水腫。腸絨毛破壞,上皮細胞壞死,大量滲出,腸絨毛高度下降,數量減少。見圖8。
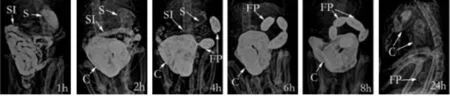
圖1 大鼠造模前胃腸運動功能的X線圖像
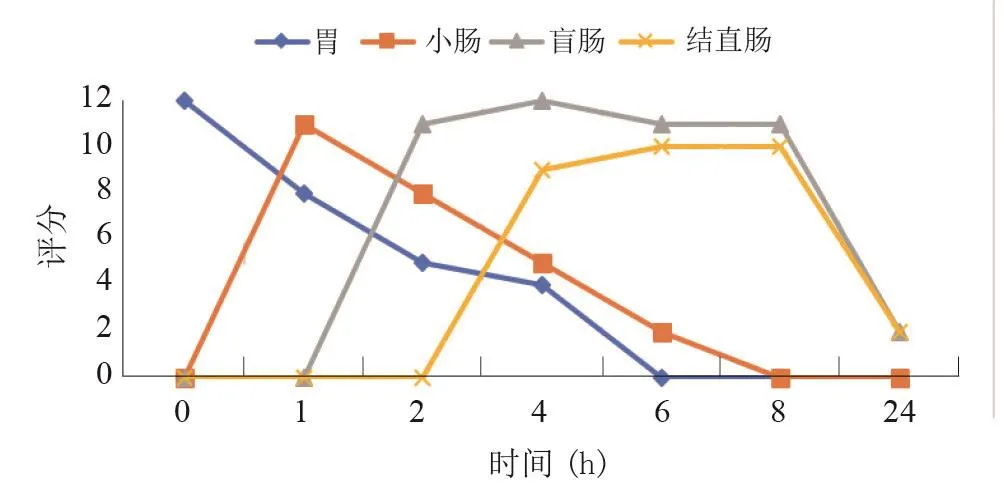
圖2 大鼠造模前各器官定量評分曲線
3 討論
本研究使用非侵入性的X線造影法評估脊髓損傷后胃腸道傳輸功能動態變化,發現胃、小腸、盲腸、結直腸分別在不同時間點發生傳輸延遲,表明脊髓損傷后胃排空和腸道傳輸功能減弱,傳輸時間延長。
脊髓損傷后腸道失去神經支配,腸道蠕動頻率降低,幅度下降,傳輸時間延長,直腸肛門協調性紊亂,表現為排便困難、大便失禁等癥狀,是影響患者日常生活質量和身心健康的重要因素[10-11]。
1985年Meshkinpour等[12]研究大鼠脊髓橫斷之后靜息結腸運動活動的變化,結果表明,結腸運動受到脊髓休克的影響,并可能導致結腸運動減弱。2001年Gondim等[13]通過管飼法在清醒大鼠中研究脊髓橫斷損傷后胃排空、腸道轉運,結果表明,脊髓橫斷損傷抑制胃排空和腸道轉運。2015年韓蕓峰等[14]通過炭末灌胃研究脊髓損傷后NΒD,發現脊髓損傷后大鼠腸道推進率降低。本實驗研究結果與之前的相關研究結果相一致,說明通過X線方法定量評估腸道傳輸功能的動態變化具有可信度及可行性。
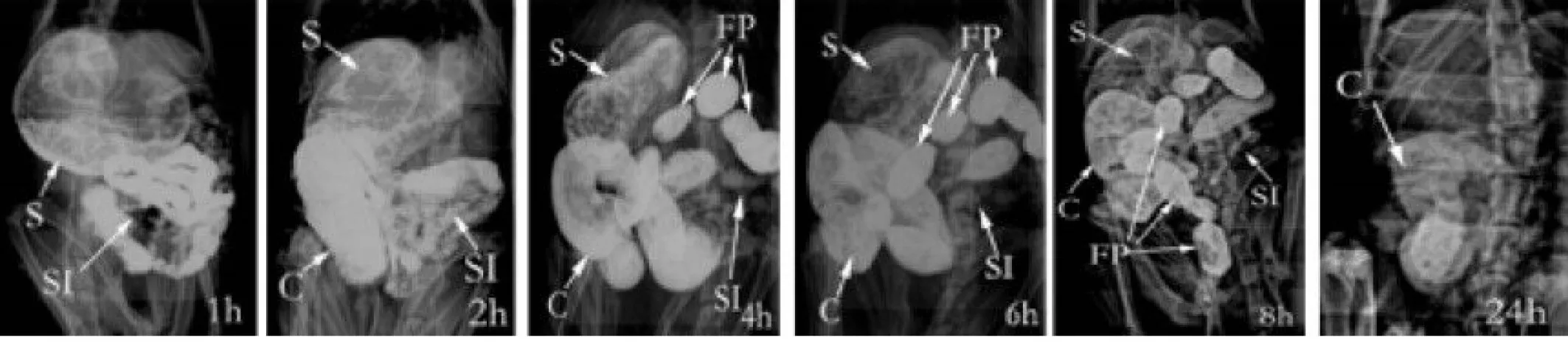
圖3 大鼠脊髓損傷后4周胃腸運動功能的X線圖像

圖4 大鼠脊髓損傷后4周胃定量評分曲線
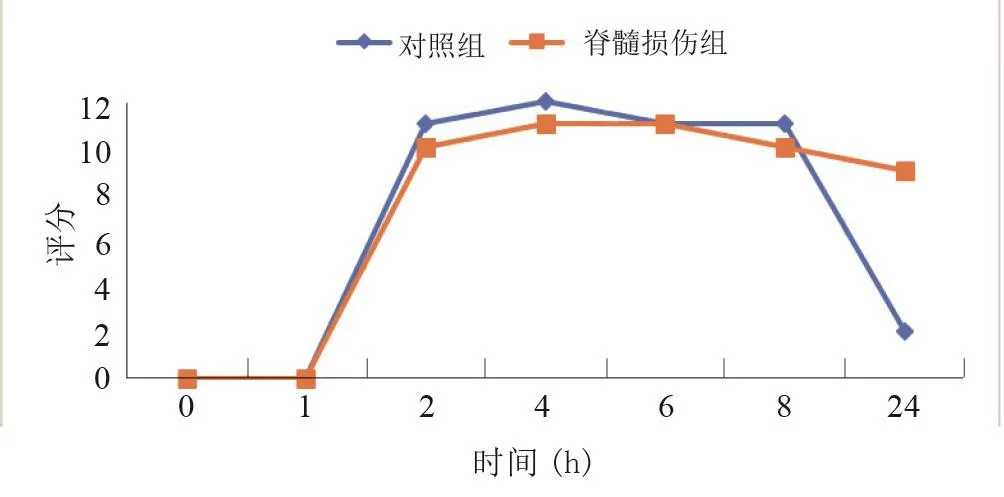
圖6 大鼠脊髓損傷后4周盲腸定量評分曲線
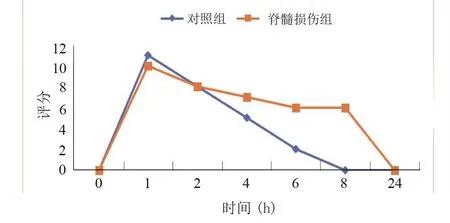
圖5 大鼠脊髓損傷后4周小腸定量評分曲線
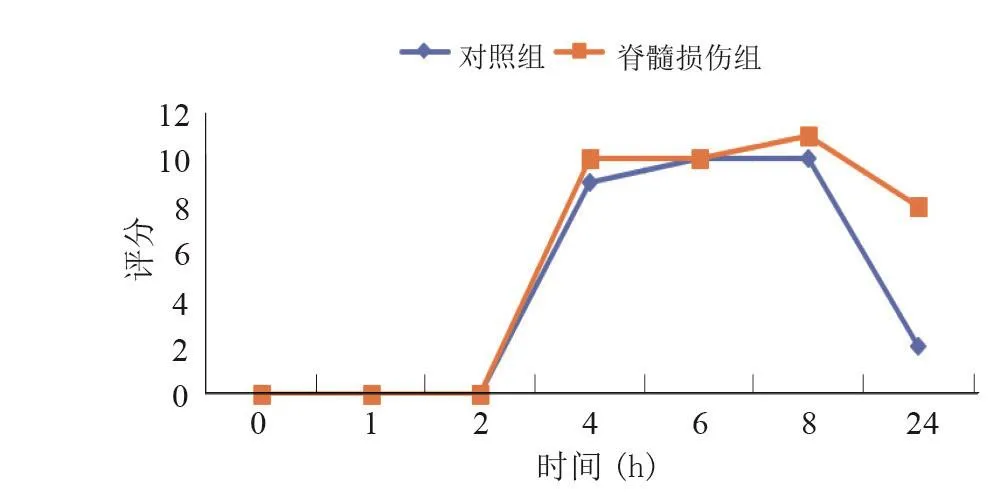
圖7 大鼠脊髓損傷后4周結直腸定量分析評分曲線

圖8 結腸HE染色
在脊髓損傷后的腸道功能研究中,腸道推進試驗、糞便粒數、糞便含水率測定、放射影像、核素顯像、酸堿指示劑是研究腸道運動功能的常用方法[15-17]。與這些方法相比,本研究不需要使用麻醉劑,將清醒的大鼠固定于塑料管中2~3 min進行X線拍照,可避免麻醉劑對胃腸蠕動的干擾。實驗前對大鼠進行適應訓練,訓練后大鼠可自行進入塑料管中,可避免密閉環境對腸道傳輸功能的干擾。總之,本研究采用的X線造影方法不需要麻醉,方法簡便易行,具有非侵入性,且能夠定量地反映腸道功能的動態變化,對脊髓損傷后NΒD的功能變化評估更加精確。除此之外,本方法可以評估脊髓損傷后胃腸道不同器官的動態變化情況,也可以為相關治療方法的研究提供方法學依據。
然而,本實驗的研究周期較短,未對NΒD的腸道傳輸功能的動態變化進行長期觀察;且沒有對胃腸道所有器官進行病理組織檢測。未來應將胃腸道的功能變化與病理學結果相結合,進一步探討NΒD的發生發展過程。
綜上所述,放射攝影技術不具有侵入性,并能提供胃腸道不同區域大小和形狀改變的信息。為NΒD研究提供了新的工具。
[1]徐青,高飛,王磊,等.脊髓損傷后腸道功能障礙:美國臨床實踐指南解讀[J].中國康復理論與實踐,2010,16(1):83-86.
[2]HocevarΒ,Gray M.Intestinal diversion(colostomy or ileostomy)in patients with severe bowel dysfunction following spinal cord injury[J].J Wound Ostomy Continence Nurs,2008,35(2):159-166.
[3]Liu CW,Huang CC,Chen CH,et al.Prediction of severe neuro-genic bowel dysfunction in persons with spinal cord injury[J].Spinal Cord,2010,48(7):554-559.
[4]Pan Y,LiuΒ,Li R,et al.Βowel dysfunction in spinal cord injury:current perspectives[J].CellΒiochemΒiophys,2014,69(3):385-388.
[5]張潔,楊德剛,李建軍,等.國際脊髓損傷腸道功能基礎數據集最新修訂及解讀[J].中國康復理論與實踐,2017,23(10):1236-1240.
[6]Cabezos PA,Vera G,Castillo M,et al.Radiological study of gastrointestinal motor activity after acute cisplatin in the rat.Temporal relationship with pica[J].Auton Neurosci,2008,141(1-2):54-65.
[7]Vera G,Lópezpérez AE,Martínezvillaluenga M,et al.X-ray analysis of the effect of the 5-HT3 receptor antagonist granisetron on gastrointestinal motility in rats repeatedly treated with the antitumoral drug cisplatin[J].ExpΒrain Res,2014,232(8):2601-2612.
[8]Cabezos PA,Vera G,Martín-Fontelles MI,et al.Cisplatin-induced gastrointestinal dysmotility is aggravated after chronic administration in the rat.Comparison with pica[J].Neurogastroenterol Motil,2010,22(7):797-805.
[9]劉小康,徐建廣,連小峰,等.大鼠鉗夾式急性脊髓損傷模型的制備與評價[J].中國矯形外科雜志,2012,20(14):1318-1322.
[10]Preziosi G,Raptis DA,Raeburn A,et al.Autonomic rectal dysfunction in patients with multiple sclerosis and bowel symptoms is secondary to spinal cord disease[J].Dis Colon Rectum,2014,57(4):514-521.
[11]逯曉蕾,李建軍,杜良杰,等.脊髓損傷后腸道功能的變化[J].中國康復理論與實踐,2010,16(8):758-760.
[12]Meshkinpour H,Harmon D,Thompson R,et al.Effects of thoracic spinal cord transection on colonic motor activity in rats[J].Paraplegia,1985,23(5):272-276.
[13]Gondim FA,Rodrigues CL,da Graca JR,et al.Neural mechanismsinvolved in the delay of gastric emptying and gastrointestinal transit of liquid after thoracic spinal cord transection in awake rats[J].Auton Neurosci,2001,87(1):52-58.
[14]韓蕓峰,王振宇,于濤.大鼠脊髓損傷模型建立及神經源性腸功能障礙的初步評價[J].中國臨床神經外科雜志,2015,20(10):617-620.
[15]朱黎婷,朱毅.脊髓損傷神經源性腸道功能障礙的診斷、評價和康復治療現況[J].中國康復醫學雜志,2013,28(12):1163-1167.
[16]Media S,Christensen P,Lauge I,et al.Reproducibility and validity of radiographically determined gastrointestinal and segmental colonic transit times in spinal cord-injured patients[J].Spinal Cord,2009,47(1):72-75.
[17]Liu GX,Yang YX,Yan J,et al.Glial-derived neurotrophic factor reduces inflammation and improves delayed colonic transit in rat models of dextran sulfate sodium-induced colitis[J].Int Immunopharmacol,2014,19(1):145-152.

