重型血友病A患兒關節出血后IL-1β、IL-6、TNF-α釋放與關節病變形成的相關性研究
劉國青 陳振萍 唐 凌 吳心怡 甄英姿 李 剛 王 巖 張寧寧 張紀水 于國霞 吳潤暉
(首都醫科大學附屬北京兒童醫院血液腫瘤中心 兒童血液病與腫瘤分子分型北京市重點實驗室 兒科學國家重點學科 教育部兒童重大疾病重點實驗室, 北京 100045)
血友病A是一種由凝血因子Ⅷ缺乏所致X染色體連鎖的先天性出血性疾病,發病率為每5 000例活產男嬰中發病1例。盡管血友病的相關治療取得了很大的進展,關節病變作為血友病關節出血后的第一合并癥,其發生發展仍未得到有效預防和治療,關節炎甚至關節殘疾的出現影響著許多患者(尤其是患兒)的身心健康[1-2]。世界血友病聯盟(World Federation of Hemophilia, WFH)將預防治療推薦為重型血友病的標準治療方法。預防治療的優勢及有效性已得到公認,但是研究[3]也顯示,雖然預防治療可以降低出血事件的發生概率,一旦血友病性關節病形成,就不可再逆轉,此時預防治療只能延緩關節病的進展。
臨床觀察[4]顯示,相同出血情況下,關節病的形成與否、嚴重程度存在個體差異,提示除關節出血因素外,存在其他影響因素參與血友病關節病的形成。血友病關節出血后血液對關節軟骨具有直接侵蝕作用:血液充滿關節腔后激活單核/巨噬系統釋放白細胞介素-1β(interleukin-1β, IL-1β)、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、基質金屬蛋白酶類等細胞因子,導致血管內皮生長因子(vascular endothelial growth factor, VEGF)分泌增加,誘發滑膜肥大和新生血管生長,形成滑膜炎性反應;出血后滑膜內的鐵沉積導致關節軟骨細胞損傷和死亡,最終造成整個關節的退行性變和功能障礙[3,5-6]。而風濕性關節炎也有類似的過程,因此人們普遍認為,血友病關節出血后的關節病發病機制及過程類似于類風濕性關節炎退行性變軟骨的破壞過程[1]。
在其他炎性關節病變,尤其是風濕免疫病領域中,已經發現關節炎與炎性反應因子的關系,尤其是IL-1β、IL-6、TNF-α,并且抗細胞因子的藥物如抗IL-1β、IL-6、TNF-α的靶向藥物已經成功的應用于預防風濕性關節炎的慢性關節病變。近幾年,人們通過體外細胞和小鼠模型的研究,可以得知IL-1β、IL-6、TNF-α等炎性反應因子在血友病關節病變的形成過程中起著重要作用[7],但究竟炎性反應因子在關節出血后關節病變形成過程中如何作用至今仍不清楚,故本研究主要探討血友病患兒不同關節出血期炎性反應因子的表達情況,通過觀察不同關節出血時期IL-1β、IL-6、TNF-α的血清蛋白濃度,以及外周單個核細胞中mRNA表達的情況,從血清水平和基因表達水平得到一個變化規律,尋找患兒關節病變形成過程中的主要因素,為更好地了解關節出血后關節病變形成的機制,為之后關節病變的用藥和治療提供可靠的理論依據。
1 資料與方法
1.1 研究對象
收集2015年10月至2016年4月在首都醫科大學附屬北京兒童醫院血友病門診常規篩查抑制物處于不同關節出血分期的47例血友病患兒作為研究組。所有入組患者均簽署知情同意書。
納入標準:(1)年齡2~18歲;(2)重型血友病患兒;(3)沒有抑制物產生病史;(4)沒有危重部位出血;(5)常規篩查抑制物后留取足夠殘留血標本進行檢測。
排除標準:(1)年齡<2歲或>18歲;(2)抑制物陽性;(3)伴有類風濕關節病、骨關節炎、混合性結締組織病、銀屑病等自身免疫系統疾病;(4)各種感染病的急性期;(5)近期服用過抗炎鎮痛藥物;(6)病程中曾服用過免疫制劑。
1.2 相關診斷標準及定義[6]
(1)關節出血:關節的異常感覺并滿足以下任意一條:①關節表面皮膚進行性腫脹或皮膚溫度進行性升高;②疼痛加劇;③與原來相比,關節活動范圍進行性縮小或肢體活動困難加劇。在嬰兒和小幼兒如果出現唯獨不愿活動的肢體,可能提示關節或肌肉出血。(2)重型血友病A:患兒血漿因子FⅧ活性水平<1%。(3)關節病變:血友病性關節病是由于關節反復出血而引起的關節滑膜、軟骨及軟骨下骨的一系列病理改變。
1.3 實驗分組
分為以下3組:(1)無關節出血(non-joint bleeding, NJB) 組:3個月內無關節出血;(2)急性關節出血 (acute joint bleeding, AJB)組:1個月內有關節出血;(3)慢性關節出血(chronic joint bleeding, CJB) 組:3個月內有關節出血,1個月內無關節出血。
1.4 實驗方法
1)臨床資料收集:收集患兒年齡及關節出血時間。
2)標本收集:紫帽管(EDTA抗凝)收集患兒靜脈血標本,保證在采集后2 h內處理標本。
3)實驗檢測: ①應用ELISA法測定血清中IL-1β、IL-6、TNF-α細胞因子的濃度。收取外周血標本,用離心機3 000 r/min離心25 min,收集血清,放入-70°低溫冰箱保存備用。用ELISA法測定血清中IL-1β、IL-6、TNF-α細胞因子的濃度。 ②外周單個核細胞進行RNA提取、反轉錄及用RT-PCR測定IL-1β、IL-6、TNF-α的mRNA表達量。收取外周血標本,裂解紅細胞,洗滌單個核細胞,Trizol法提取分選細胞總RNA,進行RNA純度與濃度的測定,加RNA 2 μg,Random Primers 1 μL, 補Rnase Free Water至12.5 μL,70 ℃ 5 min;反轉錄第二步上機(PCR儀):每12.5 μL產物中加M-MLV 5×Buffer 5 μL,dNTPs(2.5 mmol/L)5 μL,RnaseSin 0.5 μL,M-MLV 1 μL。37 ℃ 60 min。cDNA終濃度為80 ng/μL。將1 μg細胞總RNA反轉錄合成cDNA第一條鏈,隨后進行PCR擴增。根據NCBI基因庫描述的IL-1β、IL-6、TNF-α基因序列,設計IL-1β、IL-6、TNF-α、β-actin引物序列如表1,每次實驗用無酶水代替cDNA,作為PCR陰性對照。擴增體系:cDNA 1 μL、PCR Master MIX 5 μL、滅菌注射用水3 μL,上游引物(2.5 μmol/L) 0.5 μL、下游引物(2.5 μmol/L) 0.5 μL,IL-1β、IL-6、TNF-α和β-actin用染料法進行熒光相對定量PCR,ABI ViiA7實時熒光定量PCR儀上機,程序為:95 ℃ 15 min,95 ℃ 15 s,62 ℃ 30 s,72 ℃ 30 s(35個循環),收集數據。③用到的公式:目的基因mRNA=2-△△Ct[△△Ct=(待測樣本目的基因平均Ct-待測樣本內參基因平均Ct)—(對照樣本目的基因平均Ct-對照樣本內參基因平均Ct)]。

表1 RT-PCR的引物序列Tab.1 Primer sequences
TNF-α:tumor necrosis factor-α;IL-6:interleukin-6;IL-1β:interleukin-1β.
1.6 統計學方法
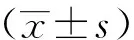
2 結果
2.1 一般資料
入組患兒47例,其中AJB組17例(伴關節病變8例,不伴關節病變9例),CJB組13例,NJB組17例。患兒中位年齡5.5(2~18)歲。
2.2 關節出血后炎性反應因子變化情況
1)關節出血組與無關節出血組相比,IL-1β、IL-6及TNF-α血清濃度差異無統計學意義(P>0.05),而細胞內mRNA的表達水平均升高,其中以TNF-α升高為主且差異有統計學意義(P=0.002);即血友病患兒關節出血后IL-1β、IL-6及TNF-α表達水平均升高,其中以TNF-α升高為主;2)急性出血期與無關節出血組比較,IL-1β、IL-6及TNF-α血清濃度差異無統計學意義(P>0.05),而細胞內IL-1β、IL-6及TNF-α的mRNA的表達水平均值升高,其中以TNF-α升高為主且差異有統計學意義(P=0.009);3)慢性出血組與無關節出血組比較,僅細胞內TNF-α的mRNA的表達水平升高且差異有統計學意義(P=0.031);4)急性出血期與慢性出血期的L-1β、IL-6及TNF-α血清表達濃度及細胞內mRNA的水平差異無統計學意義(P>0.05),見表2~4。
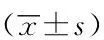

GroupBlood serumNumber of caseValue/(pg·mL-1)Expression of mRNANumber of caseValueNJB1610.528±5.078160.376±0.364JB2813.115±9.912270.764±1.146AJB1613.566±9.119160.980±1.425CJB1212.514±11.273110.450±0.432 IL-1β:interleukin-1β;NJB: non-joint bleeding;JB:joint bleeding; AJB:acute joint bleeding; CJB:chronic joint bleeding.
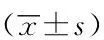

GroupBlood serumNumber of caseValue/(pg·mL-1)Expression of mRNANumber of caseValueNJB150.615±1.416150.224±0.380JB280.891±1.940260.372±0.781AJB160.963±2.055160.419±0.962CJB120.797±1.861100.298±0.380 IL-6:interleukin-6;NJB: non-joint bleeding;JB:joint bleeding; AJB:acute joint bleeding; CJB:chronic joint bleeding.
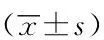

GroupBlood serumNumber of caseValue/(pg·mL-1)Expression of mRNANumber of caseValueNJB1613.346±3.296171.066±0.815JB2816.012±8.863*302.866±2.750*AJB1616.207±10.775*173.517±3.328*CJB1215.753±5.862132.014±1.456* *P<0.05 vs NJB group;TNF-α:tumor necrosis factor-α;NJB: non-joint bleeding;JB:joint bleeding; AJB:acute joint bleed-ing; CJB:chronic joint bleeding.
2.3 關節病變的患兒炎性反應因子表達水平
血清水平:AJB組伴關節病變與AJB組不伴關節病變的IL-1β的血清表達水平(12.976±6.100vs14.024±11.287),IL-6的血清表達水平(0.162±0.487vs1.991±2.836)及TNF-α的血清表達水平(20.250±15.770vs13.062±2.390)差異均無統計學意義(P值分別為0.828、0.140、0.276)(圖1)。
細胞內mRNA的水平:AJB組伴關節病變與AJB組不伴關節病變的IL-1β的mRNA表達水平(1.542±1.879vs0.4718±0.317),IL-6的mRNA表達水平(0.125±0.612vs0.647±1.263)差異均無統計學意義(P值分別為0.137和0.250);TNF-α的mRNA表達水平(5.584±3.634vs1.680±1.590)差異有統計學意義(P=0.02)(圖2)。

圖1 AJB組伴與不伴關節病變患兒的IL-1β、IL-6、TNF-α的血清蛋白表達水平Fig.1 The levels of IL-1β, IL-6 and TNF-α inblood serum between AJB group with arthropathy and AJB group without arthropathy
AJB:acute joint bleeding;IL-1β:interleukin-1β;IL-6:interleukin-6;TNF-α:tumor necrosis factor-α.

圖2 AJB組伴與不伴關節病變患兒的IL-1β、IL-6、TNF-α的mRNA表達水平Fig.2 The levels of IL-1β, IL-6 and TNF-α mRNAbetween AJB group with arthropathy and AJB groupwithout arthropathy
AJB:acute joint bleeding;IL-1β:interleukin-1β;IL-6:interleukin-6;TNF-α:tumor necrosis factor-α;There was significant difference in the expression of mRNA of TNF-α between AJB group with arthropathy (P=0.02).
3 討論
血友病是一種X染色體連鎖的先天性出血性疾病。該病由于凝血因子Ⅷ/Ⅸ缺乏,導致患兒異常出血,其中以關節出血為主,嚴重的出血可致死,凝血因子替代治療后,該疾病由致死性疾病變為致殘性疾病[8]。重度血友病患者中82%的出血事件發生在關節,膝關節、踝關節及肘關節占了所有關節出血的80%,反復出血最終將形成血友病關節病變,引起疼痛和導致永久性功能障礙[9-10]。
炎性細胞因子被認為參與人類炎性關節炎的形成。TNF-α是有效的前炎性反應因子蛋白,Ji等[11]提出TNF-α在關節炎性病變中起著重要的作用。國外研究[1]已證實TNF-α在小鼠模型的類風濕關節病的形成中起到重要作用,如K/BxN模型中TNF-α目標失活的小鼠中關節病變的概率降低。近期TNF-α抑制劑藥物也開始試用于硬皮病的臨床治療中。細胞因子中的TNF-α是炎性反應的誘發因子。近幾年人們通過體外細胞和小鼠模型的研究[11-12],可以得知TNF-α、IL-1β、IL-6和IL-10等炎性反應因子在血友病關節病變的形成過程中起著重要作用。Forsyth等[13]提出血友病關節出血后,實際的機械損傷引發的出血可能微乎其微,而促炎性細胞因子(特別是TNF-α、IL-1β、IL-6)通常作為組織修復因子,巨噬細胞樣滑膜細胞來增生擴增,隨著鐵、成纖維細胞樣滑膜細胞增生,對滑膜和軟骨組織造成進一步破壞,在關節內出血后進行正常傷口愈合時大大地延長了正常的生理時間,導致了病理性的結果而不是生理性的修復。
本研究顯示關節出血期TNF-α的mRNA表達水平明顯升高,差異有統計學意義,而TNF-α血清蛋白可見升高,但差異無統計學意義,考慮本研究標本均用臨床檢測因子抑制物剩余標本,實驗取血時間和標本收取存在困難,而TNF-α血清蛋白容易裂解,不穩定,故認為mRNA表達水平相對穩定,結果更加可信,故關節出血期TNF-α升高。
本研究顯示急性關節出血期伴關節病變與不伴關節病變的患兒相比較,TNF-α的mRNA表達水平明顯升高,且差異有統計學意義,而未見其他因子的升高,故認為TNF-α在關節病變時會升高,是關節病變形成的關鍵因子。
本研究還顯示,關節出血慢性期TNF-α的mRNA高于無關節出血組,并且差異有統計學意義(P<0.05),而IL-1β、IL-6未見明顯升高,可見TNF-α在急性期及慢性期持續升高,并且在伴關節病變的患兒中升高明顯,故認為TNF-α是血友病慢性滑膜炎形成中的關鍵炎性因子,并且在慢性關節病變形成過程中可能發揮重要作用。
雖然血友病關節病變的機制仍不甚明確,但是人們逐漸認識到血友病關節病變是血友病患者關節腔內頻繁出血引起的軟骨退行性變和滑膜炎性反應[14-15],因此探討關節病變和炎性反應因子的關系,可尋找有效控制關節病變進展的靶點藥物,以提高血友病關節病變的防治水平。而本研究顯示,關節出血后炎性反應因子釋放升高,并且在關節出血慢性期仍可見TNF-α明顯升高,同時伴關節病變的患兒的TNF-α表達水平較不伴關節病變者明顯升高,故認為TNF-α可能參與了慢性關節病變的形成,而其他炎性反應性關節炎中,尤其是類風濕關節炎中,細胞因子TNF-α已經成為類風濕性關節炎的主要藥物靶點,TNF-α抑制劑在臨床中也廣泛應用。因此,筆者期待如同目前已經應用于臨床的類風濕關節炎的治療一樣,將TNF-α抗體用于血友病性關節病的治療,為預防血友病性關節病變提供新的治療方向和思路。
但本研究也存在局限性,本研究的入組患者的年齡并不均等,主要是急性出血期伴靶關節病變的患兒一般均為年齡較大患兒,故年齡出現明顯不均等, 而兒童的細胞因子水平與年齡無關,故考慮本研究中年齡對于細胞因子水平的影響不大,同時本研究為橫斷面研究,未進行隨訪調查研究,且病例研究數量少,因此,需要前瞻性、大樣本、動物實驗等研究進一步證實。
結論:重型血友病A患兒關節出血急性期IL-1β、IL-6、TNF-α表達升高,以TNF-α升高為主,慢性期只見TNF-α表達升高,伴有關節病變的患兒TNF-α表達水平明顯升高,故TNF-α是關節病變形成的關鍵因子。
[1] Haxaire C, Blobel C P. With blood in the joint-what happens next? Could activation of a pro-inflammatory signalling axis leading to iRhom2/TNF-α-convertase-dependent release of TNF-α contribute to haemophilic arthropathy?[J]. Haemophilia, 2014, 20(Suppl 4):11-14.
[2] Murdaca G, Spano F, Contatore M, et al. Potential use of TNF-α inhibitors in systemic sclerosis[J]. Immunotherapy, 2014, 6(3):283-289.
[3] Srivastava A, Brewer A K, Mauser-Bunschoten E P, et al. Guidelines for the management of hemophilia[J]. Haemophilia, 2013, 19(1):e1-e47.
[4] Narkbunnam N, Sun J, Hu G, et al. IL-6 receptor antagonist as adjunctive therapywith clotting factor replacement to protect against bleeding-induced arthropathy in hemophilia[J]. J Thromb Haemost, 2013, 11(5):881-893.
[5] Jansen N W, Roosendaal G, Hooiveld M J, et al. Interleukin-10 protects against blood-induced joint damage[J]. Br J Haematol, 2008, 142(6):953-961.
[6] Astermark J, Dolan G, Hilberg T, et al. Managing haemophilia for life: 4th haemophilia global summit[J]. Haemophilia, 2014, 20(Suppl 5):1-20.
[7] ?vlisen K, Kristensen A T, Jensen A L, et al. IL-1β, IL-6, KC and MCP-1 are elevated in synovial fluid from haemophilic mice with experimentally induced haemarthrosis[J]. Haemophilia, 2009, 15(3):802-810.
[8] Fischer K,van der Bom J G,Mauser Bunsehoten E P,et al. The effects of postponing prophylactic treatment on long-term outcome in patients with severe hemophilia[J].Blood,2002,99(7):2337-2341.
[9] Hermans C, De Moerloose P, Fischer K, et al. Management of acute haemarthrosis in haemophilia a without inhibitors: literature review, European survey and recommendations[J]. Haemophilia, 2011, 17(3):383-392.
[10] McCarthy A, Moore A, Redhead L, et al. Development of haemophilic arthropathy of the ankle: results of a Delphi consensus survey on potential contributory factors[J]. Haemophilia, 2014, 21(1):116-123.
[11] Ji H, Pettit A, Ohmura K, et al. Critical roles for interleukin 1 and tumor necrosis factor α in antibody-induced arthritis[J]. J Exp Med, 2002, 196(1): 77-85.
[12] Valentino L A. Blood‐induced joint disease: the pathophysiology of hemophilic arthropathy[J]. J Thromb Haemost, 2010, 8(9): 1895-1902.
[13] Forsyth A L, Rivard G E, Valentino L A, et al. Consequences of intra-articular bleeding in haemophilia: science to clinical practice and beyond[J]. Haemophilia, 2012, 18(Supple 4):112-119.
[14] 郝曉陽, 王霖虹,謝燕燕,等.血友病患者骨代謝相關生化指標及細胞因子特點的研究[J].中國煤炭工業醫學雜志,2016,19(8):1108-1112.
[15] 郝曉陽,閆振宇.血友病性骨質疏松的研究進展[J].中國煤炭工業醫學雜志,2016,19(1):167-170.

