維藥布亞中金雀花堿誘導HepG-2細胞凋亡作用及其衍生物的制備
于蕾,尚東雨,楊經輝,陳志峰,王鑫,姜波,孫永雪,張連芳,季宇彬(.哈爾濱商業大學 生命科學與環境科學研究中心,黑龍江 哈爾濱 50076;2.國家教育部抗腫瘤天然藥物工程研究中心,哈爾濱 50076)
維藥布亞(SophoraalopecuroidesL.)屬于豆科槐屬植物,又稱苦豆子,全株具有味苦性寒的特點,發揮清熱消暑、利尿除濕、抗菌消炎、止痛鎮靜等作用,在臨床上能有效治療濕熱痢疾,喉痛、咳嗽,腸炎泄瀉及濕疹等濕熱性或血液質性疾病[1]。維藥布亞中含有豐富的生物堿類成分,其中金雀花堿(Cytisine)又被稱為金雀花酮堿、野靛堿以及烏樂堿,屬于喹諾里西啶類生物堿[2]。維藥布亞中的生物堿歸屬于喹諾里西啶類生物堿,這類生物堿具有相似的結構和功能,野決明屬和紫藤屬等這些不同屬的植物中也含有此類生物堿[3]。20世紀60年代初,人類就已經發現此類生物堿具有抑瘤作用,其中維藥布亞總堿、苦參堿和槐定堿早已用于臨床治療惡性腫瘤,槐定堿是Ⅰ類抗癌新藥[4],而結構相似的金雀花堿抗癌效果在最進研究中才初見端倪。
天然抗腫瘤藥物以其作用機制獨特、毒副作用低的特點一直是近年來抗腫瘤藥物研究的一個熱點,通過對天然藥物進行化學結構修飾可以提高藥物作用強度、提高藥物特異性或降低藥物毒副作用,或優化其物理化學活性[5]。Rouden J[6]等人對金雀花堿進行化學修飾反應得到了一系列的9-及10-取代金雀花堿衍生物,對其進行親和力分析實驗,結果,兩個10-取代衍生物在與α4β2膽堿受體亞型的結合試驗中具有比金雀花堿更高的選擇性,分別是金雀花堿的3000倍及900倍。合成的9-乙烯基金雀花堿與金雀花堿的生物活性非常相似,同時還可以穿透血腦屏障,提高了金雀花堿的生物活性及利用價值。Houllier N[7]等人合成了一系列新的N-(芳烷基)和N-(芳酰基)-金雀花堿,對其進行大鼠α4β2和α7膽堿受體亞型結合的實驗研究,結果表明多數修飾后的衍生物對α4β2膽堿受體亞型具有高親和性。其中的3個衍生物的鈣離子活性及電生理實驗結果顯示,這三個衍生物對不同的亞型表現出拮抗劑或部分激動劑活性,表明N取代基的金雀花堿衍生物對其活性有很大的影響。本實驗通過對金雀花堿進行結構修飾,試圖提高金雀花堿的生物活性及利用價值,減小藥物副作用,為獲得更佳的抗腫瘤衍生物進了初步的研究。
本實驗首先通過MTT法對金雀花堿進行體外抗腫瘤實驗,發現其具有明顯抑制人肝癌HepG-2細胞增殖的活性。在此研究基礎上,進一步對金雀花堿作用后HepG-2細胞形態及其超微結構進行觀察,確定其是否對細胞生長狀態及細胞內的超微結構產生影響。本實驗還應用流式細胞儀檢測金雀花堿作用后HepG-2細胞凋亡率。此外,本實驗采用親核取代的方法對活潑氫進行取代,得到金雀花堿衍生物N-乙酰基金雀花堿,并采用MTT法檢測N-乙酰基金雀花堿對HepG-2細胞的增殖抑制作用并與金雀花堿進行比較。
1 材料與方法
1.1 材料
1.1.1 細胞株
人肝癌HepG-2細胞,由哈爾濱商業大學生命科學與環境科學研究中心提供。HepG-2細胞用含10%胎牛血清的RPMI1640培養液在37 ℃,5%CO2培養箱中培養,取對數生長期的細胞用于實驗。
1.1.2 藥物及試劑
金雀花堿(純度>98%,批號:20111101C),陜西大河藥業有限責任公司;羥基喜樹堿(HCPT,純度>98%,批號:H109197),阿拉丁試劑有限公司;胰蛋白酶(批號:20130308),美國Sigma藥物公司;二甲基亞砜(DMSO)(批號:20120726),天津巴斯夫化工有限公司;RPMI-1640培養基(批號:20130507),GIBCO公司;胎牛血清(批號:20130206),杭州四季青生物工程公司;MTT(溴化四氮唑藍)(批號:2010212),北京索萊寶科技有限公司;碘化丙啶(PI)(批號:P4170),Sigma公司;RNase A(批號:V900498),Sigma公司;Triton-X-100(批號:V900502),上海華舜生物工程有限公司;枸櫞酸鈉(分析純,批號:20120625),北京康普匯維科技有限公司。
1.1.3 實驗儀器
ZF-C型三用紫外分光儀,上海康禾光電儀器有限公司;ADVANCE III 600MHz高分辨核磁共振波譜儀,Bruker公司;Olympus-CKI41倒置顯微鏡,日本Olympus公司;680型全自動酶標儀,美國BIO-RAD公司;JEM-1220透射電子顯微鏡,日本電子公司。
1.2 方法
1.2.1 MTT法檢測金雀花堿對人肝癌HepG-2細胞的生長抑制作用

細胞生長抑制率=( A對照組- A試驗組)/ A對照組×100%。
1.2.2 倒置顯微鏡觀察金雀花堿作用后HepG-2的細胞形態
胰酶消化后稀釋為濃度為3×105個/mL的細胞懸液,每孔1 mL接種于6孔培養板,培養24 h后,每孔加1 mL不同濃度的藥液,金雀花堿實驗組的濃度分別為2.5、5、10 mmol/L,陽性藥HCPT的濃度為60 μmol/L,空白對照組每孔加1 mL 的RPMI1640培養液,藥物作用48 h后,在倒置顯微鏡下拍照觀察其形態變化[10-11]。
1.2.3 透射電子顯微鏡觀察金雀花堿對HepG-2細胞超微結構的影響
取對數生長期的HepG-2細胞,胰酶消化后,以3×105個/mL接種于6孔板,24 h后給藥,每個濃度3個平行組,金雀花堿的給藥濃度分別為2.5、5、10 mmol/L,陽性藥HCPT的濃度為60 μmol/L,空白對照組加等體積的RPMI 1640培養液,作用24 h后,收集細胞,立即用2%戊二醛固定2.5 h,再用鋨酸進行雙重固定。經乙醇梯度脫水,環氧樹脂包埋,超薄切片,醋酸鈾、檸檬酸鉛雙重染色后,透射電鏡下觀察并拍照[12]。
1.2.4 流式細胞儀檢測金雀花堿對HepG-2細胞凋亡率的影響
對數生長期的細胞,稀釋終濃度為3×105個/mL,接種于6孔板,培養箱培養24 h,每孔加1 mL不同濃度的藥液,每個濃度設3個平行孔,金雀花堿給藥組的濃度(2.5、5、10 mmol/L),陽性藥HCPT的濃度為60 μmol/L,空白對照組加1 mL的RPMI1640培養液,培養48 h后取出6孔培養板,每孔加入1 mL PBS緩沖液洗3次,1 mL 0.25 %胰蛋白酶消化,懸液移至離心管,1000 rpm、10 min離心收集細胞,PBS重懸并計數,取1×106個重懸的細胞,于4℃冰箱內固定液固定24 h,1000 rpm離心棄固定液,用PBS洗3次,避光條件下加PI染色液(避光條件下稱取枸櫞酸鈉33.4 mg,PI 5 mg,RnaseA 1 mg,加入Trtiton-X-100 0.5 mL,充分混勻)800 μL,混勻,孵育30 min;400目尼龍網過濾,流式細胞儀(Flow Cytometry, FCM)檢測[13-14]。
1.2.5 目標化合物的設計與合成及產物對人肝癌HepG-2細胞的生長抑制作用
圖1為金雀花堿化學結構式圖,3位上的N原子連接的H是活潑氫,所以容易被其他物質取代,本實驗在此理論基礎下,用Ac2O對其進行親核取代反應。目標化合物的合成路線如圖2。室溫、攪拌條件下,向前體化合物金雀花堿(95 mg,0.5 mmol)和乙酸酐(2.0 mL)混合溶液中,加入吡啶(2 mL,0.002 5 mmol),反應24 h,待TLC檢測底物金雀花堿消失,攪拌下將反應混合物倒入冰鹽水(50 mL)中,真空抽濾得到白色固體,TLC檢測所得固體為單一化合物,對產物進行1H-NMR檢測。此外,采用MTT法檢測金雀花堿衍生物對人肝癌HepG-2細胞的生長抑制作用,實驗方法及給藥劑量同1.2.1。

圖1 金雀花堿化學結構式

圖2 金雀花堿衍生物合成路線
1.3 統計學分析
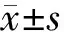
2 結果
2.1 MTT法檢測金雀花堿對人肝癌HepG-2細胞的生長抑制作用
實驗結果如圖3。金雀花堿作用于HepG-2細胞72 h后,隨著藥物濃度的增加,OD值顯著降低,HepG-2細胞的生長抑制率逐漸升高。經計算金雀花堿IC50為5.36 mmol/L。陽性藥HCPT對細胞的生長抑制作用顯著,72 h的半數抑制濃度IC50為8.56 μmol/L。
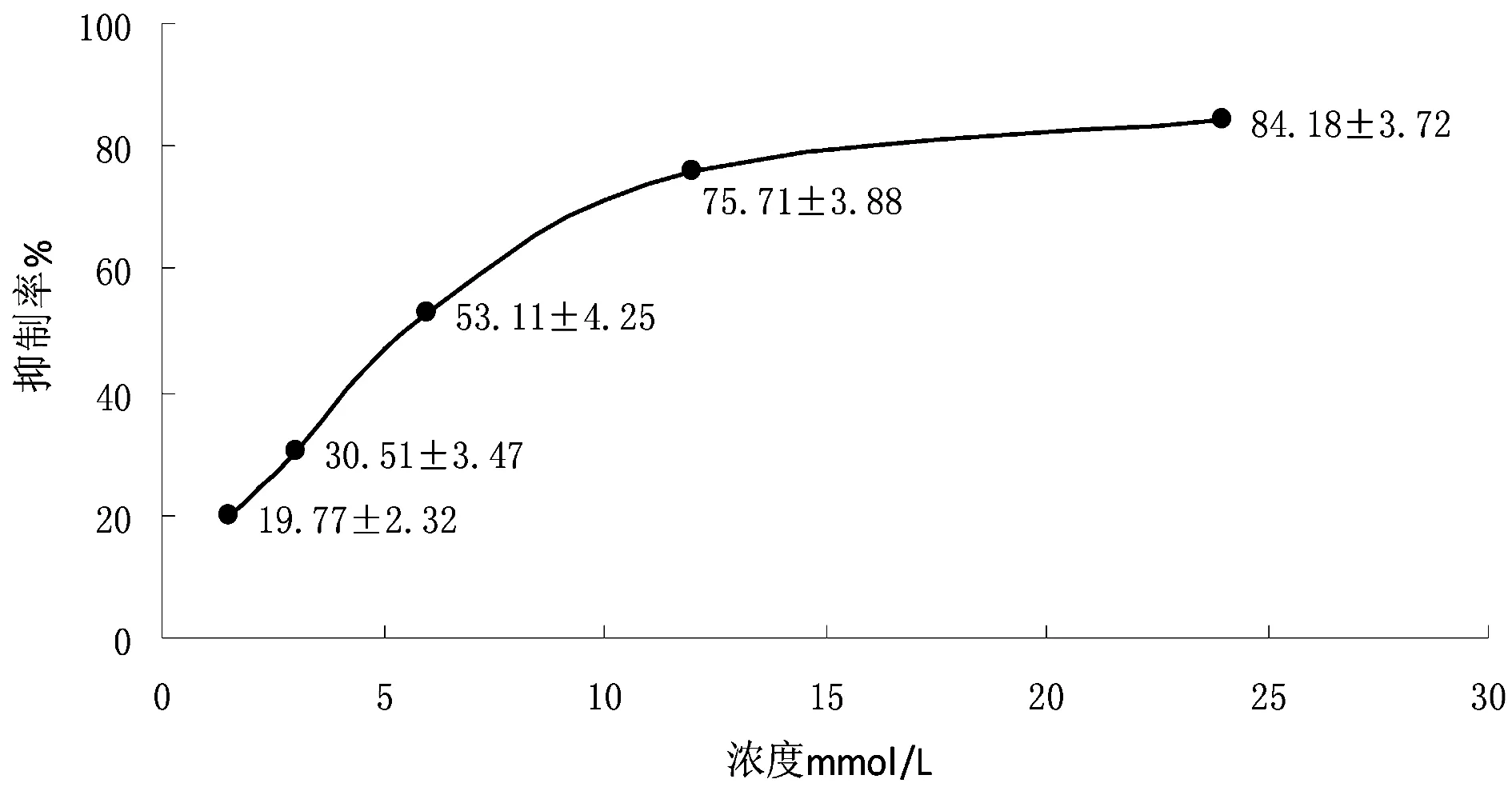
圖3 金雀花堿作用后HepG-2細胞的生長抑制率
2.2 倒置顯微鏡觀察金雀花堿作用后HepG-2的細胞形態
如圖4所示,細胞給藥48 h后,在普通倒置顯微鏡下觀察,發現空白對照組細胞會貼壁聚堆生長,細胞飽滿,邊緣清晰,無漂浮死細胞。HCPT對照組漂浮死細胞較金雀花堿中劑量組少,細胞存在明顯的形態學變化。隨著金雀花堿劑量的增加細胞體積逐漸變小,細胞逐漸變圓變粗糙,折光性逐漸減弱,貼壁細胞減少,出現懸浮死細胞。中高劑量組細胞多數脫落,有少數細胞體積變大,細胞破裂,呈壞死狀。

圖4 倒置顯微鏡觀察HepG-2的細胞形態(10×40)注:A.空白對照組;B.陽性對照組;C.低劑量組;D.中劑量組;E.高劑量組
2.3 金雀花堿對HepG-2細胞超微結構的影響
金雀花堿對HepG-2細胞超微結構的影響如圖5所示,空白對照組細胞結構清晰,細胞器結構完整,細胞表面少量微絨毛突起,細胞核較大,常染色質豐富,核仁明顯,胞漿呈均勻中等的電子密度,具有較多游離多聚核糖體,粗面內質網和線粒體散在分布于細胞中。不同濃度金雀花堿作用后可見細胞凋亡形態學改變,細胞表面微絨毛減少和消失,凋亡細胞可見大小不等球狀的突起及凋亡小體,細胞膜破裂,胞漿外溢;高劑量組內質網腔明顯擴張、線粒體腫脹。陽性對照組線粒體減少,細胞突起明顯減少,可見大面積內質網腫脹擴張可見典型凋亡細胞、凋亡小體。表明金雀花堿能損傷重要細胞器誘導HepG-2細胞凋亡。
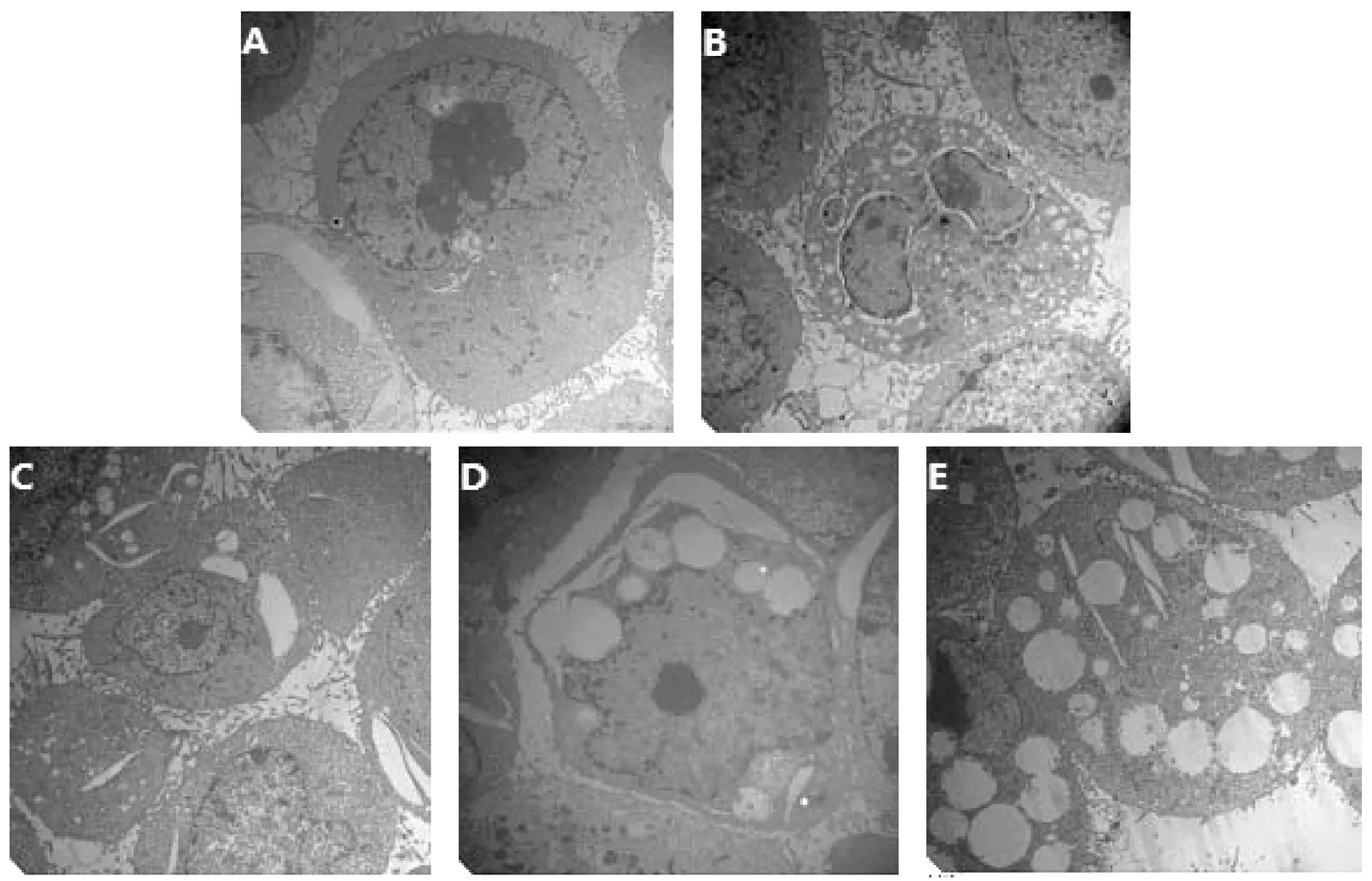
圖5 金雀花堿作用HepG-2細胞后的電鏡圖片(8000×)注:A.空白對照組;B.陽性對照組;C.低劑量組;D.中劑量組;E.高劑量組
2.4 流式細胞儀檢測金雀花堿對HepG-2細胞凋亡率的影響
不同濃度的金雀花堿作用于人肝癌HepG-2細胞48 h后,FCM檢測結果如表1和圖6顯示,金雀花堿給藥組的DNA直方圖中G0/G1峰前面出現明顯的亞二倍體凋亡峰,且隨著金雀花堿濃度的增加凋亡率也有顯著增加(P<0.01)。金雀花堿的給藥量為2.5 mmol/L時凋亡率為(3.72±0.49)%,隨著給藥量上升到10 mmol/L時,凋亡率上升至(65.74±3.34)%,呈一定的劑量依賴性。陽性組凋亡率為(15.83±3.16)%(P<0.01)。

表1 流式細胞儀檢測金雀花堿對HepG-2細胞的凋亡率
注:與空白組比較,**P<0.01
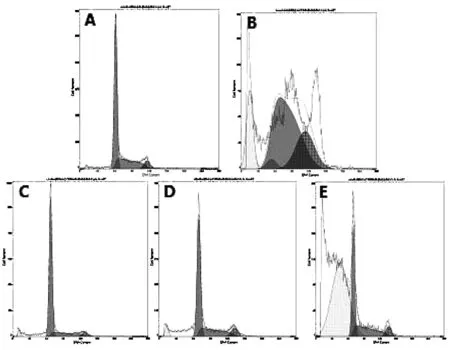
圖6 FCM檢測HepG-2細胞凋亡率注:A.空白對照組;B.陽性對照組;C.低劑量組;D.中劑量組;E.高劑量組
2.5 金雀花堿衍生物結構鑒定
將得到的產物點樣展開,TLC檢測,呈現藍紫色熒光的單一化合物,與反應物金雀花堿存在極性差異,表明原料金雀花堿完全反應得到產物。NMR檢測:白色固體,1H-NMR (500 MHz, CDCl3) δ 1.75 (s, 2H), 1.98~2.02 (m, 3H), 2.53 (s, 1H), 2.83(q, J=2.0, 1H), 3.09(s, 1H), 3.40 (q, J=1.5 Hz, 1H), 3.84~3.92 (m, 2H), 4.12 (q, J=2.0 Hz, 1H),4.74(dd, J=4.5 ,6.0Hz, 1H), 6.07(q, J=2.0 Hz, 1H), 6.46(q, J=1.5 Hz, 1H),7.30(s, 1H)。結果表明,產物為白色固體,與文獻[15]比對一致,故鑒定該化合物為N-乙酰基金雀花堿(N-acetylcytisine)。
2.6 MTT法檢測N-乙酰基金雀花堿對HepG-2細胞的生長抑制作用
MTT法檢測不同濃度金雀花堿及N-乙酰基金雀花堿對HepG-2細胞的生長抑制作用,經過3次平行實驗求出半數抑制濃度。由表2可明顯看出,N-乙酰基金雀花堿作用于HepG-2細胞72 h后,隨著藥物濃度的增加,OD值顯著降低,HepG-2細胞的生長抑制率逐漸升高。經計算金雀花堿IC50為5.51 mmol·L,N-乙酰基金雀花堿IC50為7.51 mmol/L。陽性藥HCPT對細胞的生長抑制作用顯著,72 h的半數抑制濃度IC50為8.56 μmol/L。
3 討論
維藥布亞(SophoraAlopecuraidesL.)是豆科槐屬(Sophora)植物,主要分布在我國西北的荒漠地區和中亞細亞一帶地區[16]。布亞全株具有味苦性寒的特點,發揮止痛鎮靜、清熱消暑、抗菌消炎、利尿除濕等作用,在臨床上能有效治療喉痛、濕熱痢疾、咳嗽、腸炎泄瀉及濕疹等濕熱性或血液質性疾病[17]。布亞含有多種化學成分,包含了有機酸、蛋白質、多糖、黃酮和生物堿等,其中生物堿含量最高,地上部分的生物堿含量占總生物堿的6.11%~8.03%,種子中的生物堿含量高達8.11%。布亞生物堿具有鎮靜鎮痛、降壓降脂、抗病毒、抗炎以及抗腫瘤作用,是布亞的主要生物活性成分[18]。
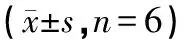
表2 MTT法測定金雀花堿及N-乙酰基金雀花堿對HepG-2的抑制率
注:與空白組比較,*P<0.05,**P<0.01
喹諾里西啶類生物堿的多種生物學活性得到了廣泛研究,其中包括槐定堿、苦參堿、苦豆堿在內的生物堿被證明具有良好的抗腫瘤活性,而關于金雀花堿該方面的研究卻少有報道[19-20]。本實驗首先通過體外實驗的方法,從增殖抑制作用、形態學觀察、細胞凋亡率等方面對金雀花堿的抗腫瘤作用進行研究。MTT法是一種常用的體外篩選抗腫瘤藥物的方法,操作簡便、敏感。活細胞線粒體中的脫氫酶可以把MTT代謝還原形成一種藍紫色不溶物-甲瓚化合物(Formazan),通過該原理測定不同給藥劑組顏色變化的深淺,得到腫瘤細胞生長狀況。通過計算測定的OD值得可到細胞受抑制的情況[21]。本研究發現金雀花堿能顯著抑制人肝癌HepG-2細胞增殖,IC50為5.36 mmol/L。
細胞凋亡是一個形態學的概念,發生凋亡的細胞有著典型的形態學特征[22]。采用倒置顯微鏡觀察給金雀花堿48 h后HepG-2細胞的形態變化。空白組細胞會貼壁聚堆生長,細胞飽滿,邊緣清晰,無漂浮死細胞,金雀花堿給藥組細胞隨著劑量的增加細胞體積逐漸變小,細胞逐漸變圓變粗糙,折光性逐漸減弱,貼壁細胞減少,出現懸浮死細胞,中高劑量組細胞多數脫落,有少數細胞體積變大,細胞破裂,呈壞死狀。此外,本實驗還采用透射電鏡進一步分析金雀花堿引起的HepG-2 細胞凋亡形態變化,結果顯示,不同濃度金雀花堿作用后可見HepG-2 細胞凋亡發生形態學改變,細胞表面的微絨毛減少或有些消失,凋亡細胞出現大小不等球狀的突起和凋亡小體,細胞膜被破裂,導致胞漿外溢;內質網腔擴張明顯,線粒體腫大。倒置顯微鏡和透射電子顯微鏡觀察結果都為證明金雀花堿能誘導HepG-2凋亡提供了形態學的依據。
對PI染色后的細胞進行FCM分析,可以發現在DNA直方圖上正常二倍體細胞的G0/G1峰前出現一個亞二倍體凋亡峰(apoptotic peak,AP峰),代表凋亡細胞。根據此峰可以得出凋亡細胞占總細胞數的百分率[23-25]。流式細胞儀檢測結果顯示給藥組出現明顯凋亡峰,且呈一定的劑量依賴性,高劑量組凋亡率為(65.74±3.34)%,明確了金雀花堿能誘導人肝癌HepG-2細胞的凋亡。通過對金雀花堿作用后細胞超微結構的觀察,發現其內質網腔明顯擴張、線粒體出現腫脹現象,說明金雀花堿誘導HepG-2細胞凋亡,可能是通過內質網應激及線粒體通路進行的。
研究顯示,多數N取代基的金雀花堿衍生物對其生物活性有很大的影響[7]。為提高金雀花堿的生物活性及利用價值,獲得活性更好,毒副作用更低的抗腫瘤金雀花堿衍生物,本實驗對金雀花堿進行化學結構修飾。本實驗分析得出目標化合物N-乙酰基金雀花堿,但MTT實驗結果顯示,經計算金雀花堿IC50為5.51 mmol/L,N-乙酰基金雀花堿IC50為7.51 mmol/L,提示其衍生物活性低于金雀花堿本身,并未能增強其抗腫瘤活性,說明金雀花堿的此種衍生物,不能起到增強藥效的作用,不再具備繼續研究的潛質。
綜上所述,金雀花堿體外具有抑制HepG-2細胞生長的作用,能夠誘導人肝癌HepG-2細胞凋亡。N-乙酰基金雀花堿能夠抑制HepG-2細胞的生長,但其作用較金雀花堿弱,表明在金雀花堿的3位N上修飾鏈狀結構Ac2O并不能增強金雀花堿的抗腫瘤活性。
[1] 郝偉亮,孟根達來,解紅霞.苦豆子的化學成分及藥理作用研究進展[J].中國藥房,2016,27(13):1848-1850.
[2] 吐爾孫阿衣·克力木,努爾麥麥提·如則,阿依努爾·阿不來提.維藥苦豆子研究近況[J].中國民族醫藥雜志,2016,40(5):66-68
[3] 游菁菁,李月英,沙碧瑩,等.中藥苦豆子生物堿的研究進展[J].江西中醫藥大學學報,2015,27(2):109-113,116.
[4] 田真真,萬紅嬌,楊翠萍.槐定堿的藥理研究綜述[J].中國實驗方劑學雜志,2010,16(11):219-221.
[5] 劉耀武,栗進才,夏成凱.關于天然藥物活性成分結構修飾與改造的研究探討[J].時珍國醫國藥,2009,20(6):1553-1555.
[6] Rouden J, Lasne MC, Blanchet J, et al. (-)-Cytisine and derivatives: synthesis, reactivity, and applications[J].Chem Rev,2014,114(1):712-778.
[7] Houllier N, Gopisetti J, Lestage P, et al. Identification of 9-fluoro substituted (-)-cytisine derivatives as ligands with high affinity for nicotinic receptors[J].Bioorg Med Chem Lett,2010,20(22):6667-6670.
[8] 蘆沖,張睿蘇,高彥宇,等.半枝蓮醇提物含藥血清對人結腸癌HT-29細胞增殖、凋亡和周期的影響[J].中醫藥學報,2016,44(2):51-54.
[9] 姬艷菊,徐巍.青龍衣提取物對人肝癌細胞株抑制作用的實驗研究[J].中醫藥學報,2014,42(5):30-34.
[10] 司維柯,肖桃元,康格非.苦參堿對人肝癌細胞HepG2的細胞形態影響和相關增殖因素的變化[J].第三軍醫大學學報,2000,22(6):553-556.
[11] Ji YB, Yu L. N-butanol extract of Capparis spinosa L. induces apoptosis primarily through a mitochondrial pathway involving mPTP open, Cyt-C release and Caspase activation[J].Asian Pac J Cancer Prev,2014,15(21):9153-9157.
[12] 王芝蘭,王榮田,郭立新,等.益腦靈對老年性癡呆模型大鼠學習記憶力及海馬細胞超微結構的影響[J].中醫藥學報,2005,33(3):50-52.
[13] 孫陽,吳勃巖,車艷新,等.鱉甲煎丸誘導肝癌細胞凋亡及對STAT信號通路的影響[J].時珍國醫國藥,2016,27(4):849-851.
[14] Shi J, Jiang Q, Ding X, et al. The ER stress-mediated mitochondrial apoptotic pathway and MAPKs modulate tachypacing-induced apoptosis in HL-1 atrial myocytes[J].PLOS One,2015,10(2):e0117567.
[15] Przyby AK, Kubicki M. A comparative study of dynamic NMR spectroscopy in analysis of selected N-alkyl-, N-acyl-, and halogenated cytisine derivatives[J].J Mol Struct,2011,985:157-166.
[16] 石雪蓉.抗腫瘤中藥的研究現狀[J].四川解剖學雜志,2009,17(3):32-34.
[17] 江蘇新醫學院.中藥大辭典(上冊)[M].上海:上海科學技術出版社,2010:322.
[18] 全國中草藥匯編組.全國中草藥匯編(上冊)[M].北京:人民衛生出版社,2003:12.
[19] Gao H, Guo Y, Deng N, et al. Suppressive Effect of Matrine on Tumor Invasion in N-Butyl-N-(4-Hydroxybutyl)Nitrosamine-Induced Urinary Bladder Carcinogenesis[J].Chemotherapy,2015,60(2):119-128.
[20] 林澤.槐屬植物中藥生物堿抗腫瘤作用機制研究[D].汕頭:汕頭大學,2008.
[21] liwka L, Wiktorska K, Suchocki P, et al. The Comparison of MTT and CVS Assays for the Assessment of Anticancer Agent Interactions[J].PLoS One,2016,11(5):e0155772.
[22] Colicos MA, Dash PK. Apoptotic morphology of dentate gyrus granule cells following experimental cortical impact injury in rats: possible role in spatial memory deficits[J].Brain Res,1996,739(1-2):120-131.
[23] Green DR. Means to an End: Apoptosis and other Cell Death Mechanisms [M].New York:Cold Spr Harbor Lab Press,2011:47-62.
[24] Grosse J, Warnke E, Wehland M,et al. Mechanisms of apoptosis in irradiated and sunitinib-treated follicular thyroid cancer cells[J].Apoptosis,2014,19(3):480-490.
[25] Fleisher TA. Apoptosis[J].Ann Allergy Asthma Immunol,1997,78(3):245-249.

