Methylocorus sp. MP 688菌株glyA基因體外表達及功能研究
孫宇桐,鄒琪琪,孫菊鮮,孫曉宇,齊姍姍,辛 琪,葛 欣(河北大學 生命科學學院,河北 保定 071002)
甲基營養菌是一種廣泛存在的微生物,它能夠將一碳化合物作為唯一的碳源和能源。Methylocorussp. MP 688是從土壤中篩選到的一株高產吡咯喹啉醌細菌,能夠以甲醇為唯一碳源生長。吡咯喹啉醌是在細菌中繼煙酰胺和黃酮之后的第3個氧化還原因子,菌株MP 688作為重要的吡咯喹啉醌生產菌在工業上有著重要的經濟價值[1-4]。因此,本文通過分析菌株MP688的基因組信息及代謝途徑,來探究菌體代謝活動中絲氨酸循環對于細胞生命活動所起的作用,無疑會對今后進一步改造菌體代謝通路起到重要的指導作用。
1 材料與方法
1.1 材料
MP688野生型菌種、質粒pGX為本實驗室保存;大腸埃希菌DH 5α及BL 21感受態、質粒pET-15b、瓊脂糖凝膠DNA回收純化試劑盒、普通質粒提取試劑盒購自北京天根生物公司;限制性內切酶、T4DNA連接酶等購自博邁德生物公司;考馬斯亮藍試劑、牛血清白蛋白溶液購自上海阿拉丁生化科技股份有限公司;無縫克隆試劑盒(ClonExpress?MultiS One Step Cloning Kit)購自Vazyme公司;測序及PCR引物合成由奧科鼎盛公司完成。
MP培養基。硫酸鎂0.2 g·L-1,硫酸銨3 g·L-1,磷酸二氫鉀1.4 g·L-1,磷酸氫二鈉3 g·L-1,檸檬酸鐵0.03 g·L-1,氯化鈣0.03 g·L-1,氯化錳0.005 g·L-1,硫酸鋅0.005 g·L-1,硫酸銅0.005 g·L-1,甲醇10 mL,pH值6.8。
逆向酶活底物反應液配置。DL-苯基絲氨酸(100 mmol·L-1) 25 mL,磷酸吡哆醛 100 μL(25 mmol·L-1),Na2EDTA(100 mmol·L-1) 500 μL,Na2SO4(250 mmol·L-1) 5 mL,K2HPO4-KH2PO4(pH 7.6) 5 mL,調節pH值至7.6,ddH2O定溶至50 mL。
1.2 SHMT蛋白體外表達及純化方法
1.2.1glyA基因的克隆及pET15b-glyA質粒構建
登錄GenBank查找菌株MP 688的glyA基因序列(NC014733),該開放閱讀框編碼一條由415個氨基酸組成的肽鏈,預測分子量為44.4 ku。通過Primer 5設計了一對寡聚核苷酸引物,序列見表1。基因組提取、PCR、酶切、連接、質粒轉化等常規分子生物學操作按照文獻[5]方法進行。使用質粒pET-15b作為glyA基因表達載體,轉化大腸埃希菌BL 21感受態細胞。
1.2.2glyA基因誘導表達
SHMT酶的表達、純化。按照1%接種量將轉化入pET15b-glyA質粒的BL 21感受態接入100 mL含有氨芐青霉素100 μg·mL-1的液體LB培養基中,在37 ℃,200 r·min-1搖床培養至菌濃度為D=0.6時,加入IPTG終濃度1 mmol·L-1,16 ℃,100 r·min-1誘導表達12~16 h。隨后,將全部培養物經10 000 r·min-1離心10 min。使用裂解緩沖液重懸菌體,超聲破碎菌體,5 min,將破碎后菌體4 ℃,12 000 r·min-1離心30 min。將上清與處理好的Ni螯合Chelating-Sepharose樹脂混勻,4 ℃旋轉搖床緩搖1 h;4 ℃,500g離心3 min,輕去上清,收集樹脂珠粒;加入5 mL含低濃度咪唑洗脫液,4 ℃旋轉搖床緩搖10 min,洗脫雜質;4 ℃,500g離心3 min, 輕去上清,收集樹脂珠粒,重復洗滌3次;再將1 mL洗脫液加入樹脂中,充分混合后離心,上清液中應含有高濃度目的蛋白;電泳檢測各組分,考察純化效果。
SHMT酶保存條件:4 ℃透析除鹽,每隔8 h更換一次透析液,逐漸降低透析液中的鹽離子濃度,透析后的蛋白溶液加入終濃度為5%甘油,-20 ℃保存。
1.2.3 SHMT酶活測定
BSA標準曲線繪制。將BSA標準溶液10 mg·mL-1依次進行梯度稀釋,取同樣體積稀釋液加入等體積的考馬斯亮藍溶液,每個梯度做3個平行并與96孔板中進行波長為595 nm吸光值檢測,記錄數值,并繪制BSA標準曲線。
苯甲醛標準曲線繪制。取苯甲醛母液(10 mmol·L-1)10 μL溶于10 mL ddH2O中,避光保存。將其依次進行梯度稀釋,取同樣的稀釋液加入等體積的考馬斯亮藍溶液,每個梯度做3個平行并與96孔板中進行波長為275 nm吸光值檢測,記錄數值,并繪制標準曲線。
最適酶促反應條件實驗及逆向酶活測定。在35 ℃條件下測定最佳酶促反應pH,分別使用磷酸緩沖液(pH值5.0~7.0)、Tris-HCl緩沖液(pH值7.5~8.5)作為緩沖體系。在pH 7.0條件下檢測最適反應溫度,范圍為25~60 ℃。將最高酶活定義為100%,然后分別計算其他條件下的相對酶活,繪制pH/溫度-相對酶活性曲線,以確定酶的最適pH值或溫度。
逆向酶活測定。測定純化后的酶蛋白濃度,再將1 μg酶蛋白加入1 mL底物溶液[6-10],最適溫度及pH值條件下避光反應1 h,測定D275數值并記錄。將SHMT酶活力單位定義為:1 μg SHMT酶35 ℃避光反應1 h條件下,轉化生成1 μmol·L-1的苯甲醛所具有的酶活力,稱為一個酶活力單位(IU,又稱U)。
1.3 雙交換系統glyA的敲除
1.3.1 敲除載體pGX-up-Gm-down構建
引物up-F、up-R用于擴增基因glyA的上游同源臂,引物down-F、down-R用于擴增基因glyA的下游同源臂;使用雙交換敲除法進行敲除實驗,以慶大霉素(Gm)為敲除標記。Gm-F,Gm-R引物用來擴增慶大霉素抗性基因。使用Vazyme公司無縫克隆試劑盒將片段和敲除載體pGX線性化質粒相連。引物序列及酶切位點見表1。

表1 引物序列的基本情況
1.3.2 雙交換glyA基因敲除
將pGX-up-Gm-down質粒通過電擊轉化的方法導入MP688菌株中, 將其均勻涂布于以添加果糖(20 mmol·L-1)及慶大霉素(50 μg·mL-1)的MP固體培養基(FGMP)上,28 ℃培養3 d。挑取單菌落,轉接FGMP液體試管2~3 mL,30 ℃搖床培養2 d。生長的培養液,轉接添加果糖(20 mmol·L-1)及卡那霉素(50 μg·mL-1)的MP液體培養基(FKMP)中,若在FGMP中生長且在FKMP中不長,則為通過雙交換法成功構建的glyA基因缺失菌。此外,還通過更換不同的碳源如甲醇來篩選敲除子。
2 結果與分析
2.1 glyA基因體外表達
2.1.1 pET15b-glyA質粒構建及表達
我們使用primer premier 5.0軟件設計glyA基因引物,擴增得到完整的glyA基因,將其成功連接到表達質粒上,PCR驗證結果及雙酶切結果見圖1。通過化學轉化法成功構建大腸埃希菌BL 21轉化子,誘導表達后進行SDS-聚丙烯酰胺凝膠電泳,發現加入誘導物的培養物在42.5 ku大小處條帶明顯加粗,蛋白電泳圖片見圖2。

1為Marker;2為雙酶切驗證;3為glyA 基因;4為空載酶切;5為環狀質粒圖1 pET-15b-glyA質粒構建驗證

1為Marker; 2為未誘導; 3~4為誘導圖2 IPTG誘導轉化子表達SHMT蛋白電泳結果
2.1.2 SHMT蛋白表達及純化
根據膠圖發現42.5 ku蛋白為雙帶。由此得出兩個猜想:SHMT蛋白被水解破壞;SHMT蛋白上樣緩沖液處理在變性過程中未能完全將其還原,其中含有兩個或多個半胱氨酸,因此出現兩種結構。為驗證猜想的正確性,我們登錄NCBI查找MP 688表達的SHMT氨基酸序列,分析其氨基酸序列及組成。由于SHMT序列在68及165位置處為半胱氨酸,可能導致分子內或分子間形成二硫鍵,序列如圖3。進一步導致純化的蛋白出現如圖4中條帶3~5的雙帶。因此,再次進行SDS-聚丙烯酰胺凝膠電泳,并在上樣前補加β-ME,電泳結果見圖5,從而解決了非均一條帶的問題。

圖3 SHMT氨基酸序列
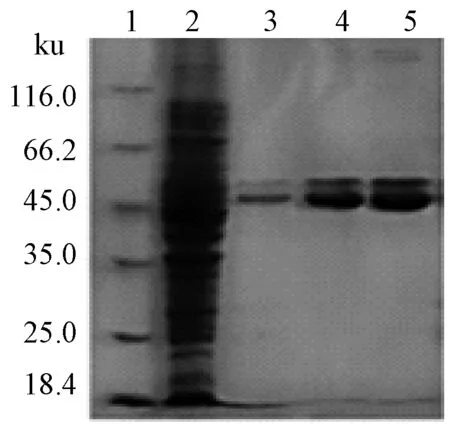
1為Marker; 2為破碎菌體; 3~5為純化蛋白圖4 SHMT蛋白純化電泳結果
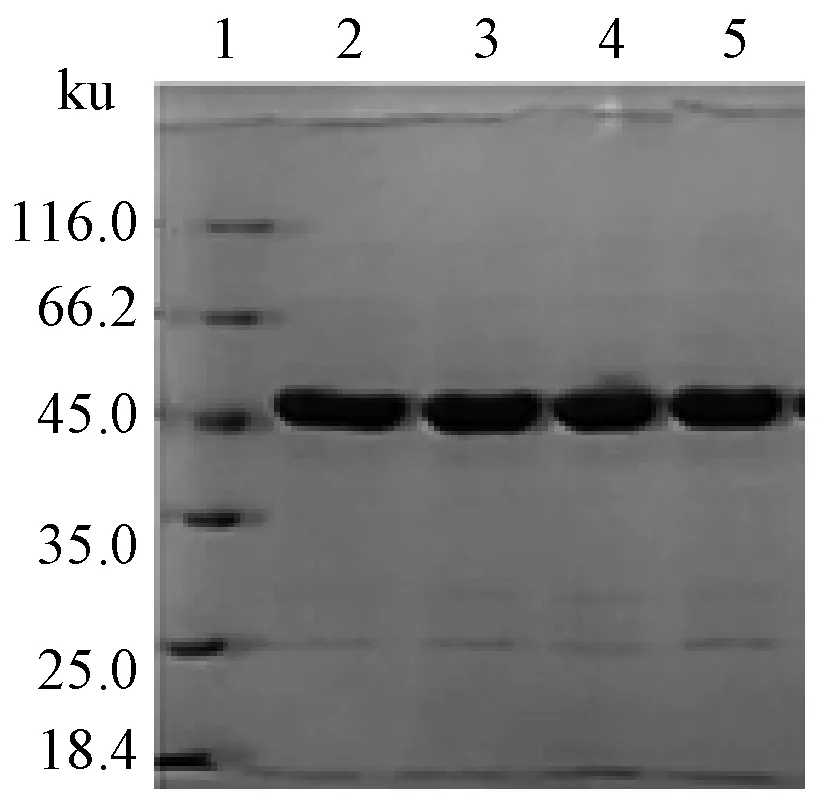
1為Marker; 2為破碎菌體; 3~5為純化蛋白圖5 還原SHMT蛋白電泳結果
2.2 SHMT蛋白的酶活力
2.2.1 蛋白含量測定標準曲線
記錄梯度稀釋BSA蛋白D595吸光值并使用Excel繪制標準曲線如圖6。
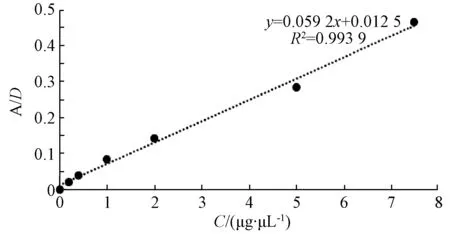
圖6 蛋白濃度標準曲線
2.2.2 純化后蛋白濃度
使用合適稀釋梯度的純化蛋白溶液加入考馬斯亮藍溶液,做3個平行并于96孔板中進行波長為595 nm吸光值檢測,平均吸光值為0.018 4。代入BSA標準曲線所得方程式中計算,得出蛋白濃度為0.1 g·L-1。
2.2.3 苯甲醛標準曲線
苯甲醛母液(10 mmol·L-1):10 μL溶于10 mL ddH2O中,避光保存。記錄苯甲醛標準曲線測定數據,使用Excel繪制苯甲醛標準曲線,見圖7。

圖7 苯甲醛標準曲線
2.2.4 逆向酶活力
測定不同溫度或不同pH條件下的酶促反應速率,記錄數值并計算在不同條件下的相對酶活力,繪制柱狀圖,如圖8及圖9。得出SHMT酶最適反應pH值為7.5,最適催化溫度35~40 ℃。因此,后續實驗選擇在pH 值7.5的條件下,35 ℃反應1 h測定D275處的吸光值,并計算酶活。

圖8 pH值對SHMT酶活力影響
結合SHMT酶一級結構序列,引發我們探究還原及非還原狀態對酶活性的影響。我們在測定逆向酶活的同時,梯度添加β-巰基乙醇(β-ME)為實驗組,正常不添加還原劑的反應組為對照組,分別做3組平行測定SHMT逆向酶活力,將1 μg酶蛋白加入1 mL底物溶液(pH值7.5)中,35 ℃ 避光反應1 h,測定D275。測定結果見表2。
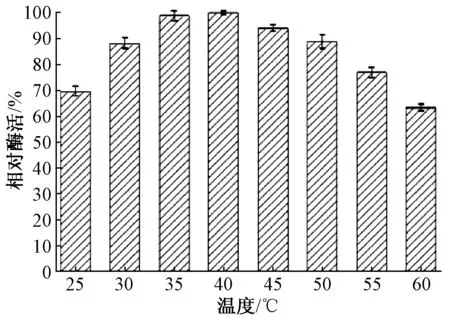
圖9 溫度對SHMT酶活力影響
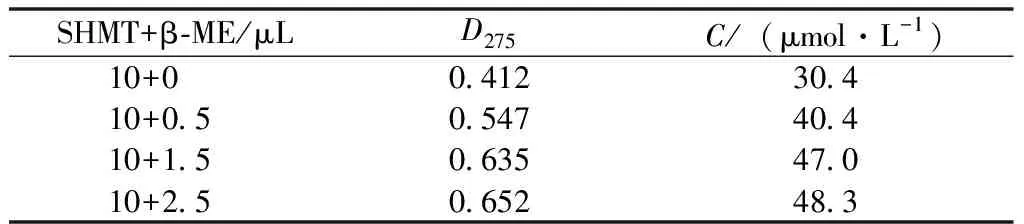
表2 苯甲醛的吸光值
注:β-ME影響吸光值,所以梯度添加β-ME時,應該以加β-ME的底物反應液為空白對照調0。
根據酶活定義可以得出1 μg SHMT酶在正常催化條件下的酶活力為30.4 IU,在添加β-ME的純化條件下酶活力為48.3 IU。
2.3 glyA敲除質粒構建
2.3.1glyA敲除
通過GenBank中查找到glyA基因上下游各1 500 bp左右的片段及慶大抗性基因通過無縫克隆設計相關引物并成功擴增出3個條帶,使用pGX質粒作為載體,成功構建出glyA敲除質粒。敲除質粒構建及雙酶切驗證見圖10。

a為擴增片段(1表示DNA marker,2表示Up片段,3表示Gm片段,4表示down片段; 5表示glyA片段);b為pGX-glyA重組敲除質粒;c為敲除質粒雙酶切驗證圖圖10 pGX-glyA敲除質粒構建及雙酶切驗證
2.3.2 敲除結果
電轉野生型MP 688感受態細胞,將其均勻涂布于FGMP固體平板上,28 ℃培養3 d。反復挑取單菌落,接FGMP液體試管2~3 mL,30 ℃搖床培養。2 d后,生長的培養液,轉接FKMP液體培養基。通過更換不同的碳源如甲醇,代替果糖進行敲除子篩選實驗。由于反復篩選敲除子,我們得到多株可在添加慶大霉素的MP培養基中生長的菌株,始終未得到缺失型菌株。
3 討論
我們成功將MP688菌株glyA基因在體外表達、純化并測定SHMT酶活性。在純化蛋白的過程中發現,合理地添加β-ME可以使酶處于還原狀態并維持均一的空間結構。發現相同的實驗條件下,在酶促反應體系中添加β-ME,可大幅增加苯甲醛產量。依據本文酶活力單位的定義,我們可以得出,在相同的實驗條件下,添加β-ME的酶促反應體系可顯著增強SHMT酶催化效率。
由于反復篩選敲除子,并沒有得到缺失型菌株。分析MP 688菌株代謝途徑,參考報道的MethylobacteriumextorquensAM 1菌株代謝模塊見圖11[6]。細菌菌體代謝有機碳源為菌體生長代謝提供必需的能量,同化C1單位促進菌體生長繁殖。通常菌株經糖酵解途徑后到達絲氨酸循環及檸檬酸循環實現C1單位利用。菌株MP 688與AM 1代謝途徑存在巨大差異,可發現菌株MP 688基因組較AM 1所含信息量少。
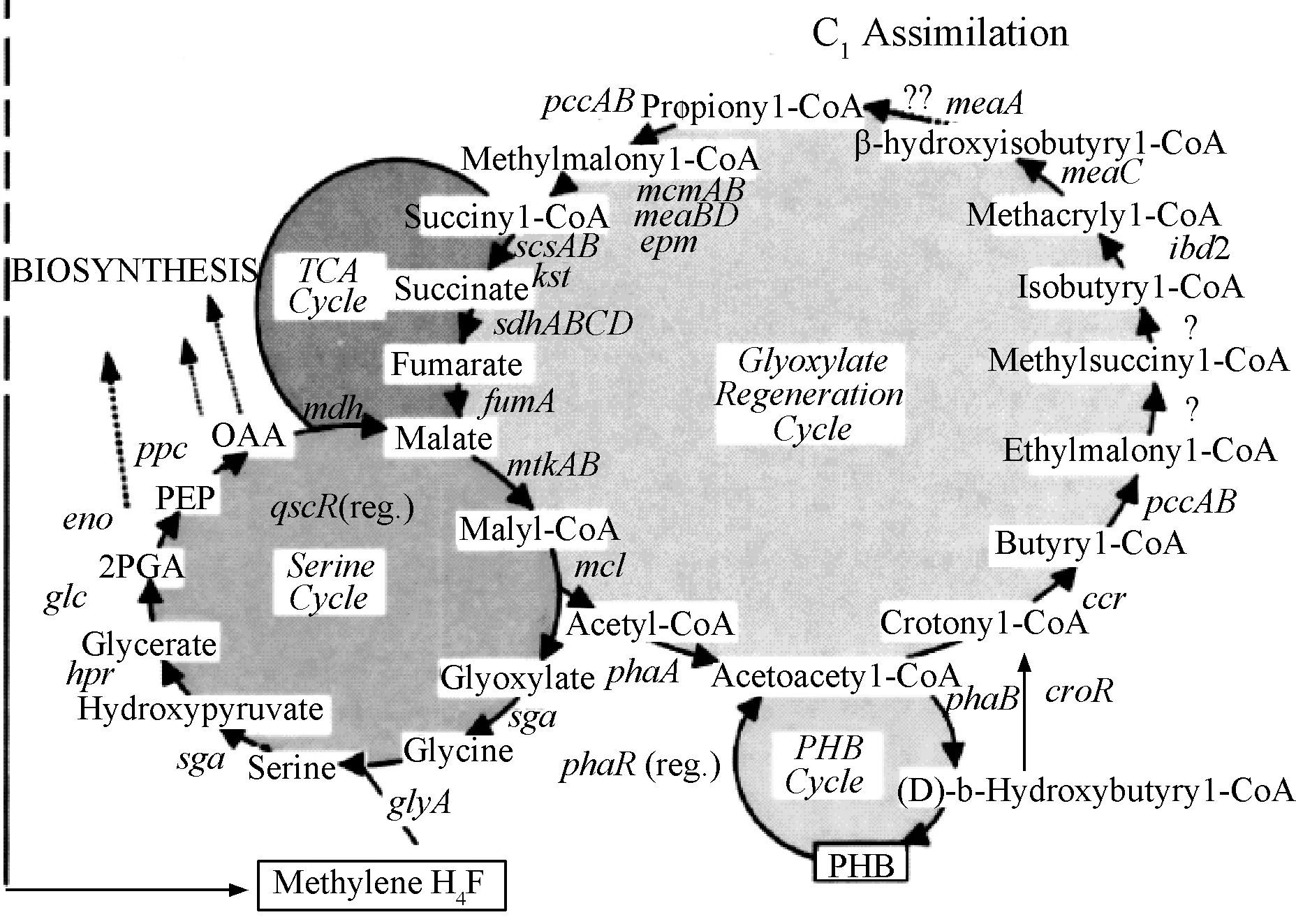
圖11 菌株Methylobacterium extorquens AM1的C1同化通路
菌株MP 688檸檬酸循環通路不完整,缺少草酰琥珀酸向琥珀酸-CoA轉化的酶及琥珀酸向延胡索酸轉化的酶基因。菌株MP 688沒有完整的檸檬酸途徑及絲氨酸循環途徑,C1同化由SHMT酶催化完成,必將通過其他代謝通路來形成環形通路。
在MP688菌株基因組中發現能夠催化絲氨酸-甘氨酸之間相互轉化的基因只有glyA基因一種。因此,我們推測glyA基因在菌體固定C 1單位中作為關鍵基因存在,起到不可替代的作用。一旦缺失,菌株將會致死。這為后一步改造該菌種,構建吡咯喹啉醌高產菌株具有十分重要的意義。
參考文獻:
[1] XIONG X H, ZHI J J, YANG L, et al. Complete genome sequence of the bacteriumMethylovorussp. strain MP688, a high-level producer of pyrroloquinolone quinone[J]. Journal of Bacteriology, 2011, 193(4):1012-1013.
[2] CHISTOSERDOVA L, CHEN S W, LAPIDUS A, et al. Methylotrophy inMethylobacteriumextorquensAM1 from a genomic point of view[J]. Bacteriology, 2003, 185(10): 2980-2987.
[3] 李大攀,葛欣,魏靜遠,等. 甲基營養菌 MP688甲醇脫氫酶基因mpq1818的敲除及功能研究[J]. 生物技術通訊, 2015, 25(5):632-635.
[4] NAYAK D D, MARX C J. Genetic and phenotypic comparison of facultative methylotrophy betweenMethylobacteriumextorquensstrains PA1 and AM1[J]. PLoS ONE, 2014, 9(9):e107887.
[5] 奧斯伯, 布倫特, 金斯頓, 等. 精編分子生物學實驗指南[M]. 北京: 科學出版社, 1998.
[6] CHISTOSERDOVA L V, LIDSTROM M E. Genetics of the serine cycle inMethylobacteriumextorquensAM1: Cloning, sequence, mutation, and physiological effect ofglyA, the gene for serine hydroxymethyltransferase[J]. American Society for Microbiology, 1994, 176(21):6759-6763.
[7] 沈天翔,那淑敏,喻國策,等. 大腸桿菌絲氨酸羥甲基轉移酶基因(glyA)的克隆和表達[J]. 微生物學報, 1997, 37(6): 423-428.
[8] FLORIO R, DI SALVO M L, VIVOLI M, et al. Serine hydroxymethyl-transferase: A model enzyme for mechanistic, structural, and evolutionary studies[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2010, 1814(11): 1489-1496.
[9] DIJKMAN W P, FRAAIJE M W. Discovery and characterization of a 5-hydroxymethylfurfural oxidase fromMethylovorussp. strain MP688[J]. Applied Environmental Microbiology, 2014, 80(3):1082-1090.
[10] GE X, WANG W, HAN Y, et al.Methylovorussp. MP688 exopolysaccharides contribute to oxidative defense and bacterial survival under adverse condition[J]. World Journal of Microbiology & Biotechnology, 2013, 29(12):2249-2258.

