1-磷酸鞘氨醇在膿毒性休克患者表達及其與預后關系的研究
朱先華,胡曉飛
0 引言
膿毒性休克是指膿毒癥合并機體代謝系統、微循環系統等功能障礙,導致器官低灌注或器官功能不全[1]。目前針對膿毒性休克患者病情嚴重程度和預后評估方法以危重病評分為主,以急性生理和慢性健康狀況評分Ⅱ(Acute physiology and chronic health evaluationⅡ,APACHEⅡ)應用最為廣泛,但APACHEⅡ評分需要記錄患者多項生理、生化指標的檢測結果,評分過程容易滯后,導致患者錯過最佳治療方案的治療窗[2]。因此,尋找更加準確的評估膿毒性休克病情和預后、易于臨床檢測的生物學標志物已成為診治膿毒性休克領域的研究熱點之一。1-磷酸鞘氨醇(Sphingosine-1-phosphate,S1P)是一種脂質酶,在膿毒性休克的發生、發展中起到重要作用。S1P可促進炎癥因子表達、上調炎癥因子水平和參與炎癥反應[3-4]。近年研究顯示,S1P作為啟動炎癥反應的信號因子,尤其在膿毒性休克患者血清中呈強陽性表達。目前關于S1P與膿毒性休克病情嚴重程度和預后的關系仍不明確,相關文獻較少,缺乏統一定論。因此,本研究旨在分析S1P在膿毒性休克患者表達及其與預后的關系。
1 資料與方法
1.1 一般資料 選擇我院2015年1月至2017年1月收治的136例膿毒癥患者作為研究對象,分為單純膿毒癥、重度膿毒癥和膿毒性休克3個亞組。單純膿毒癥組33例,男18例,女15例,年齡24~69歲,平均(57.5±4.1)歲;重度膿毒癥組38例,男20例,女18例,年齡23~71歲,平均(56.9±3.8)歲;膿毒性休克組65例,男36例,女29例,年齡22~68歲,平均(56.3±4.3)歲。納入標準:所有患者符合膿毒癥診斷標準,病因包括肺部、尿路、腹腔、血行性細菌感染。排除標準:年齡<18歲,入院72 h內病死、合并腫瘤、免疫性疾病、嚴重心腦血管疾病、重要臟器功能障礙及具有哮喘病史的患者。本研究經醫院倫理委員會批準,且患者或其家屬均簽署知情同意書。
1.2 研究方法 比較各組血清S1P、降鈣素原(Procalcitonin,PCT)表達水平、APACHEⅡ評分、死亡率;根據膿毒性休克患者的APACHEⅡ評分,分為<15分、15~20分、>20分3個分段,比較不同分段的血清S1P、PCT表達水平、死亡率;根據膿毒性休克患者的預后情況,分為死亡組和存活組,比較兩組患者的血清S1P、PCT表達水平、APACHEⅡ評分;采用Spearman相關分析膿毒性休克患者血清S1P表達水平與PCT、APACHEⅡ評分、死亡率的相關性。
1.3 血清S1P和PCT表達水平的檢測 所有患者在入ICU治療24 h內,抽取空腹靜脈血3 mL,低溫離心5 min (3 000 r/min),分離血清,置于-80 ℃環境中待檢測;采用雙抗體夾心酶聯免疫吸附法(ELISA)檢測血清S1P和PCT表達水平,其中人S1P-ELISA檢測試劑盒由研域生物技術(上海)有限公司提供,人PCT-ELISA檢測試劑盒由武漢明德生物科技股份有限公司提供,嚴格按照試劑盒的使用說明書,準備試劑、標準品和樣品,并進行稀釋,加入生物素化抗體工作液,孵育、洗滌;加入酶結合物工作液,孵育、洗滌;加入底物溶液,孵育、洗滌后,加入終止液,在10 min內使用紫外分光光度計檢測,讀取吸光度值,統計回歸曲線方程,分別計算血清S1P和PCT表達水平。
1.4 APACHEⅡ評分方法 所有患者在入ICU治療24 h內,進行APACHEⅡ評分(由慢性健康狀況評分、年齡評分、急性生理學評分組成),參照標準進行判斷和加減評分,其分值越高,提示病情嚴重程度越大,預后越差。各項評分參數包括:體溫、呼吸頻率、心率、動脈血氧分壓、平均動脈壓、血細胞比容、pH值、血清鈉的濃度、血清鉀的濃度、血白細胞總數、血肌酐以及昏迷記錄評分等的最差值,與慢性健康狀況評分、年齡評分相加,最后得出總分[5-6]。

2 結果
2.1 各組血清S1P、PCT表達水平、APACHEⅡ評分、死亡率比較 膿毒性休克組血清S1P、PCT表達水平、APACHEⅡ評分、死亡率均高于單純膿毒癥組、重度膿毒癥組(P<0.05);而單純膿毒癥組與重度膿毒癥組的血清S1P、PCT表達水平、APACHEⅡ評分、死亡率比較差異無統計學意義(P>0.05)。見表1。
2.2 各APACHEⅡ分段的血清S1P、PCT表達水平及死亡率比較 APACHE Ⅱ<15分、15~20分、>20分膿毒性休克患者的血清S1P、PCT表達水平及死亡率比較差異有統計學意義(P<0.05);膿毒性休克患者血清S1P、PCT表達水平及死亡率隨著APACHE Ⅱ評分提高而提高(P<0.05)。見表2。
2.3 死亡組與存活組血清S1P、PCT表達水平及APACHEⅡ評分比較 死亡組血清S1P、PCT表達水平、APACHEⅡ評分均高于存活組(P<0.05)。見表3。
2.4 相關性分析 經Spearman相關分析,膿毒性休克患者血清S1P與PCT表達水平、APACHEⅡ評分、死亡率均呈明顯正相關(r=0.381、0.358、0.463,P<0.05)。
3 討論
膿毒性休克是由膿毒癥引起的休克,伴隨著不同程度的組織灌注不足,主要與細菌感染密切相關,多見于胰腺炎、膽管炎、膽囊炎等,已成為ICU患者死亡的最重要原因之一[7]。針對膿毒性休克,防治的關鍵在于及時準確地評估膿毒性休克患者的病情嚴重程度和預后,制定合理的治療方案,進而提高救治成功率[8]。目前臨床主要采用APACHEⅡ評分評價膿毒性休克的病情嚴重程度和預后,但APACHEⅡ評分具有嚴格的評分標準,需要患者的多項生理、生化指標的量化結果才能得出評分;同時,在APACHEⅡ評分過程中,需要收集患者的基本資料,難以在短時間完成APACHEⅡ評分,容易延誤對患者病情嚴重程度和預后的評估[9]。
S1P是一種脂質酶,亦是機體的重要炎癥介質,可由體內多種免疫細胞合成,如中性粒細胞、巨噬細胞、肥大細胞等[10-11]。同時,腫瘤壞死因子α、白介素1β等炎癥介質及內毒素可刺激中性粒細胞、巨噬細胞、肥大細胞等合成、分泌S1P,進而上調S1P表達水平。此外,S1P亦可促進腫瘤壞死因子α、白介素1β等炎癥介質的合成、分泌。PCT是一種反映膿毒癥及多臟器功能衰竭嚴重程度和預后的血清炎癥標志物之一,但在早期膿毒癥患者血清中表達不明顯[12]。通過本研究可知,膿毒性休克患者血清S1P與PCT表達水平呈明顯正相關;原因在于S1P與其他炎癥介質相互作用、促進合成,提示在膿毒性休克的發生、發展過程中,S1P與其他炎癥介質協同分泌,放大機體炎癥效應。
膿毒性休克是膿毒癥、重度膿毒癥進一步發展的病情嚴重階段[13-14]。本研究中,膿毒性休克組血清S1P表達水平高于單純膿毒癥組、重度膿毒癥組,且后兩組間差異無統計學意義,可能是因為在單純膿毒癥、重度膿毒癥的發展過程中,通過炎癥因子及毒性病原成分刺激,提高S1P合成關鍵酶磷酸化鞘氨醇激酶的表達水平或增強活性,與Hao等[15]的研究類似。李瓊等[16]研究發現,S1P參與革蘭陰性桿菌及內毒素引起膿毒性休克的病理過程。體外動物實驗表明,注射外源性的S1P可在短時間內導致小鼠出現持續低血壓狀態,類似于膿毒性休克的組織灌注不足;而預先注射S1P抑制劑,可有效解除持續低血壓狀態,改善血流動力學紊亂引起的癥狀[17-20]。S1P參與介導膿毒性休克發生、發展的原因可能為:S1P可擴張外周血管,降低血管活性物質表達水平,促進微血管滲出,減少冠脈的血流量,降低心肌收縮能力。研究表明,膿毒性休克患者存在不同程度的缺血-再灌注損傷,進而刺激S1P合成、分泌,這可能亦是膿毒性休克患者血清S1P表達水平較高的重要原因之一[21-22]。

表1 各組血清S1P、PCT表達水平、APACHEⅡ評分、死亡率比較
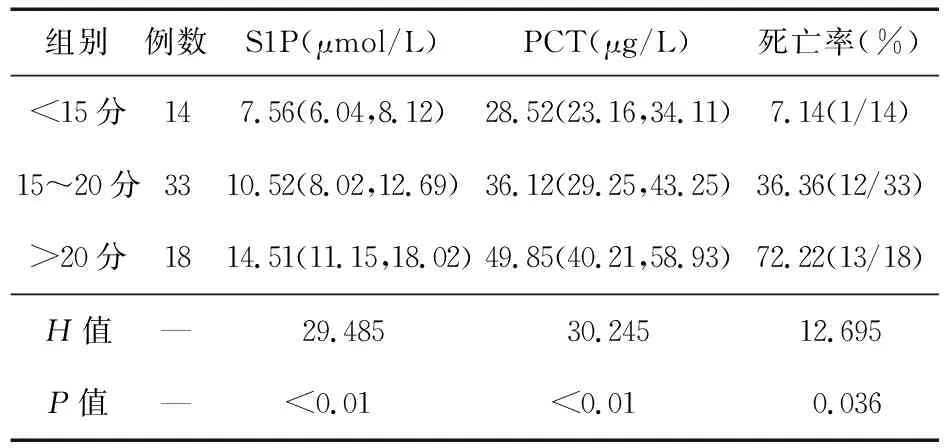
表2 各APACHEⅡ分段的血清S1P、PCT表達水平、死亡率比較
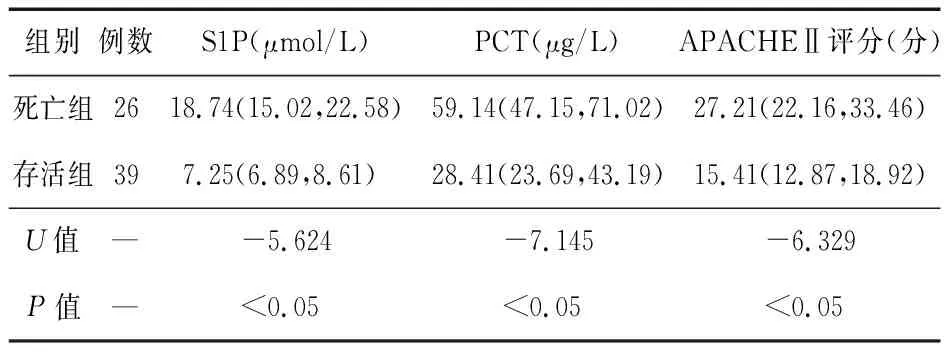
表3 死亡組與存活組血清S1P、PCT表達水平、APACHEⅡ評分比較
APACHE Ⅱ評分參數包括心率、動脈血氧分壓、平均動脈壓等生理指標及慢性健康狀況、年齡,主要用于評估危急重癥患者的病情嚴重程度和預后。在本研究中,膿毒性休克患者血清S1P表達水平隨著APACHE Ⅱ評分提高而提高,各APACHEⅡ分段間差異有統計學意義,且死亡組血清S1P表達水平高于存活組,提示S1P在膿毒性休克患者血清中表達水平顯著提高;結合Spearman相關分析,膿毒性休克患者血清S1P與PCT表達水平、APACHEⅡ評分均呈明顯正相關,可以認為膿毒性休克患者血清中S1P表達水平與患者的病情嚴重程度呈正相關。APACHEⅡ評分是目前評估膿毒性休克患者預后的常用指標,本研究顯示,死亡組血清S1P、PCT表達水平、APACHEⅡ評分均高于存活組,且膿毒性休克患者血清S1P表達水平與死亡率呈明顯正相關,此外,血清S1P表達水平的檢測流程較為便捷,可在3 h內完成,因此,膿毒性休克患者血清中S1P表達水平對于評估患者預后具有積極作用。
綜上所述,S1P在膿毒性休克患者血清中表達水平顯著提高,且與患者預后呈負相關,通過監測血清S1P表達水平,可評估病情嚴重程度和預后。
參考文獻:
[1] 程鵬雁,馬渝,陶楊,等.膿毒癥患者入ICU時血漿血小板活化因子水平與病情嚴重程度的相關性分析[J].重慶醫科大學學報,2014,12(7):1027-1031.
[2] Berthoux F,Mohey H,Laurent B,et al.Predicting the risk for dialysis or death in IgA nephropathy[J].J Am Soc Nephrol,2011,22(4):752-761.
[3] 趙蘊偉,徐意芹,王春玲,等.支氣管哮喘急性發作時血清1-磷酸鞘氨醇水平及其臨床意義[J].中國中西醫結合急救雜志,2017,24(2):177-179.
[4] Le W,Liang S,Hu Y,et al.Long-term renal survival and related risk factors in patients with IgA nephropathy:results from a cohort of 1155 cases in a Chinese adult population[J].Nephrol Dial Transplant,2012,27(4):1479-1485.
[5] Proia RL,Hla T.Emerging biology of sphingosine-1-phosphate:its role in pathogenesis and therapy[J].J Clin Invest,2015,125(4):1379-1387.
[6] Sui M,Zhou J,Xie R,et al.The sphingosine-1-phosphate receptor agonist FTY720 prevents the development of anti-glomerular basement membrane glomerulonephritis[J].Mol Biol Rep,2012,39(1):389-397.
[7] 田濤,趙允召,黎介壽.n-3多不飽和脂肪酸抑制SphK1信號通路改善膿毒癥的炎性反應[J].腸外與腸內營養,2016,23(5):309-313.
[8] 夏譽,葉素貞.EICU膿毒血癥患者預后評估及相關因素[J].實用醫學雜志,2017,33(11):1822-1825.
[9] Watson L,Tullus K,Marks SD,et al.Increased serum concentration of sphingosine-1-phosphate in juvenile-onset systemic lupus erythematosus[J].J Clin Immunol,2012,32(5):1019-1025.
[10]辛慰,吉慶春,彭秋月,等.1-磷酸鞘氨醇對肺成纖維細胞纖維化發生的影響和機制[J].實用醫學雜志,2017,33(10):1589-1592.
[11]劉慰華,林雙峰,石吉相,等.1-磷酸鞘氨醇在高糖誘導血管內皮細胞功能損傷中的作用[J].中國病理生理雜志,2016,32(2):245-250.
[12]黃嬌甜,盧秀蘭,張新萍, 等.降鈣素原清除率聯合序貫器官衰竭評分差值對兒童膿毒性休克預后評估的應用價值[J].中國小兒急救醫學,2017,24(11):831-836.
[13]陳濤,臧彬.膿毒癥及膿毒性休克患者T淋巴細胞亞群變化研究[J].臨床軍醫雜志,2017,45(1):46-48.
[14]李元塔,周廣裕,莫俊德.主動脈內球囊反搏術在膿毒性休克中的臨床應用[J].沈陽醫學院學報,2016,18(4):265-266.
[15]Hao J,Huang YM,Zhao MH,et al.The interaction between C5a and sphingosine-1-phosphate in neutrophils for antineutrophil cytoplasmic antibody mediated activation[J].Arthritis Res Ther,2014,16(4):R142.
[16]李瓊,常志芳,楊國安,等.1型1-磷酸鞘氨醇受體的siRNA對人涎腺導管上皮細胞的作用[J].北京大學學報(醫學版),2016,48(6):987-993.
[17]張堅,侯金超,徐孟龍,等.S1PR3激動劑KRX-725促進細菌清除影響膿毒癥小鼠預后[J].中華急診醫學雜志,2016,25(1):57-62.
[18]賀苗,趙杰,蘇健,等.1-磷酸鞘氨醇后適應對大鼠心肌缺血/再灌注損傷的保護作用[J].中國藥理學通報,2013,29(10):1369-1373.
[19]包馨慧,李海霞,陶靜,等.1-磷酸鞘氨醇/1-磷酸鞘氨醇1受體信號通路在大鼠肥大心肌細胞缺血后適應中的作用及其機制[J].中華心血管病雜志,2016,44(5):431-435.
[20]熊響清,王良榮,陳祥建,等.抑制鞘氨醇激酶-1/1-磷酸鞘氨醇信號通路減少大鼠肢體缺血再灌注肺損傷[J].中華實驗外科雜志,2016,33(11):2549-2551.
[21]Eitner F,Floege J.In search of a better understanding of IgA nephropathy-associated hematuria[J].Kidney Int,2012,82(5):513-515.
[22]Sutter I,Park R,Othman A,et al.Apolipoprotein M modulates erythrocyte efflux and tubular reabsorption of sphingosine-1-phosphate[J].J Lipid Res,2014,55(8):1730-1737.

