紅景天苷通過激活AMPK/PI3K/Akt/eNOS途徑減輕ApoE(-/-)小鼠動脈粥樣硬化
左曉利,黃紅瑩,孟祥毅
0 引言
動脈粥樣硬化是多種心腦血管疾病的基礎。內皮細胞損傷應答學說認為,動脈粥樣硬化是機體對血管內皮細胞損傷的一種慢性反應[1]。血管內皮細胞損傷表現為內皮功能障礙和紊亂,繼而引起氧化應激、脂質代謝異常、脂質物質積聚等一系列生理病理變化,從而促進動脈粥樣硬化形成[2]。紅景天苷(Salidroside,SAL)是從藥用植物紅景天中分離的苯乙醇類單一中藥成分,是紅景天的主要活性成分之一。研究表明,紅景天苷能夠激活DNA修復酶poly(ADP-核糖)、聚合酶(Parp-1),并保護細胞免受氧化應激[3]。近年研究表明,紅景天苷可以降低低密度脂蛋白受體缺陷小鼠的動脈粥樣化斑塊形成[4],但其抗動脈粥樣硬化作用的機制尚不完全清楚。本研究通過高脂肪飲食誘導ApoE(-/-)小鼠動脈粥樣硬化,探究紅景天苷對ApoE(-/-)小鼠動脈粥樣硬化的影響,并初步探討所涉及的相關分子機制。
1 材料與方法
1.1 動物來源及藥物 8周齡雄性ApoE(-/-)小鼠50只(體重18~22 g)購自北京生命科學研究所,動物許可證號:SYXK(京)2015-0002。高脂肪食物(含15%脂肪、0.15%膽固醇)由北京生命科學研究所提供。紅景天苷(純度>98%)購自中國藥品生物制品檢定所,批號:111575-200502。
1.2 動物分組及處理 隨機選取10只小鼠作為正常飲食組(ND組),接受標準飲食。另外40只小鼠接受高脂飲食(小鼠食物中含15%脂肪、0.15%膽固醇),持續8周。造模完成后,將高脂飲食小鼠隨機分成4組,每組10只:模型組(HFD組)、低劑量紅景天苷處理組(L-SAL組)、高劑量紅景天苷處理組(H-SAL)、AMPK激活劑組(AC組)。
根據參考文獻[5]進行紅景天苷劑量選擇。L-SAL組和H-SAL組分別灌服紅景天苷30、50 mg/kg,1次/d,連續給藥8周。根據參考文獻[6],AC組腹腔注射AMPK激活劑A-769662(可直接使AMPK磷酸化) 30 mg/kg,1次/d,連續給藥8周。ND組和HFD組給予等體積蒸餾水。
1.3 血糖和血清脂質分析 紅景天苷治療8周后,采用葡萄糖監測儀(Life Scan,加拿大)測量小鼠空腹血糖(FBG)水平。禁食12 h后,取小鼠尾靜脈血2 mL,4 ℃ 3 500 r/min離心20 min,分離血清,-80 ℃儲存。采用脂肪酸和脂質代謝試劑盒(美國Sigma-aldrich)測量血清總膽固醇(TC)、HDL-c、LDL-c和三酰甘油(TG)。
1.4 ApoE(-/-)小鼠主動脈內皮性舒張功能測定 紅景天苷治療8周后,每組隨機選取4只小鼠進行內皮依賴性舒張功能測定。小鼠注射60 mg/kg戊巴比妥鈉麻醉后,經腹部除毛、消毒后,剪開腹腔暴露臟器,經后腔靜脈放血處死,于體視顯微鏡下取主動脈血管鞘及周圍結締組織,浸泡于Krebs液中,剪成若干段長約4 mm的主動脈血管環。將每只小鼠各取3段血管環連接至JH-2張力換能器,采用BL-420S生物信號采集系統記錄血管張力變化作為基礎值。將血管環置于HV-4離體恒溫器官灌流系統的浴槽中,通入含5% CO2的O2,給予血管環0.5 g張力負荷,待血管環張力平衡后,加入10-6mmol/L去甲腎上腺素溶液進行預刺激,平衡后,依次加入10-9~10-4mmol/L氯化乙酰膽堿(ACh),記錄每一濃度下血管環張力變化,取3個血管環的平均張力,內皮依賴性舒張度=[(最大張力-各濃度點張力)/(最大張力-基礎值)] ×100%。經37 ℃ Krebs液灌洗2次后,換為濃度為10-9~10-4mmol/L硝普鈉(SNP)刺激血管環,非內皮依賴性血管舒張度=(SNP誘發的血管環張力-加入ACh后的張力)/SNP誘發的血管環張力×100%。
1.5 標本采集 實驗結束后,剩余小鼠禁食12 h后,處死。取小鼠主動脈根部組織,一部分組織置于-80 ℃保存,用于蛋白免疫印跡檢測。另一部分組織于4%多聚甲醛中固定,行蘇丹Ⅳ染色,或經常規脫水、石蠟包埋后,行HE染色、Masson染色、免疫組織化學分析。
1.6 ApoE(-/-)小鼠動脈粥樣硬化病變分析 取經4%多聚甲醛固定的組織,用蘇丹Ⅳ染色以確定病變面積。由Sony 3-CCD攝像機采集圖像,并使用ImagePro圖像分析軟件(Media Cybernatic Inc.,美國)進行分析。以病變(紅色)覆蓋的總主動脈表面積的百分比表示動脈粥樣硬化病變形成的程度。取石蠟包埋組織,用切片機(Microtome International,德國)連續切片(4 μm),經蘇木精-伊紅(HE)染色和Masson染色,于顯微鏡下觀察。使用Image-Pro 圖像分析軟件進行分析。
1.7 免疫組織化學分析 石蠟包埋組織連續切片(4 μm)后,經脫蠟、干燥后,于常溫下保存,行抗p-AMPKα(Thr172)、抗p-PI3K、抗p-Akt、抗p-eNOS(Ser1177)免疫組織化學染色。DAB顯色試劑盒購自上海基因科技有限公司,抗p-AMPKα(Thr172)、抗p-PI3K、抗p-Akt、抗p-eNOS(Ser1177)單克隆抗體購自Cell Signaling Technology。免疫組織化學陽性細胞計算方法如下:在光學顯微鏡下隨機選擇3個海馬區域視野(放大倍數×400),拍攝數字圖像并進行染色,根據視野內的平均光密度值(MOD)進行計算。
1.8 蛋白免疫印跡分析 使用補充有PMSF(Riche)的RIPA蛋白提取試劑(Beyotime)從組織中提取蛋白質。4 ℃下12 000 r/min離心10 min,10% SDS-PAGE分離上清液,將分離的蛋白質轉移到硝酸纖維素膜(Sigma)上。將膜在PBS和5%脫脂乳中封閉1 h,并用抗p-AMPKα (Thr172)、抗AMPKα、抗p-PI3K、抗p-Akt、抗Akt、抗p-eNOS (Ser1177)、抗eNOS和內部對照GAPDH (Cell Signaling Technology)的特異性一抗與膜于4 ℃孵育過夜。將膜用HRP綴合的二抗(Cell Signaling Technology)在室溫下孵育1 h。使用增強的化學發光檢測試劑(Thermo Scientific,Waltham,MA)定量免疫復合物的量。使用Quantity One軟件(Life Technologies)評估相對蛋白表達水平。
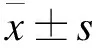
2 結果
2.1 紅景天苷對ApoE(-/-)小鼠血脂及血糖的影響 四組小鼠FBG、HDL-c、TG水平差異均無統計學意義(P>0.05)。HFD組、L-SAL組、H-SAL組小鼠TC、LDL-c水平高于ND組(P<0.05)。AC組、L-SAL組、H-SAL組小鼠TC、LDL-c水平與HFD組比較差異均無統計學意義(P>0.05),見表1。
2.2 紅景天苷對ApoE(-/-)小鼠動脈粥樣硬化的影響
2.2.1 蘇丹Ⅳ染色 應用蘇丹Ⅳ染色評估紅景天苷對ApoE(-/-)小鼠主動脈病變程度的影響。與ND組相比,HFD組小鼠主動脈根部組織經蘇丹Ⅳ染色為紅色;與HFD組相比,AC組、L-SAL組和H-SAL組小鼠主動脈根部蘇丹Ⅳ染色為紅色區域的面積減少。以病變覆蓋總主動脈表面積的百分比表示動脈粥樣硬化病變形成的程度,與HFD組相比,AC組、L-SAL組和H-SAL組小鼠病變區面積均顯著降低,且H-SAL組顯著低于L-SAL組,差異均有統計學意義(P<0.05)。H-SAL組與AC組差異無統計學意義(P>0.05),見圖1。

圖1 ApoE(-/-)小鼠主動脈根部病變面積(n=6)
注:*與ND組比較,P<0.05;#與HFD組比較,P<0.05;Δ與AC組比較,P<0.05;&與L-SAL組比較,P<0.05

表1 紅景天苷對ApoE(-/-)小鼠血脂及血糖的影響
注:與ND組相比,*P<0.05
2.2.2 HE染色 應用HE染色評估紅景天苷對ApoE(-/-)小鼠動脈粥樣硬化斑塊的影響。與ND組相比,HFD組小鼠HE染色可見主動脈根部內膜出現凸向管腔的粥樣硬化斑塊,管腔面積減少,斑塊明顯增加;與HFD組小鼠相比,AC組、L-SAL組和H-SAL組主動脈根部斑塊明顯減少。以動脈粥樣硬化斑塊占主動脈瓣面積的百分比表明動脈粥樣硬化斑塊面積,與HFD組相比,AC組、L-SAL組和H-SAL組小鼠斑塊面積均縮小,且H-SAL組顯著低于L-SAL組(P<0.05)。H-SAL組與AC組差異無統計學意義(P>0.05),見圖2。

圖2 ApoE(-/-)小鼠主動脈根部斑塊面積(n=6)
注:*與ND組比較,P<0.05;#與HFD組比較,P<0.05;Δ與AC組比較,P<0.05;&與L-SAL組比較,P<0.05
2.2.3 Masson染色 應用Masson染色評估紅景天苷對ApoE(-/-)小鼠動脈粥樣硬化斑塊內膠原的影響。與ND組比較,HFD小鼠主動脈根部病變部位Masson染色顯示,膠原藍色染色明顯減少;與HFD組小鼠比較,AC組、L-SAL組、H-SAL組小鼠斑塊內膠原藍色染色明顯增加。以藍色陽性染色面積百分比表明斑塊內膠原含量,與HFD組相比,AC組、L-SAL組、H-SAL組小鼠膠原含量顯著增加,且H-SAL組顯著高于L-SAL組,差異均有統計學意義(P<0.05)。H-SAL組與AC組差異無統計學意義(P>0.05),見圖3。

圖3 ApoE(-/-)小鼠主動脈根部斑塊內膠原含量 (n=6)
注:*與ND組比較,P<0.05;#與HFD組比較,P<0.05;Δ與AC組比較,P<0.05;&與L-SAL組比較,P<0.05
2.3 紅景天苷對ApoE(-/-)小鼠主動脈血管內皮依賴性舒張功能的影響 與ND組比較,HFD組小鼠主動脈血管內皮依賴性舒張功能顯著降低(P<0.05);與HFD組比較,AC組、L-SAL組、H-SAL組小鼠內皮依賴性舒張功能均顯著增加(P<0.05);H-SAL組與AC組比較差異無統計學意義(P>0.05)。五組小鼠間非內皮依賴性舒張功能差異無統計學意義(P>0.05),見圖4。
2.4 紅景天苷對ApoE(-/-)小鼠主動脈中p-AMPKα、p-PI3K、p-Akt、p-eNOS蛋白表達的影響 各組組織中均顯示p-AMPKα、p-PI3K、p-Akt、p-eNOS蛋白陽性表達。與ND組相比,HFD組p-AMPKα(Thr172)、p-PI3K、p-Akt、p-eNOS(Ser1177)MOD值均顯著降低,差異均有統計學意義(P<0.05)。與HFD組相比,AC組、L-SAL組、H-SAL組p-AMPKα(Thr172)、p-PI3K、p-Akt、p-eNOS(Ser1177)MOD值顯著增加,差異均有統計學意義(P<0.05)。H-SAL組與AC組差異無統計學意義(P>0.05),見圖5。

圖4 ApoE(-/-)小鼠主動脈血管內皮依賴性舒張功能(n=4)
注:A.內皮依賴性舒張功能測定,B.非內皮依賴性舒張功能測定。*與ND組比較,P<0.05;#與HFD組比較,P<0.05;Δ與AC組比較,P<0.05;&與L-SAL組比較,P<0.05

圖5 ApoE(-/-)小鼠主動脈中p-AMPKα、p-PI3K、p-Akt、p-eNOS蛋白表達(n=6)
2.5 紅景天苷對ApoE(-/-)小鼠主動脈中AMPK/PI3K/Akt/eNOS信號轉導途徑的影響 與ND組比較,HFD組p-AMPKα(Thr172)、p-PI3K、p-Akt、p-eNOS(Ser1177)蛋白表達顯著降低,差異均有統計學意義(P<0.05)。與HFD組比較,AC組、L-SAL組和H-SAL組p-AMPKα(Thr172)、p-PI3K、p-Akt、p-eNOS(Ser1177)蛋白表達顯著增加,差異均有統計學意義(P<0.05)。H-SAL組與AC組差異無統計學意義(P>0.05),見圖6。

圖6 ApoE(-/-)小鼠主動脈AMPK、PI3K、Akt、eNOS磷酸化水平檢測(n=6)
3 討論
ApoE(-/-)小鼠是常用的研究動脈粥樣硬化發生機制的動物模型。本研究選用8周齡雄性ApoE(-/-)小鼠,通過高脂飲食構建動脈粥樣硬化模型,結果顯示,與正常飲食小鼠相比,HFD組小鼠表現出動脈粥樣硬化病變,主動脈根部內膜出現凸向管腔的粥樣硬化斑塊,且斑塊內膠原明顯減少,表明造模成功。
藥理學研究證實,紅景天苷對心血管系統、神經系統具有良好的保護作用,且具有抗氧化應激、抗炎、免疫調節等多種藥理活性[7]。國內有關研究表明,紅景天苷可以降低低密度脂蛋白受體缺陷小鼠的動脈粥樣硬化斑塊形成[8]。本研究發現,紅景天苷能夠改善高脂肪飲食ApoE(-/-)小鼠動脈粥樣硬化病變情況,使主動脈根部的粥樣硬化斑塊減少,且增加斑塊內膠原含量,提示紅景天苷對高脂飲食誘導的動脈粥樣硬化有一定的治療作用。然而,紅景天苷對ApoE(-/-)小鼠動脈粥樣硬化治療作用的相關機制尚不明確。
血管內皮損傷及功能紊亂是動脈粥樣硬化發生發展過程的關鍵影響因素之一,主要表現為一氧化氮(NO)合成減少。NO在內皮生物學中起重要作用,參與多種內皮功能調節,包括血管舒張、細胞增殖、衰老和凋亡等[9]。本研究通過測定內皮依賴性舒張功能來評估內皮功能,結果發現,ND組和HFD組小鼠非內皮依賴性舒張功能差異無統計學意義,而內皮依賴性舒張功能差異有統計學意義,證實血管舒張反應差異是由內皮功能異常引起的。HFD組小鼠內皮依賴性舒張功能顯著下降,然而,經紅景天苷處理后,小鼠內皮依賴性舒張功能顯著改善,提示紅景天苷可能通過保護血管內皮功能來改善ApoE(-/-)小鼠動脈粥樣硬化。
內皮一氧化氮合酶(eNOS)是合成NO的關鍵酶,其活化能夠促進內皮細胞分泌NO,NO進一步發揮舒張血管效應,從而對抗內皮功能失調。eNOS活性受eNOS-Ser1177和eNOS-Thr495磷酸化的影響[10]。腺苷-磷酸蛋白激酶(AMPK)是由α、β、γ亞基組成的異源三聚體絲氨酸/蘇氨酸激酶,其級聯活化能夠增加細胞在應激狀態下的保護作用[11]。已證實,在營養過度和肥胖模型中,AMPK信號通路的失調能夠導致代謝紊亂,并促進內皮功能障礙的發展[12]。在心血管系統中,AMPK活化能夠使eNOS Ser1177位點磷酸化,磷酸化的eNOS進一步與熱休克蛋白(HSP)-90結合,增加eNOS含量,使NO釋放增加,從而改善內皮功能[13-14]。有研究發現,在培養的內皮細胞中,AMPK激活通過Akt-eNOS和/或PI3K/Akt/eNOS刺激eNOS Ser1177位點磷酸化,促進NO產生[15]。上述研究表明,AMPK及其下游級聯PI3K-Akt-eNOS在內皮功能中起重要調控作用。近年研究表明,高脂肪飲食能夠減少內皮AMPK磷酸化,導致內皮功能障礙相關的PI3K-Akt-eNOS通路的下調[16]。本研究發現,HFD組ApoE(-/-)小鼠p-AMPKα(Thr172)、p-Akt、p-PI3Kα-110、p-eNOS(Ser1177)蛋白表達水平均顯著降低,提示動脈硬化小鼠中AMPK/PI3K/Akt/eNOS信號級聯的抑制。既往研究發現,紅景天苷通過激活eNOS來緩解同型半胱氨酸誘導的內皮功能障礙[17]。與此一致,本研究發現,紅景天苷能夠活化Ser1177位點,增加eNOS的磷酸化。另外,本研究發現,紅景天苷能夠激活AMPKα(Thr172)、Akt、PI3Kα-110蛋白的磷酸化,且與AMPK激活劑A-769662作用效果一致。提示紅景天苷能夠促使動脈硬化小鼠中AMPK/PI3K/Akt/eNOS信號級聯的激活。結合相關研究結果,推測紅景天苷使動脈硬化ApoE(-/-)小鼠內皮AMPKα-Thr172的磷酸化水平增加,其下游級聯的PI3K/Akt信號通路被激活,使eNOS(Ser1177)磷酸化水平增加,促進NO釋放,從而緩解血管內皮功能障礙,改善ApoE(-/-)小鼠動脈粥樣硬化病變。
血脂異常與血管內皮損傷往往并存,也是引起動脈粥樣硬化的主要原因之一[18],血清TC和LDL-c升高是動脈硬化的危險因素之一[19-20]。本研究發現,HFD組小鼠血清TC和LDL-c水平顯著增加,提示血脂異常可能參與高脂飲食誘導的ApoE(-/-)小鼠動脈粥樣硬化過程。紅景天苷處理雖然改善了小鼠動脈粥樣硬化,然而對動脈粥樣硬化ApoE(-/-)小鼠血清TC和LDL-c水平無明顯影響,表明紅景天苷對ApoE(-/-)小鼠動脈粥樣硬化的影響與血脂水平的改變無明顯關系。
綜上所述,紅景天苷能夠通過激活AMPK/PI3K/Akt/eNOS信號級聯,改善與eNOS活化相關的血管內皮功能,從而減輕ApoE(-/-)小鼠動脈粥樣硬化病變。
參考文獻:
[1] 王麗.PPAR-γ激動劑PIO對ApoE(-/-)小鼠血管內皮細胞損傷及動脈粥樣硬化的保護作用[D] .揚州大學,2016.
[2] 陳洪娜,李軍,王福文.非血脂因素致血管內皮損傷時黏附分子變化的研究進展[J] .中國動脈硬化雜志,2017,25(3):314-320.
[3] Qian EW,Ge DT,Kong SK.Salidroside protects human erythrocytes against hydrogen peroxide-induced apoptosis[J] .J Nat Prod,2012,75(4):531-537.
[4] Zhang BC,Li WM,Guo R,et al.Salidroside decreases atherosclerotic plaque formation in low-density lipoprotein receptor-deficient mice[J] .Evid Based Complement Alternat Med,2012,2012:607508.
[5] 張立平,鄭曦,馬雙陶,等.紅景天苷對低壓低氧誘導的ApoE-/-小鼠動脈粥樣硬化斑塊穩定性的影響[J] .臨床心血管病雜志,2014,30(10):881-884.
[6] 吳柯佳,代潔,張力.AMPK激活劑減輕TNF-α誘導的爆發性肝損傷[J] .基因組學與應用生物學,2017,36(4):1396-1402.
[7] 張明發,沈雅琴.紅景天苷心臟保護藥理作用的研究進展[J] .藥物評價研究,2017,40(1):125-132.
[8] 張立平,馬雙陶,楊大春,等.紅景天苷對低壓低氧誘導的ApoE(-/-)小鼠動脈粥樣硬化斑塊及MMP-2、MMP-9和TIMP-2表達的影響[J] .中華中醫藥雜志,2015,30(6):2043-2046.
[9] 黃琛,錢海凌,李麗.中醫藥保護動脈粥樣硬化血管內皮功能研究進展[J] .中西醫結合心腦血管病雜志,2013,11(1):69-71.
[10] Raij L.Nitric oxide in the pathogenesis of cardiac disease[J] .J Clin Hypertens (Greenwich),2006,8(12 Suppl 4):30-39.
[11] 李曉丹.腺苷酸活化蛋白激酶的核苷酸變構調節機制的研究[D] .中國科學技術大學,2014.
[12] Ruderman N,Prentki M.AMP kinase and malonyl-CoA:targets for therapy of the metabolic syndrome[J] .Nat Rev Drug Discov,2004,3(4):340-351.
[13] Chen Z,Peng IC,Sun W,et al.AMP-activated protein kinase functionally phosphorylates endothelial nitric oxide synthase Ser633[J] .Circ Res,2009,104(4):496-505.
[14] Horman S,Vertommen D,Heath R,et al.Insulin antagonizes ischemia-induced Thr172 phosphorylation of AMP-activated protein kinase alpha-subunits in heart via hierarchical phosphorylation of Ser485/491[J] .J Biol Chem,2006,281(9):5335-5340.
[15] Morrow VA,Foufelle F,Connell JM,et al.Direct activation of AMP-activated protein kinase stimulates nitric-oxide synthesis in human aortic endothelial cells[J] .J Biol Chem,2003,278(34):31629-31639.

[17] Leung SB,Zhang H,Lau CW,et al.Salidroside improves homocysteine-induced endothelial dysfunction by reducing oxidative stress[J] .Evid Based Complement Alternat Med,2013,2013:679635.
[18] 謝宇光,石雪穎,于曉玲.血脂異常與血管內皮細胞損傷對動脈粥樣硬化形成的協同作用[J] .中國心血管病研究雜志,2006,4(6):478-480.
[19] 陳曉芳.冠心病患者血中同型半胱氨酸血脂及D-二聚體的實驗分析[J] .山西醫藥雜志,2015,44(9):1072-1073.
[20] 殷瑛,任杰,趙興勝.高血壓與血脂異常對亞臨床動脈粥樣硬化病變影響的研究進展[J] .醫學綜述,2009,15(7):1060-1062.

