miR-135b對LZST1表達及肺癌細胞轉移行為的影響
杜芝洋,杜發旺
目前,肺癌是呼吸系統中最常見的惡性腫瘤,是醫療保險人群中排名前五的高花費腫瘤,在臨床上主要通過手術或全身化療和放療進行治療[1]。在免疫功能低下的老年肺癌患者中,更容易出現較高的轉移風險[2]。目前,轉移性肺癌的治療效果很不理想,化療效果也差強人意[3]。據相關報道,晚期轉移肺癌的5年生存率不超過10%[4]。因此,目前需要研究參與肺癌侵襲和轉移的分子靶標,以及晚期轉移性肺癌新的治療策略。
miRNA是一種小的非編碼RNA分子,可以通過結合靶mRNA的3'端非翻譯區來抑制翻譯或誘導mRNA切割[5-6]。然而,關于肺癌中miRNA表達的臨床轉化成果較少[7-8]。有相關肺癌組織的miRNA芯片分析顯示,肺癌組織中有9種miRNA的表達發生明顯變化,其中miR-135b的表達在肺癌組織和配對正常組織中變化最大(上調8.5倍)[9]。并且miR-135b與腫瘤的生長、生存期、運動性和侵襲性有密切的關聯[10],在多種其他腫瘤(乳腺癌、肺癌、結腸癌和前列腺)組織中存在明顯表達差異[11-14]。在不同組織來源的惡性腫瘤中,miR-135b表現的致癌性或抑癌性,具有一定的組織特異性[15]。在頭頸部,miR-135b通過激活低氧誘導因子-1α來刺激癌細胞增殖,集落形成和血管生成,可能發揮腫瘤啟動子的作用[16]。亮氨酸拉鏈腫瘤抑制基因1(LZTS1)被描述為促腫瘤基因[17]。功能研究表明,LZTS1的一個或兩個等位基因的過表達可以導致小鼠自發性腫瘤發生,并且重新導入LZTS1抑制因子可以抑制裸鼠體內的致瘤性[18]。本研究為了探討miR-135b對LZTS1在肺癌組織中表達的影響,及其對肺癌A549細胞遷移和侵襲行為的影響,為肺癌發生和進展的機制研究提供理論參考。
1 材料與方法
1.1組織標本、細胞株和試劑 在本醫院獲得肺癌患者書面知情同意后,采集肺癌組織和癌旁正常組織樣本,石蠟包埋相關組織用于免疫組織化學研究。本研究獲得醫院審查委員會的批準。人類肺癌A549細胞購自復旦大學細胞培養中心,在37℃下5% CO2培養箱中進行細胞培養。RPMI 1640細胞培養基購自美國Gibco公司,胎牛血清購自杭州四季青生物材料研究所,Transwell侵襲小室購自美國Corning,Matrigel基質膠購自美國BD公司,脂質體Lipofectamine 2000購自Santa Cruz公司。LZST1一抗購自美國Abcam公司。HOTAIR+siRNA和miR-135b-mimic購自上海吉瑪生物科技有限公司。Trizol購自美國Ambion公司,逆轉錄試劑盒(FSQ-101)購自日本TOYOBO公司,PCR試劑盒購自美國Sigma公司。熒光素酶活性檢測試劑盒購自Promega公司。熒光素酶報告載體由Promega公司合成。
1.2PCR分析 使用mirVana miRNA分離試劑盒從肺癌組織和癌旁正常組織中分離總RNA。使用Nano-2000分光光度計測定RNA濃度和純度。miR-135b引物序列:正向5'-GGCGTGAGGCTTGAGGGCT-3',反向5'-GGCGTAGGCGATTGGGGATCG-3'。LZST1引物序列:正向5'-ATTTAAGGAGCGGATTTAGC-3',反向5'-TTTTCGAGTCGAAACACACT-3'。以總RNA為模板,逆轉錄cDNA,反應條件按照cDNA合成試劑盒使用說明進行設置,反應條件:95℃預變性10 min、95℃變性15 s、60℃退火32 s,循環50次后檢測其溶解曲線,檢測完成后,通過計算機系統自動分析各樣本Ct值,采用RQ=2-ΔΔCt計算miRNA的相對表達量。實驗重復3次。
1.3慢病毒轉染 根據慢病毒轉染說明的方案,使用10 nmol的miR-135b-inhibitor和miR-135b-mimic模擬物轉染肺癌A549細胞,分為miR-135b-inhibitor組和miR-135b-mimic組;使用相應的NC模擬物進行陰性對照。使用高容量RNA-to-cDNA試劑盒和Power SYBR GreenMasterMix對轉染細胞中的miR-135b mRNA表達進行qRT-PCR分析。用于miR-135b基因的PCR擴增的引物如下:正向5'-ACCTCTAGAAACCCAGAACTCA-3',反向5'-TCCAGAAGAGCCCATATCACTA-3'。使用U6作為內參照:正向5'-GCGCCCAATACGACCAA-3',反向5'-CTCTCTGCTCCTCCTGTTC-3'。使用熱循環儀通過qRT-PCR擴增基因轉錄物。條件如下:在50℃下UNG溫育2 min和95℃下聚合酶活化10 min,然后95℃ 15 s和60℃ 1 min,進行45個循環。通過計算機系統自動分析各樣本Ct值,采用RQ=2-ΔΔCt計算miRNA的相對表達量。實驗重復3次。
1.4Western blotting蛋白質印跡分析 用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離細胞總蛋白,并將其轉移到硝酸纖維素膜。使用5%脫脂牛奶充分封閉膜,并與一抗(LZST1濃度1∶1500),內參GAPDH(濃度1∶2000),4℃下孵育過夜。次日,TBST充分沖洗過后,使用二抗辣根過氧化物酶標記物(濃度1∶2000)孵育2 h,TBST充分沖洗過后,使用化學發光試劑ECL顯影液檢測目標蛋白的表達水平。實驗重復3次。
1.5劃痕愈合實驗 將轉染細胞和對照組細胞培養至對數生長期。使用200 μl無菌移液器尖端以標準方式將單層細胞劃傷創建無細胞區域。將培養基吸出并用新鮮的完全培養基代替,然后將細胞在37℃孵育48 h。48 h后記錄并拍照細胞的遷移情況。在每個實驗條件下以5個隨機間隔測量遷移角化細胞之間的遷移殘余間隙,以實際遷移距離與原始擦傷寬度的百分比作為比較數據。
1.6Transwell侵襲實驗 使用24孔板進行細胞侵襲測定。將轉染細胞和對照組細胞培養至對數生長期,重新懸浮在無血清培養基中并以每孔1×104個細胞的密度加入到上室中,底室含有10%胎牛血清和正常濃度生長因子的培養基。培養24 h后,通過抽吸基質膠去除上部孔中的細胞并用棉簽擦拭膜的頂部。使用差異快速染色試劑將膜下側的細胞固定,進行染色。在光學顯微鏡下計數細胞侵襲數目,每個膜觀察5個顯微鏡視野。實驗重復3次。
1.7免疫組織化學檢測 將6 μm厚組織切片在10%中性福爾馬林中固定10 min,然后用PBS洗滌2次。在室溫下用1%牛血清白蛋白封閉載玻片1 h,然后用1∶200稀釋度的LZTS1兔多克隆抗體在室溫下孵育1 h。以相同稀釋度的正常兔IgG作為陰性對照。吸出一抗并在PBS中洗滌2次后,用親和純化的驢抗兔IgG以1∶1000的稀釋度孵育LZTS1 30 min。然后洗滌載玻片并用DAPI以1∶1000的稀釋度染色1 min。使用95%乙醇固定細胞2 min后在顯微鏡下分析LZTS1染色強度。
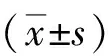
2 結果
2.1miR-135b和LZST1的表達情況 肺癌組織和癌旁正常組織中miR-135b表達水平分別為4.15±0.76和1.28±0.29,LZST1表達水平分別為6.58±0.89和1.93±0.21。肺癌組織中miR-135b和LZST1表達水平明顯高于癌旁正常組織(P<0.05)。免疫組化結果顯示,LZST1蛋白在肺癌組織中表達陽性,在癌旁正常組織中表達陰性。表明miR-135b和LZST1在肺癌中扮演一定的促癌作用。
2.2miR-135b對肺癌A549細胞LZST1蛋白表達的影響 miR-135b-inhibitor組、miR-135b-mimic組和陰性對照組的LZST1蛋白表達水平分別為1.03±0.29、4.03±1.02和1.86±0.76。miR-135b-mimic組的LZST1蛋白表達水平高于miR-135b-inhibitor組和陰性對照組,且陰性對照組高于miR-135b-inhibitor組(P<0.05)。結果表明過表達miR-135b后LZST1蛋白的表達上調,抑制miR-135b表達后LZST1蛋白的表達下調。見圖1。

圖1miR-135b對肺癌A549細胞LZST1蛋白表達的影響
A.miR-135b-mimic組和陰性對照組;B.miR-135b-inhibitor組和陰性對照組;LZST1為亮氨酸拉鏈腫瘤抑制基因1
2.3miR-135b對肺癌A549細胞遷移能力的影響 miR-135b-inhibitor組、miR-135b-mimic組和陰性對照組的實際遷移距離百分比分別為(9.8±1.9)%、(82.8±9.3)%和(33.6±4.2)%。miR-135b-mimic組的實際遷移距離百分比高于miR-135b-inhibitor組和陰性對照組,且陰性對照組高于miR-135b-inhibitor組(P<0.05)。結果表明過表達miR-135b后肺癌A549細胞的遷移能力增強,抑制miR-135b表達后肺癌A549細胞的遷移能力減弱。見圖2。

圖2miR-135b對肺癌A549細胞遷移能力的影響
2.4miR-135b對肺癌A549細胞侵襲能力的影響 miR-135b-inhibitor組、miR-135b-mimic組和陰性對照組侵襲至膜下的細胞數目分別為42.6±5.1、342.1±21.9和101.3±7.6。miR-135b-mimic組侵襲至膜下的細胞數目高于miR-135b-inhibitor組和陰性對照組,且陰性對照組高于miR-135b-inhibitor組(P<0.05)。結果表明過表達miR-135b后肺癌A549細胞的侵襲能力增強,抑制miR-135b表達后肺癌A549細胞的侵襲能力減弱。見圖3。

圖3miR-135b對肺癌A549細胞侵襲能力的影響(×40)
A.miR-135b-mimic組和陰性對照組;B.miR-135b-inhibitor組和陰性對照組
3 討論
最近的研究表明,部分miRNA不僅對促進實體器官腫瘤的生成以及轉移瘤的發展具有一定的調控作用,而且對腫瘤的進展和轉移也可能發揮重要作用[19]。全基因組測序研究表明肺癌的基因表達譜存在巨大差異,從而引起其他的分子發展機制,如影響肺癌患者的基因表達及miRNA改變[20]。
miR-135b與多種類型惡性腫瘤的進展有關[21]。本研究發現,miR-135b在肺癌組織中表達水平高于癌旁正常組織,同時可以調控下游LZST1蛋白的表達,過表達和抑制miR-135b后,LZST1蛋白水平也相應上調和下調,推測腫瘤基因LZTS1可能是miR-135b的直接靶基因[22]。進而推測miR-135b可能通過靶向調控LZTS1表達水平,而調控肺癌細胞的遷移和侵襲行為。有學者研究指出,miR-135b不直接參與肺癌A549增殖行為的直接調控,表明miR-135b是通過調控LZTS1腫瘤基因發揮功能的啟動子。miR-135b表達從正常到息肉再到惡性組織的遞增表明miR-135b失調是一種早期癌變因素,隨著細胞分化異常逐漸表達增強[23]。因此,本實驗研究的數據表明miR-135b可能通過調節腫瘤因子(如LZTS1等)干擾肺癌的進展過程。
最近研究證明,LZTS1為miR-135b的靶基因,并且影響多種腫瘤的生長,運動性和侵襲性[24]。然而,LZTS1在肺癌進展過程中的作用以及與miR-135b表達的關系未被明確探討。LZTS1是miR-135b在肺癌中的腫瘤調控基因之一,但miR-135b/LZTS1軸在肺癌中的關系及其功能尚不清楚。本實驗發現,在癌旁正常肺組織中LZTS1表達普遍較低,而在肺癌組織中LZTS1表達明顯上調。這與先前報道的其他多種腫瘤類型(如乳腺癌和腎癌)中LZTS1表達降低相符合[25]。進而本研究還在蛋白水平上發現LZTS1蛋白表達水平與miR-135b表達成正相關。證明過表達miR-135b可以增加LZTS1蛋白的表達,導致肺癌細胞的遷移和侵襲能力增強。
還有研究顯示,人類腫瘤基因通常作為細胞周期的調節劑起作用,通過上調miR-135b直接影響LZTS1蛋白的表達可導致腫瘤細胞M期細胞周期機制的阻斷,導致遺傳變化的積累,引起遺傳不穩定性和細胞非整倍性的出現[26]。相關研究發現,通過敲除小鼠體內的LZTS1基因會發展出各種腫瘤,表明非整倍體表型可以驅動體內細胞惡性轉化[27]。馬瑞宏等[28]研究表明,抑制miR-135b不影響體外肺癌細胞的增殖能力,說明在影響惡性細胞遷移和侵襲功能的同時miR-135b的丟失不會直接干擾腫瘤生長。
綜上所述,miR-135b/LZTS1信號軸在肺癌進展中起重要調控作用,并且miR-135b可能作為臨床肺癌生物治療的有效靶點,后續實驗需要進一步研究miR-135b的作用機制,以逐步開發肺癌及肺癌轉移瘤的新治療方式。
[參考文獻]
[1] Shi Y, Au J S, Thongprasert S,etal. A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER)[J].J thorac Oncol, 2014,9(2):154-162.
[2] Raaschou-Nielsen O, Andersen Z J, Beelen R,etal. Air pollution and lung cancer incidence in 17 European cohorts: prospective analyses from the European Study of Cohorts for Air Pollution Effects (ESCAPE)[J].Lancet Oncol, 2013,14(9):813-822.
[3] Malvezzi M, Bertuccio P, Rosso T,etal. European cancer mortality predictions for the year 2015: does lung cancer have the highest death rate in EU women?[J].Ann Oncol, 2015,26(4):779-786.
[4] Argirion I, Weinstein S J, Mannisto S,etal. Serum insulin, glucose, indices of insulin resistance, and risk of lung cancer[J].Cancer Epidemiol Biomarkers Prev, 2017,26(10):1519-1524.
[5] Kasinski A L, Kelnar K, Stahlhut C,etal. A combinatorial microRNA therapeutics approach to suppressing non-small cell lung cancer[J].Oncogene, 2015,34(27):3547-3555.
[6] Sozzi G, Boeri M, Rossi M,etal. Clinical utility of a plasma-based miRNA signature classifier within computed tomography lung cancer screening: a correlative MILD trial study[J].J Clin Oncol, 2014,32(8):768-773.
[7] Peng Y, Dai Y, Hitchcock C,etal. Insulin growth factor signaling is regulated by microRNA-486, an underexpressed microRNA in lung cancer[J].Proc Natl Acad Sci U S A, 2013,110(37):15043-15048.
[8] Liu Z L, Wang H, Liu J,etal. MicroRNA-21 (miR-21) expression promotes growth, metastasis, and chemo-or radioresistance in non-small cell lung cancer cells by targeting PTEN[J].Mol Cell Biochem, 2013,372(1-2):35-45.
[9] Su W, Mo Y, Wu F,etal. miR-135b reverses chemoresistance of non-small cell lung cancer cells by downregulation of FZD1[J].Biomed Pharmacother, 2016,84:123-129.
[10] Nezu Y, Hagiwara K, Yamamoto Y,etal. miR-135b, a key regulator of malignancy, is linked to poor prognosis in human myxoid liposarcoma[J].Oncogene, 2016,35(48):6177-6188.
[11] Hua K, Jin J, Zhao J,etal. miR-135b, upregulated in breast cancer, promotes cell growth and disrupts the cell cycle by regulating LATS2[J].Int J Oncol, 2016,48(5):1997-2006.
[12] Valeri N, Braconi C, Gasparini P,etal. microRNA-135b promotes cancer progression acting as a downstream effector of oncogenic pathways in colon cancer[J].Cancer Cell, 2014,25(4):469-483.
[13] Xiao S, Yang Z, Lv R,etal. miR-135b contributes to the radioresistance by targeting GSK3β in human glioblastoma multiforme cells[J].PloS one, 2014,9(9):e108810.
[14] Aakula A, Leivonen S K, Hintsanen P,etal. MicroRNA-135b regulates ERα, AR and HIF1AN and affects breast and prostate cancer cell growth[J].Mol Oncol, 2015,9(7):1287-1300.
[15] Adai A, Szafransak-Schwarzbach A, Andruss B,etal. Methods and compositions involving miR-135b for distinguishing pancreatic cancer from benign pancreatic disease: U.S. Patent 9,644,241[P].2017-5-9.
[16] Umezu T, Tadokoro H, Azuma K,etal. Exosomal miR-135b shed from hypoxic multiple myeloma cells enhances angiogenesis by targeting factor-inhibiting HIF-1[J].Blood, 2014,124(25):3748-3757.
[17] Lovat F, Ishii H, Schiappacassi M,etal. LZTS1 downregulation confers paclitaxel resistance and is associated with worse prognosis in breast cancer[J].Oncotarget, 2014,5(4):970-977.
[18] Xu Z, Wang T. miR-214 promotes the proliferation and invasion of osteosarcoma cells through direct suppression of LZTS1[J].Biochem Biophys Res Commun, 2014,449(2):190-195.
[19] George S, Chaudhery V, Lu M,etal. Sensitive detection of protein and miRNA cancer biomarkers using silicon-based photonic crystals and a resonance coupling laser scanning platform[J].Lab Chip, 2013,13(20):4053-4064.
[20] Frampton G M, Fichtenholtz A, Otto G A,etal. Development and validation of a clinical cancer genomic profiling test based on massively parallel DNA sequencing[J].Nat biotechnol, 2013,31(11):1023-1031.
[21] Beltran H, Yelensky R, Frampton G M,etal. Targeted next-generation sequencing of advanced prostate cancer identifies potential therapeutic targets and disease heterogeneity[J].Eur Urol, 2013,63(5):920-926.
[22] Mori M, Triboulet R, Mohseni M,etal. Hippo signaling regulates microprocessor and links cell-density-dependent miRNA biogenesis to cancer[J].Cell, 2014,156(5):893-906.
[23] Pei H, Jin Z, Chen S,etal. MiR-135b promotes proliferation and invasion of osteosarcoma cells via targeting FOXO1[J].Mol Cell Biochem, 2015,400(1-2):245-252.
[24] Olasz E B, Seline L N, Schock A M,etal. MicroRNA-135b regulates leucine zipper tumor suppressor 1 in cutaneous squamous cell carcinoma[J].PLoS One, 2015,10(5):e0125412.
[25] Lovat F, Ishii H, Schiappacassi M,etal. LZTS1 downregulation confers paclitaxel resistance and is associated with worse prognosis in breast cancer[J].Oncotarget, 2014,5(4):970-977.
[26] Zhou W, He M R, Jiao H L,etal. The tumor-suppressor gene LZTS1 suppresses colorectal cancer proliferation through inhibition of the AKT-mTOR signaling pathway[J].Cancer Lett, 2015,360(1):68-75.
[27] He Y, Liu X. The tumor-suppressor gene LZTS1 suppresses hepatocellular carcinoma proliferation by impairing PI3K/Akt pathway[J].Biomed Pharmacother, 2015,76:141-146.
[28] 馬瑞宏,黃穎秋,劉彩剛.FEZ1/LZTS1基因與原發性肝癌相關性研究[J].海南醫學院學報,2013,19(2):148-151.

