循環腫瘤細胞檢測對結直腸癌患者根治術后異時性肝轉移的預測價值分析
張振毫
結直腸癌異時性肝轉移是患者行根治術原發性病灶切除6個月后出現的肝轉移,已成為嚴重影響結直腸癌根治術患者生活質量和預后效果的公共衛生問題[1-2]。故研究導致異時性肝轉移發生的相關因素,并予以積極對癥處理是改善結直腸癌根治術后患者預后的關鍵措施[3]。近年來有研究顯示,循環腫瘤細胞(CTC)是惡性腫瘤術后復發和轉移的重要因素[4]。且有相關研究證實,CTC與肝癌患者術后大血管侵犯等有著密不可分的關系,但其與根治術后結直腸癌患者預后的相關性尚未明確報道[5-6]。本文對80例行根治術治療結直腸癌患者的臨床資料進行回顧性分析,目的在于研究CTC檢測對結直腸癌患者根治術后異時性肝轉移的預測價值,具體報告如下。
1 資料與方法
1.1一般資料 選取2013年1月—2016年1月我院收治的80例結直腸癌患者納入研究,其中男42例,女38例;年齡28~85(58.64±9.26)歲;病程2~6(3.64±1.20)年;原發病灶:結腸32例,直腸48例。①納入標準:均符合2007年世界衛生組織關于結直腸癌的明確診斷標準[7];所有原發病灶均為結直腸癌;均在腹腔鏡下行腫瘤根治切除術治療且術后經病理學檢查確診;本研究經醫院倫理委員會批準同意;患者及家屬均知情同意并簽署知情同意書。②排除標準:存在肝腎功能異常以及心、腦和血液系統等疾病患者;存在其他系統惡性腫瘤患者;臨床資料不完整者。
1.2研究方法 回顧性分析所有患者的臨床資料,并記錄患者的性別、年齡、CTC表達、異時性肝轉移發生率以及其他臨床病理資料。根據CTC檢測情況將患者分為CTC陽性組22例和CTC陰性組58例。①CTC檢測方法:所有患者檢測當天清晨于空腹狀態下抽取靜脈血液5 ml,置于含有EDTA的抗凝管中,通過FicollPaque PLUS分離液將該標本進行密度梯度離心;離心后按照試劑盒說明書以磁性標記的抗CD45單克隆抗體提取表達CD45的白細胞將CTC聚集,聚集后通過離心涂片機收集細胞,并在多聚賴氨酸玻片上制成細胞涂片。將載玻片與針對人去唾液酸糖蛋白受體(ASGPR)、氨甲酰磷酸合成酶1(CPS1)小鼠單克隆抗體和大鼠抗人CD45單克隆抗體的混合物共孵育,再用兔抗小鼠-Alexa Fluor647 IgG、兔抗大鼠-Alexa Fluor 488作為二抗孵育,隨后用DAPI染色。通過熒光顯微鏡(IX71,Olympus)評估染色的載玻片,調整檢測器靈敏度和曝光時間從標本捕獲陽性染色圖像。體積比較大、細胞核染呈陽性表達(藍色)、CPS1和ASGPR呈陽性表達(紅色)且CD45呈陰性表達(黃色未染)的細胞即為CTC[8]。②手術方法:所有患者全身麻醉成功后分別在臍兩旁10 cm處切口為操作孔,并在腹直肌外緣5 cm處開口作為操作輔助切口。常規建立氣腹后,于腹腔鏡下切斷腸系膜動脈,游離結腸系膜,最后在腫瘤下2 cm左右切斷直腸,然后使用吻合器進行結腸-直腸端吻合,最后縫合切口。
1.3觀察指標 記錄患者的性別、年齡、原發病灶腫瘤大小、腫瘤部位、腫瘤浸潤深度、腫瘤分化程度、淋巴結轉移情況及異時性肝轉移發生情況等相關臨床資料,并比較不同CTC表達患者間上述資料的差異,分析CTC與結直腸癌患者臨床病理特征的關系以及導致異時性肝轉移發生的相關影響因素。
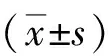
2 結果
2.1兩組不同CTC表達患者的相關臨床特征比較 兩組的腫瘤浸潤深度、腫瘤分化程度、淋巴結轉移、腫瘤大小以及異時性肝轉移發生率比較差異具有統計學意義(P<0.05)。兩組的性別、年齡和腫瘤部位比較差異無統計學意義(P>0.05)。見表1。

表1 兩組不同CTC表達結直腸癌患者的相關臨床特征比較(例)
注:CTC為循環腫瘤細胞
2.2CTC表達與臨床病理特征的關系 通過Spearman等級相關分析可知,CTC陽性表達與腫瘤浸潤深度、腫瘤大小和淋巴結轉移率均呈正相關(r=0.326、0.294和0.426,P=0.024、0.028和0.002),與腫瘤分化程度呈負相關(r=-0.386,P=0.018)。
2.3單因素分析 有無異時性肝轉移患者的腫瘤浸潤深度、腫瘤分化程度、淋巴結轉移、腫瘤大小以及CTC表達比較差異均有統計學意義(P<0.01)。見表2。

表2 影響結直腸癌患者根治術后異時性肝轉移的單因素分析(例)
注:CTC為循環腫瘤細胞
2.4多因素分析 非條件多因素Logistic回歸模型分析結果顯示,腫瘤浸潤較深、出現淋巴結轉移、低分化、腫瘤≥5 cm以及CTC陽性表達均為導致結直腸癌患者根治術后異時性肝轉移的獨立危險因素(P<0.05)。見表3。
3 討論
近年來,結直腸癌的發病率呈逐漸上升趨勢。但根據以往臨床資料可知,根治手術是治療結直腸癌首選的治療手段[9-10]。但隨著病例資料的增多,相關研究數據顯示,仍有部分患者手術治療失敗,而常見原因為復發和轉移,其中近35%的結直腸癌患者行根治術后出現異時性肝轉移[11-12]。而結直腸癌根治術后異時性肝轉移患者的生活質量較低、生存時間較短,嚴重影響預后效果,是一個值得臨床上重視的問題[13-14]。
肝臟是結直腸癌患者根治術后腫瘤轉移的主要器官,其主要發生機制尚未完全闡述清楚。但有資料報道,血行微轉移在直腸癌患者行根治術后出現異時性肝轉移的過程中扮演著極為重要的角色[15-16]。本組研究結果顯示,不同CTC表達結直腸癌患者的腫瘤浸潤深度、腫瘤分化程度、淋巴結轉移、腫瘤大小以及異時性肝轉移發生率比較均存在差異;且通過Spearman等級相關分析可得,且CTC陽性表達與腫瘤浸潤深度、腫瘤大小及淋巴結轉移率均呈正相關,與腫瘤分化程度呈負相關。由此可提示,CTC的表達與結直腸癌患者的臨床病理特征和預后有著密不可分的關系。結合以往文獻報道和臨床資料可知,在腫瘤患者的原發病灶切除之前,CTC從原發腫瘤病灶上脫落后進入血液,而血液中的相關趨化因子對CTC具有一定的作用,可將其重新送回至腫瘤原發部位和轉移部位,從而造成腫瘤的復發和轉移,而CTC陽性表達率越高,則異時性肝轉移發生率越高[17-20]。

表3 影響結直腸癌患者根治術后異時性肝轉移的多因素分析
注:CTC為循環腫瘤細胞
另一方面,本研究結果顯示,不同腫瘤浸潤深度、分化程度、淋巴結轉移、腫瘤大小以及CTC表達的結直腸癌患者術后異時性肝轉移發生率均存在差異性。提示腫瘤病灶本身發展情況以及CTC的表達均為導致結直腸癌患者根治術后異時性肝轉移的可能因素。曾有研究證實,結直腸癌患者原發病灶腫瘤細胞衍生的相關細胞因子或經其他刺激反應產生的相關炎性因子對細胞黏附因子具有一定的上調作用,進一步加大CTC通過血液黏附于其他器官,而肝臟的血供最為豐富,故CTC黏附于肝臟的可能性最大[21]。而當CTC黏附于肝臟后,血小板及相關組織因子和免疫細胞可共同作用促進CTC細胞簇的生成,從而導致血管癌栓的產生,進一步加大肝轉移的可能性[22-23]。除此之外,本組數據還經非條件多因素Logistic回歸模型分析進一步證實,腫瘤浸潤較深、出現淋巴結轉移、低分化、腫瘤≥5 cm以及CTC陽性表達均為導致結直腸癌患者根治術后異時性肝轉移的獨立危險因素。CTC陽性表達率越高,表明CTC在機體內的含量越多,腫瘤細胞生長越快[24]。而腫瘤浸潤越深,分化程度越低以及腫瘤越大時,表明腫瘤進展更快,病情更為嚴重。當出現淋巴結轉移時,表明患者腫瘤細胞侵襲其他組織器官的可能性越大,從而導致預后更差。
綜上所述,CTC陽性表達與結直腸癌患者的相關臨床病理特征有相關性,且與腫瘤浸潤較深、出現淋巴結轉移、低分化和腫瘤過大均為導致結直腸癌患者根治術后異時性肝轉移的獨立危險因素,故臨床上可將CTC的檢測作為評估結直腸癌患者根治術后異時性肝轉移的有效方法。但CTC的表達是否受外界因素的影響本研究還未明確,故可加大樣本含量和延長研究時間進一步深入研究。
[參考文獻]
[1] Buim M E, Fanelli M F, Souza V S,etal. Detection of KRAS mutations in circulating tumor cells from patients with metastatic colorectal cancer[J].Cancer Biol Ther, 2015,16(9):1289-1295.
[2] 蘇月穎,張新偉.結直腸癌異時性肝轉移治療療效及預后因素分析[J].中華腫瘤防治雜志,2015,22(5):378-381.
[3] 劉少平,胡亞華,張海,等.外周血T淋巴瘤侵襲轉移誘導因子1 mRNA定量檢測與結直腸癌肝轉移的關系及其預測價值[J].臨床消化病雜志,2016,28(5):273-277.
[4] 李延東,姜訓忠,耿正偉,等.聯合檢測血清CEA、AFP、CA19-9對結直腸癌的診斷價值[J].解放軍醫藥雜志,2015,27(5):53-55.
[5] 許揚梅,劉巧珍,劉沁穎,等.流式細胞術檢測結直腸癌根治術前后循環腫瘤細胞和循環腫瘤干細胞及其臨床預測價值[J].中國腫瘤生物治療雜志,2017,24(4):355-361.
[6] 劉少平,聶磊,胡亞華,等.外周血和門靜脈血人端粒酶反轉錄酶mRNA的定量檢測與結直腸癌肝轉移及預后的關系[J].中華消化雜志,2015,35(4):225-230.
[7] 羅金鋒,馮龍.結直腸癌肝轉移的微波消融治療進展[J].重慶醫學,2017,46(23):3299-3302.
[8] 姚月娟,荊結線.結直腸癌循環腫瘤細胞檢測的臨床價值[J].腫瘤研究與臨床,2017,29(1):11-14.
[9] 姚蒙潔,李浩,徐建,等.直腸癌異時性肺轉移的危險因素及治療分析[J].中國現代普通外科進展,2015,18(3):206-209.
[10] 王林娜,張清泉,侯素平,等.RegⅣ、EGFR和survivin在結直腸癌組織中的表達及臨床意義[J].解放軍醫藥雜志,2016,28(6):45-48.
[11] 白潔,劉興華,蔡明,等.腹腔鏡異時性結直腸癌根治術的臨床療效[J].中華普通外科雜志,2017,32(1):9-11.
[12] Friedell G H. Identification of breast cancer patients with high risk of early recurrence after radical mastectomy.Ⅱ. Clinical and pathological correlations[J].Cancer, 2015,42(6):2809-2826.
[13] 梁立,劉天舒.結直腸癌肝轉移危險及預后因素分析[J].中國實用外科雜志,2016,36(4):383-386.
[14] 龍滌,張森.結直腸癌同時性肝轉移的手術時機選擇[J].結直腸肛門外科,2017,23(1):117-121,106.
[15] 喬天宇,徐永鵬,關旭,等.結直腸癌肝轉移的治療及預后因素分析[J].中華胃腸外科雜志,2015,18(9):930-934.
[16] 姚宏偉,張忠濤.結直腸癌肝轉移的規范化診斷和治療[J].中華胃腸外科雜志,2017,20(7):753-757.
[17] 何偉,元云飛.結直腸癌肝轉移的手術治療相關問題[J].中華胃腸外科雜志,2015,18(10):990-993.
[18] 閆志輝,崔立紅,浦江,等.結直腸癌及腸道腺瘤性息肉患者腸道菌群失調情況及相關危險因素分析[J].解放軍醫藥雜志,2017,29(5):25-29.
[19] 范柯,范賢東.M1分期細化對結直腸癌遠處轉移患者預后的影響[J].實用癌癥雜志,2015,30(8):1209-1211.
[20] Kolostova K, Matkowski R, Gürlich R,etal. Detection and cultivation of circulating tumor cells in gastric cancer[J].Cytotechnology, 2016,68(4):1095-1102.
[21] 趙日升,汪挺.全結腸系膜切除術與傳統結腸癌手術后無病生存率的比較[J].中華胃腸外科雜志,2015,18(6):572.
[22] 汪宇,李錫鋒,張小峰,等.術前外周血循環腫瘤細胞檢測對原發性肝細胞肝癌微血管侵犯的預測價值[J].山東醫藥,2017,57(18):33-35.
[23] Lai Y, Chen Y, Wu S,etal. Modified volumetric modulated arc therapy in left sided breast cancer after radical mastectomy with flattening filter free versus flattened beams[J].Medicine, 2016,95(14):e3295.
[24] 張艷紅,段春芳,謝憑.循環腫瘤細胞對結直腸癌預后的相關性研究[J].河北醫藥,2017,39(11):1634-1637.

