MMP-2和RECK蛋白在子宮腺肌病內膜組織中的表達及意義
王慧芳,金海紅,王智文
子宮腺肌病(adenomyosis, AM)是婦科的常見疾病,多發生于育齡期婦女,其基礎的病理改變為子宮內膜腺體和間質細胞向肌層浸潤并彌漫性生長。近年相關研究發現,AM發病年齡日趨年輕化,雖然該疾病屬于良性子宮病變,且激素藥物、血管介入、病灶挖除及電凝等措施為臨床治療提供多種選擇,但療效并不顯著[1]。尤其對有生育要求的患者,難以接受根治性手術。關于AM的發病機理目前尚未明確,但相關文獻表明其發展特性與惡性腫瘤相似,亦可發生種植、浸潤、轉移和復發等病理現象[2-3]。為探究AM的發病機制,本文研究基質金屬蛋白酶-2(matrix metalloproteinase-2, MMP-2)及其抑制物RECK蛋白在AM病理組織中的表達情況,現將結果報告如下。
1 資料與方法
1.1一般資料 選擇我院2015年6月—2017年11月收治的30例AM患者作為觀察對象。①納入標準:所有患者均行全子宮切除手術,并經病理科確診。②排除標準:惡性腫瘤及其他子宮疾病患者;3個月內接受激素類藥物治療者。年齡34~58(38.9±7.6)歲;增生期15例,分泌期15例。并收集所有患者的肌層異位內膜(異位組)和非異位內膜(非異位組)。并選取同期25例子宮肌瘤患者的非瘤區內膜作為對照組,年齡35~57(38.2±9.3)歲;增生期12例,分泌期13例。AM患者和對照組的年齡、子宮內膜處于增生期和分泌期比例比較差異無統計學意義(P>0.05),具有可比性。
1.2方法
1.2.1主要儀器與試劑:石蠟包埋機(BM型,湖北省醫用電子儀器廠),生物組織攤片、烤片機(C9S-Ⅲ型,湖北省醫用電子儀器廠),切片機(HM450型/EC350-2型,德國MICROM),離心機(SIGMA 1-13型,美國),雙目顯微鏡(CKL型,日本OLYMPUS),數碼照相機(NIKON COOLPIX4500型,日本)。鼠抗人MMP-2單克隆抗體(美國NeMarker公司),兔抗人RECK單克隆抗體(SANTA CRUA公司),U1traSensitiveTmS-P超敏試劑和DAB顯色試劑盒(福州邁新生物技術開發有限公司)。
1.2.2檢測方法:采用免疫組織化學SP法對各組標本病理組織切片的MMP-2和RECK進行測定。經兩位病理科醫師確診,顯微鏡下觀察各組染色情況,并記錄MMP-2和RECK染色強度。具體步驟為病理組織經10%中性福爾馬林固定、常規石蠟包埋制成4 μm的連續切片;60℃恒溫箱內烘烤1 h,并逐級脫蠟,水化,PBS液沖洗;RECK采用微波修復抗原,MMP-2采用高溫高壓修復抗原;后經中和非特異性反應,除去多余血清,滴加工作液,滴加鏈霉素抗生物素-過氧化酶溶液,室溫下孵育30 min(RECK)或10 min(MMP-2),PBS液沖洗5 min,連續3次,DAB底物顯色,蘇木素復染切片,梯度乙醇脫水,二甲苯透明2次,各15 min,中性樹膠封片,顯微鏡下觀察。
1.2.3結果觀察:設定陽性對照和陰性對照。RECK與MMP-2均為細胞質著色,顯示為淺黃色至棕黃色的顆粒。隨機計數10個高倍視野,陰性為陽性細胞百分率<10%、弱陽性為10%~50%、陽性為50%~75%、強陽性為>75%。參照H-score組織化學評分方法進行評分,并以陽性強度和陽性細胞百分比積分乘積計算RECK和MMP-2蛋白表達積分。
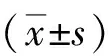
2 結果
2.1MMP-2和RECK陽性表達率情況 異位組MMP-2陽性表達率明顯高于對照組(P<0.05)。非異位組MMP-2陽性表達率與對照組和異位組比較差異均無統計學意義(P>0.05)。異位組RECK陽性表達率低于非異位組和對照組(P<0.05),但非異位組與對照組比較差異無統計學意義(P>0.05)。見表1。

表1 3組不同子宮內膜組織MMP-2和RECK陽性表達率情況[例(%)]
注:異位組為肌層異位內膜,非異位組為非異位內膜,對照組為子宮肌瘤患者的非瘤區內膜;MMP-2為基質金屬蛋白酶-2;與對照組比較,aP<0.05;與非異位組比較,cP<0.05
2.2MMP-2和RECK蛋白表達積分比較 異位組MMP-2蛋白表達積分高于非異位組和對照組,且非異位組高于對照組(P<0.05)。異位組RECK蛋白表達積分低于非異位組和對照組(P<0.05),但非異位組與對照組比較差異無統計學意義(P>0.05)。見表2。3組MMP-2和RECK蛋白表達情況,見圖1。

表2 3組不同子宮內膜組織MMP-2和RECK蛋白表達積分情況分)
注:異位組為肌層異位內膜,非異位組為非異位內膜,對照組為子宮肌瘤患者的非瘤區內膜;MMP-2為基質金屬蛋白酶-2;與對照組比較,aP<0.05;與非異位組比較,cP<0.05
3 討論
AM主要表現為痛經、經期延長和不孕等,對婦女的身心健康造成極大損傷[4]。雖然AM發病機制并不確切,但多數學者認為其影響因素包括免疫、血管生成、細胞凋亡、細胞轉移及侵襲、激素及遺傳等,其中細胞轉移與侵襲過程與細胞外基質(ECM)成分在周圍微環境的降解和重構有關[5-7]。
AM病理特征是子宮內膜腺體和間質向肌層生長,其生長過程復雜,研究顯示AM的病理改變與ECM的降解關系密切,主要體現為含ECM成分平滑肌束組成的子宮肌層能夠阻止子宮內膜的侵入作用[8]。MMPs在ECM降解過程中起關鍵性作用,可以降解ECM的所有成分[9-11]。相關文獻報道,MMP-2能夠降解子宮肌層中的Ⅳ型膠原[12-14],其過度表達可增強內膜侵襲力,從而降解異位內膜周圍的肌層,甚至基底膜的ECM成分,造成AM[15]。本文結果顯示,與對照組比較,異位組MMP-2陽性表達率以及蛋白表達積分明顯升高,證實上述相關研究,顯示MMP-2在AM內膜組織的異常表達與惡性腫瘤具有相似的生物學行為。

圖13組不同子宮內膜組織MMP-2和RECK蛋白的表達情況(SP ×400)異位組為肌層異位內膜,非異位組為非異位內膜,對照組為子宮肌瘤患者的非瘤區內膜;MMP-2為基質金屬蛋白酶-2
RECK在胚胎發育分化過程中起重要作用,可影響胚胎毛細血管形成、神經肌肉系統的發育、骨與軟骨系統發育及神經肌肉連接組織的發育分化等[16-17]。RECK是MMPs抑制劑,能夠抑制多種MMPs表達,如MMP-2、MMP-7及MT1-MMP等。多項研究顯示,RECK與惡性腫瘤的發生相關,包括肺癌、肝細胞癌、膀胱移行細胞癌、頭頸部鱗狀細胞癌等,可抑制在惡性腫瘤中高表達的MMPs,從而減弱腫瘤細胞的侵襲和轉移能力[18-19]。鑒于RECK可抑制MMP-2的表達,本研究檢測不同內膜組織中RECK蛋白的表達,結果顯示異位組RECK陽性表達率及蛋白表達積分低于非異位組和對照組,證明AM異位內膜組織中RECK蛋白表達缺失,使得MMPs進一步降解ECM,降低細胞間黏附力,造成子宮內膜異位[20]。
綜上所述,MMP-2和RECK蛋白的異常表達可能在AM發病程中發揮重要作用。MMP-2的異常表達與RECK蛋白的表達缺失可能與AM患者子宮內膜細胞“異位”到肌層有關,但引起兩者異常表達的具體原因尚需進一步探究。
[參考文獻]
[1] Takenaka K, Ishikawa S, Kawano Y,etal. Expression of a novel matrix metalloproteinase regulator, RECK, and its clinical significance in resected non-small cell lung cancer[J].Eur J Cancer, 2004,40(10):1617-1623.
[2] 王晗,董旭,葛常輝.基質金屬蛋白酶在生殖中的作用與調控[J].國外醫學計劃生育分冊,2002,21(3):141-144.
[3] Oh J, Takahashi R, Kondo S,etal. The membrane-anchored MMP inhibitor RECK is a key regulator of extracellular matrix integrity and angiogenesis[J].Cell, 2001,107(6):789-800.
[4] 宋元梓.腹腔鏡下病灶剔除術聯合左炔諾孕酮宮內緩釋系統治療子宮腺肌病[J].現代儀器與醫療,2016,22(5):125-126.
[5] 郭君紅,鄒麗.調控RECK基因表達對早孕絨毛外滋養細胞MMP-2活化及細胞侵襲力的影響[J].華中科技大學學報,2007,36(4):495-499.
[6] 楊堯華,周新艷,王嵐,等.子宮腺肌病診斷及治療的研究新進展[J].中國婦幼保健,2010,25(27):3992-3995.
[7] 楊釗.胃癌血管生成擬態的初步研究[D].衡陽:南華大學,2011:253.
[8] 王巖巖,黃立,王艷華,等.腹腔鏡下病灶切除術聯合醋酸亮丙瑞林緩釋微球治療子宮腺肌病臨床分析[J].中國綜合臨床,2016,32(4):375-378.
[9] Yu Z, Pestell T G, Lisanti M P,etal. Cancer stem cells[J].Int J Biochem Cell Biol, 2012,44(12):2144-2151.
[10] 劉倩,吳小翎,羅紅春.MMP-2在胃癌組織中的表達及其與微血管生成和淋巴結轉移的關系[J].重慶醫學,2012,41(13):1262-1264,封2.
[11] 王木森,柳雅玲.子宮腺肌病組織中MMP2、MMP7、RECK、TWIST1、CD133表達及MVD變化[J].山東醫藥,2016,56(26):53-55.
[12] 唐利,蔣海霞,李燕,等.MT1-MMP、RECK在子宮腺肌病發病中的作用研究[J].中國婦幼保健,2015,30(36):6583-6585.
[13] 李宗濤,張煒旸,芳華,等.子宮腺肌病的最新治療進展[J].中國婦幼保健,2014,29(27):4524-4526.
[14] 張繼紅,余繁榮,張蓉.子宮腺肌病中HIF-1α與MMP-2的表達及臨床意義[J].中國現代醫生,2013,51(6):63-65.
[15] 崔靜,李輝,田艷勛.RECK基因甲基化與喉鱗狀細胞癌預后的關系[J].醫學研究生學報,2014,27(6):615-618.
[16] Huang F, Cao J, Liu Q,etal. MAPK/ERK signal pathway involved expression of COX-2 and VEGF by IL-1β induced in human endometriosis stromal cells in vitro[J].Int J Clin Exp Pathol, 2013,6(10):2129-2136.
[17] Benagiano G, Brosens I, Habiba M. Structural and molecular features of the endomyometrium in endometriosis and adenomyosis[J].Hum Reprod Update, 2014,20(3):386-402.
[18] 陳光朋,付萬壘,楊坤富,等.miR-182調控RECK信號通路在非小細胞肺癌進展中的作用[J].解放軍醫學雜志,2015,40(4):309-314.
[19] 寧士龍,馬宵.腫瘤抑制基因RECK的表觀調控研究進展[J].腫瘤研究與臨床,2016,28(8):565-568.
[20] 賈晨陽,段華,汪沙.血管形成相關因子在子宮腺肌病發病中作用的研究進展[J].中國計劃生育和婦產科,2016,8(8):17-21.

