硬化性肺細胞瘤的CT表現特征分析
賀偉 周新華 李芳 呂巖 周震 李成海 陳步東
硬化性肺細胞瘤(pulmonary sclerosing pneumocytoma, PSP)是肺內少見的良性腫瘤,是一種肺泡來源的腫瘤,由類似于Ⅱ型肺泡細胞的立方形表面細胞和基質圓形細胞的雙分子層表面細胞組成。1980年WHO 將其命名為肺硬化性血管瘤,2015年WHO適時將其歸類為“腺瘤”,重新命名為硬化性肺細胞瘤[1]。手術切除為確診和治療PSP的主要方法,術前準確診斷可避免擴大手術范圍和淋巴結清掃[2]。發現及診斷本病主要依靠影像學檢查,但術前影像誤診率較高[2-4], 可誤診為結核球、錯構瘤、肺癌及曲霉菌病等。本研究收集 2012—2017年經手術病理證實的33例PSP患者的CT資料,結合病理回顧性分析其影像學征象,提高對該病的CT表現特點的認識,為提高早期正確診斷率,提高與結核球等病變的鑒別診斷能力,指導正確的治療方案提供幫助。
資料和方法
一、研究對象
收集2012—2017年在首都醫科大學附屬北京胸科醫院經手術病理證實的33例PSP患者, 女30例(90.9%),男3例(9.1%)。中位年齡54歲,年齡范圍24~84歲,其中40~60歲女性占大多數,有24例(72.7%)。20例(60.6%)患者無明顯癥狀;2例有肩背部疼痛或胸痛,2例胸悶氣短,4例有痰中帶血或咯血,5例有咳嗽、咳痰。
術前CT診斷:4例(12.1%)診斷為惡性病變;29例(87.9%)診斷為良性病變,其中有7例考慮有硬化性肺細胞瘤的可能,5例診斷為錯構瘤,3例診斷為巨淋巴結增生癥,2例診斷為結核球可能性大,12例未能確定為何種良性病變,其中尚有8例考慮不除外惡性病變。
二、檢查方法
使用美國GE LightSpeed 64排VCT儀及64排Optima CT680儀,患者吸氣狀態下常規從肺尖至橫膈水平進行掃描,層厚5 mm,層間距5 mm;螺距1.375∶1,重建視野33 cm,管電壓120 kV,自動管電流(LightSpeed 64層VCT儀80~350 mA或Optima CT680儀100~300 mA),噪聲指數 11.57。所有患者均行CT平掃并重建為層厚1.25 mm的薄層肺窗圖像,采用肺重建算法。其中29例患者行CT增強掃描,使用非離子型對比劑(碘海醇或碘普胺,350 mg I/ml)100 ml, 用高壓注射器以2.5/s~3.0 ml/s的流率靜脈推注后30 s及60 s行動脈期、延時雙期掃描。所有圖像均在圖像存儲與傳輸系統 (PACS)上觀察。
三、CT掃描評價內容
由2位工作10年以上的放射科醫師一起讀片,逐一記錄患者CT掃描所見的病變數目、大小、發病部位、邊緣及形態,以及CT平掃的密度、增強掃描的強化方式和最大強化凈值及伴隨征象,有分歧意見經討論達成共識,以診斷意見一致的結果為標準來判定每例患者的CT表現。患者表現為多發病灶者以最大病灶作為記錄;密度均勻與不均勻的判斷,以不包括鈣化以外的部分判斷;最大強化凈值定義為增強掃描的CT值與平掃CT值的差值;伴隨征象定義如下:“血管貼邊征”為增強掃描時病灶周圍呈現明顯強化的曲線樣血管影或斷面血管影;“空氣新月征”定義為病灶周圍新月形或半月形的無肺紋理區域;“暈征”定義為病灶周圍環形或半環形的磨玻璃樣密度區域;“尾征”定義為病灶邊緣尾狀突起,多位于病灶靠近肺門一側。
四、統計學處理
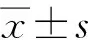
結 果
一、CT平掃表現
1.病灶數目、大小:30例(90.9%)患者為單發病灶(圖1~4), 3例(9.1%)為多發病灶(圖5~8)。所有病灶平均大小(最大長徑)約(2.73±1.32) cm,范圍在0.8~6.5 cm。病灶≤3 cm者有20例(60.6%),>3 cm者有13例(39.4%)。
2.邊緣和形態:30例(90.9%)患者病灶表現為類圓形(圖1~4),3例(9.1%)患者病灶表現為不規則形(圖5)。病灶邊緣光整者有27例(81.8%),邊緣欠規則者有2例(6.1%),病灶可見分葉者有4例(12.1%)。
3.發病部位:按照六分葉,病灶位于右上葉、右中葉、右下葉、左上葉、左上葉舌段、左肺下葉、跨葉者分別有5例(15.2%)、3例(9.1%)、6例(18.2%)、2例(6.1%)、5例(15.2%)、10例(30.3%)、2例(6.1%)。病灶位于雙肺下葉者最多,共計有16例(48.5%);病灶位于近肺門的中心型有11例(33.3%),周圍型有22例(66.7%)(外周胸膜下4例、葉間胸膜附近6例、縱隔胸膜旁7例、肺野中部5例)。
4.平掃密度:平掃密度為(33.72±14.87) HU,范圍在10~62 HU。密度均勻16例(48.5%),不均勻17例(51.5%)。內部見鈣化10例(30.3%)(圖8),囊變5例(15.2%)(圖8)。
5.縱隔及肺門淋巴結腫大:29例(87.9%)患者未見淋巴結腫大;4例(12.1%)患者見淋巴結腫大。
二、CT增強掃描表現
29例患者中,以不均勻強化多見,有19例(65.5%)(圖3,7),均勻強化者有10例(34.5%);動脈期、延時掃描平均CT值分別為(60.4±14.5) HU、(80.9±28.6) HU,最高CT值可達151 HU。病灶明顯強化者(最大強化凈值超過20 HU)有26例(89.7%),平均最大強化凈值為(48.9±26.5) HU。典型病例見圖1~4。
與平掃相比,增強掃描動脈期最大強化凈值>30 HU者有15例(45.5%),<30 HU者有14例(42.4%)。延時掃描26例(78.8%)見持續性強化,且病灶趨于更加均勻(圖4);與平掃相比,延時期最大強化凈值>40 HU者有15例(45.5%)[其中超過60 HU者8例(24.2%)],<40 HU者14例(42.4%),僅3例(9.1%)患者延時掃描未見繼續強化。
將病灶長徑以2 cm、2.5 cm及3 cm為界限,分別比較三組(≤2 cm組與>2 cm組,≤2.5 cm組與>2.5 cm組,≤3 cm組與>3 cm組)病灶平掃密度、CT增強掃描的強化方式、動脈期及延時掃描的最大強化凈值、延時掃描強化的發生率,結果顯示,≤2 cm組及>2 cm組動脈期最大強化凈值比較,差異有統計學意義(表1)。
三、CT掃描發現的伴隨征象
33例平掃患者,PSP尚見一些伴隨征象:見尾征者5例(15.2%)(圖9);見暈征者8例(24.2%);見空氣新月征者5例(15.2%);其中4例(12.1%)為空氣新月征和暈征同時存在(圖10)。而29例行CT增強掃描的患者中,伴隨血管貼邊征21例(72.4%)(圖11);假包膜征1例(3.0%)。
四、CT表現與病理改變對照分析
所有患者的病理結果均符合特征性的2種細胞(圓形細胞與表面細胞)和4種組織結構(乳頭狀結構、出血區、實性區、硬化性結構),30例患者病理改變以2種以上病理組織結構為主,僅3例患者見4種組織結構,所有患者淋巴結均未見受累。其中1例患者同時并發肺內不典型增生。免疫組織化學檢查顯示,圓形細胞表達甲狀腺轉錄因子-1(thyroid transcription factor-1,TTF-1)、上皮膜抗原 (epithelial membrane antigen,EMA)、波形蛋白(vimen-tin),基本不表達肌酸激酶(creatine kinase,CK);表面細胞表達TTF-1、EMA、vimentin和CK。
選取10例患者(動脈期最大強化凈值≥30 HU及<30 HU者各5例)與病理改變行對照分析,動脈期最大強化凈值≥30 HU者主要以出血區(圖12)及乳頭狀區結構為主;<30 HU者病灶較大,病理結構多樣,硬化區及實性區成分較多。
討 論
一、硬化性肺細胞瘤的臨床及CT表現特點
本研究顯示,PSP好發于中老年女性,且年齡在40~60歲;約60.6%的患者無臨床癥狀。這些臨床特點與文獻[2-3,5]報道相似,盡管性別、年齡及患者臨床癥狀的出現率等數據不完全一致,但總趨勢一致。本組中9例患者見咯血、咳嗽等呼吸道癥狀,需要與結核病等其他疾病進行鑒別。PSP病理冰凍切片診斷準確率低,易誤診為腺癌和類癌。因此,肺結節性病變冰凍切片檢查時,應該盡量地進行多部位取材,尤其在腫瘤與肺組織交界處,能看到更多的腫瘤結構,可以減少誤診。借助免疫組織化學檢查,常可確診[6]。盡管被認為是良性腫瘤,但已有少量文獻報道PSP伴胸膜[7]、胃播散[8]和淋巴結轉移[9-10]。PSP可同時伴發其他惡性腫瘤[11],本研究中有1例伴有非典型腺瘤樣增生。
二、硬化性肺細胞瘤的CT表現特點分析
PSP大多數為單發、境界清楚、光整的軟組織密度結節;66.7%的患者為周圍型,其中鄰近胸膜周圍者為51.5%;發病部位最多見于雙肺下葉(48.5%),其次為左肺上葉舌葉及右肺上葉(15.2%),與文獻 [2,11,12]等研究相似。
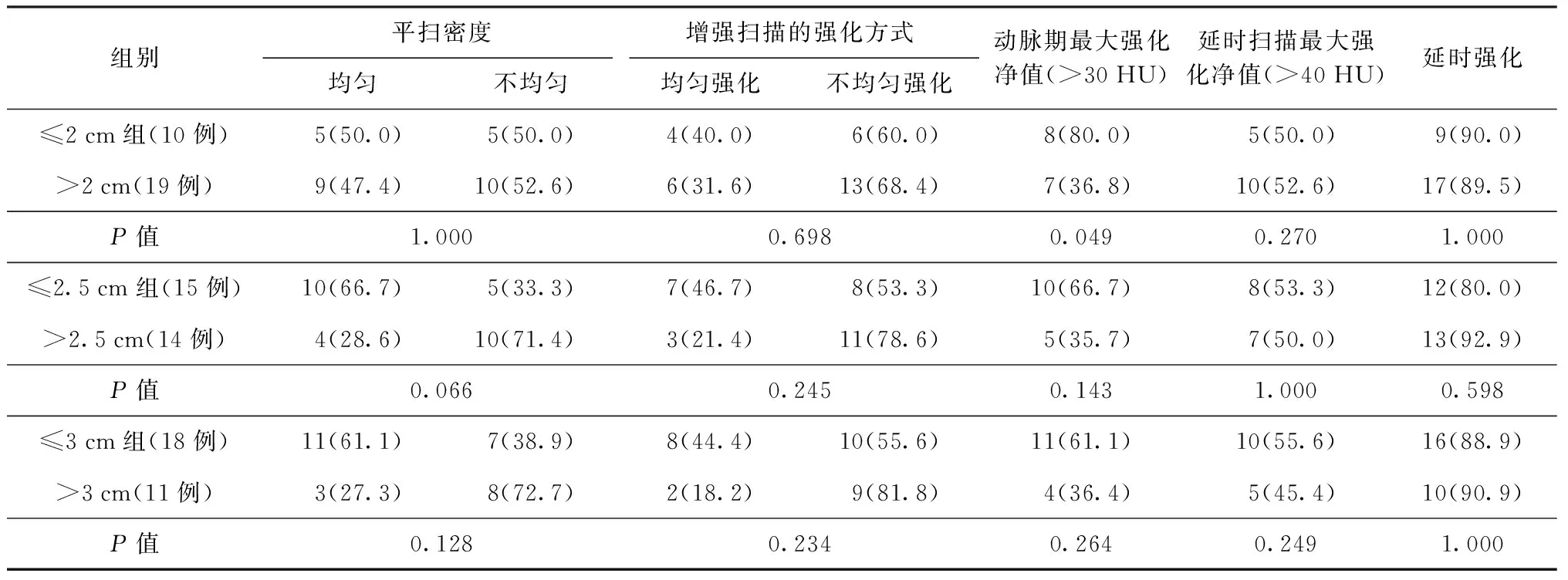
表1 不同病灶長徑組的CT掃描結果分析 [例數(構成比,%)]
注統計學檢驗采用Fisher精確概率法
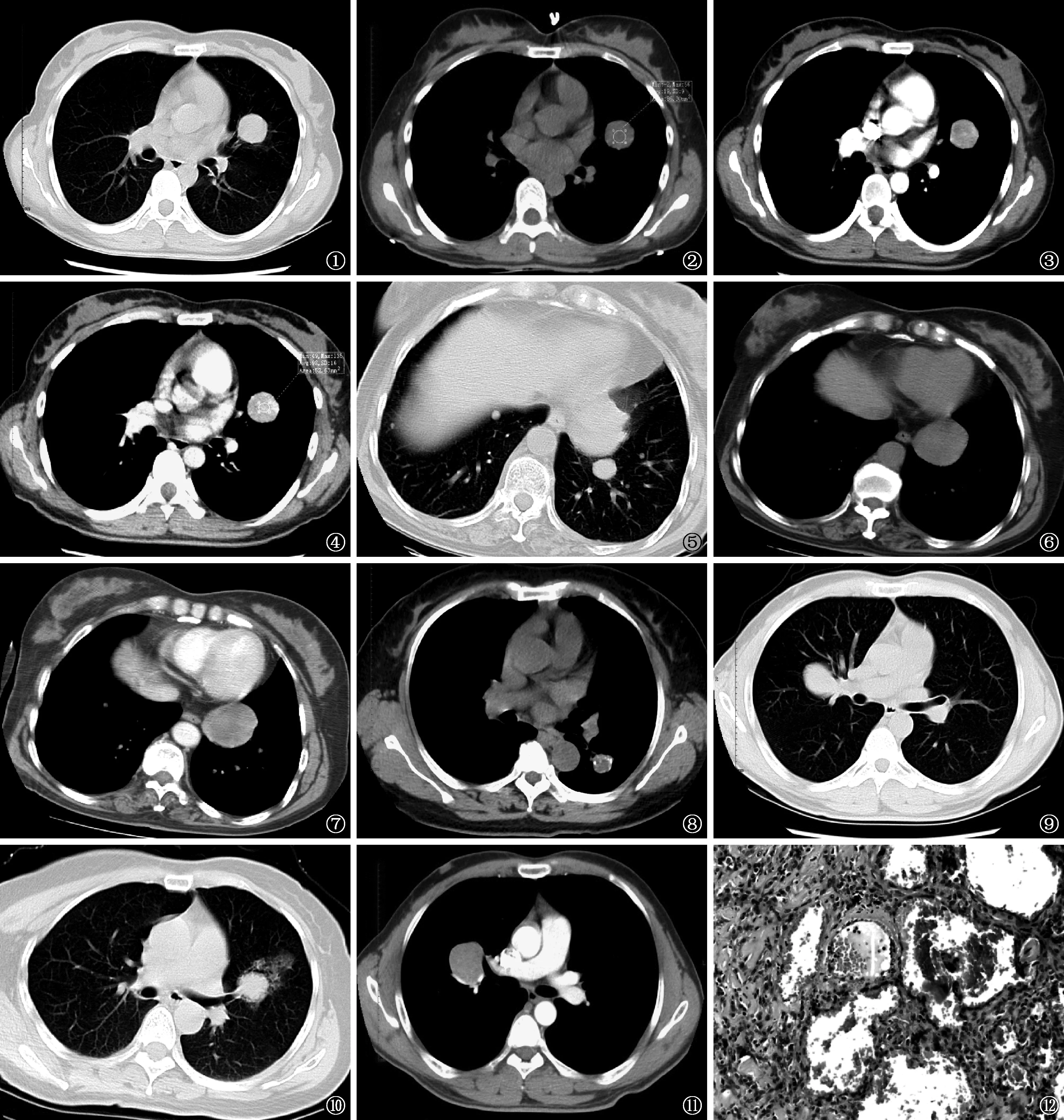
圖1~4 患者,女,53歲。圖1為肺窗,顯示左肺上葉舌段長徑3 cm的類圓形結節,境界清楚,光滑;圖2為縱隔窗,顯示結節平掃密度較均勻,CT值為19 HU;圖3為增強掃描,顯示動脈期病灶明顯強化,密度不均勻,平均CT值為82 HU,動脈期最大強化凈值為63 HU;圖4為延時掃描,顯示病灶呈持續性強化,CT值為93 HU,且病灶密度更加均勻,靜脈期最大強化凈值為74 HU 圖5~7 患者,女,52歲。圖5為肺窗,顯示左肺下葉基底段心緣旁腫塊,大小約5 cm×4 cm,邊緣局部不規則,雙肺尚見多發的、境界清楚較光滑的結節影。圖6為平掃縱隔窗,顯示左下肺腫塊影密度不均勻,平掃CT值約34 HU。圖7為增強掃描動脈期,顯示左下肺腫塊不均勻強化,CT值平均約60 HU,最大強化凈值為26 HU(<30 HU) 圖8 患者,女,38歲。左肺下葉背段結節,境界清楚、欠光滑,內見鈣化及囊變 圖9 患者,男,29歲。肺窗,顯示右肺上葉腫塊影,靠近肺門側見“尾征” 圖10 患者,女,47歲。肺窗,顯示左上肺舌段支氣管遠端見一長徑約2.6 cm的結節影,境界清楚,邊緣欠光滑,病灶外上方見空氣新月征,病灶下方及遠側見磨玻璃樣密度影 圖11 患者,男,29歲。右肺上葉近肺門部見4 cm×3 cm的腫塊影,境界清楚,光滑,增強掃描見“血管貼邊征” 圖12 圖1~4患者的病理切片圖(HE ×40),顯示其病理出血區結構,見腫瘤組織出血,大量紅細胞堆積在殘存肺泡腔內,形成血管瘤樣結構
通過本組患者觀察CT掃描所見病灶的密度及強化特點為:平掃密度不均勻略多于密度均勻者,增強掃描不均勻強化者較均勻強化者常見;顯著強化為增強掃描的特點,與文獻[13-14]報道的結果一致。本組患者CT掃描顯示,明顯強化患者可達89.7%,延時掃描60 s最大強化凈值可大于40 HU甚至超過60 HU,大多數病灶延時掃描呈持續性強化,最高CT值可達151 HU,呈血管樣強化,故延遲強化也是PSP的增強掃描的特點[15]。
有研究顯示,病理組織結構成分的差異可能是病灶CT增強掃描特點差異的原因,PSP的主要結構—出血區(海綿狀血管瘤樣)和乳頭狀區可能是動脈期強化明顯的組織病理學基礎,而實性區及硬化區是可能延時強化和不均勻強化的病理學基礎[14-15]。研究認為長徑<3 cm的病灶多以血管瘤樣及乳頭樣結構為主,動脈期呈較均勻強化,靜脈期少量實性區及硬化區進一步強化可呈漸進性強化。而隨著病灶的增大,實性區及硬化區增多且分布不均,使病灶呈不均勻花斑樣強化;靜脈期時,實性區及硬化區亦逐漸強化,整體強化趨向均勻,呈漸進性強化。表1可以看出,隨著病灶的增大,平掃密度不均勻及增強掃描不均勻強化的發生率越高;無論病灶大小,大多數患者均呈現延時強化,與文獻[14-15]的研究結果相似。但分別比較三組不同大小的患者的強化方式,延時掃描的最大強化凈值、延時強化的發生率,差異均未見統計學意義;不過病灶長徑≤2 cm組動脈期強化凈值大于30 HU者發生率明顯多于>2 cm組,差異有統計學意義(P<0.05),說明以病灶長徑2 cm為界可能是動脈期明顯強化的一個界限值,有待于今后擴大樣本并與病理一一對照分析做進一步研究。
血管貼邊征、尾征、暈征、空氣新月征均是PSP的特異性征象[12-13, 15-16],但發生率各文獻報道有一定差異。本研究顯示,血管貼邊征是最常見的伴隨征象,達72.4%,為PSP良性生長、推擠、壓迫周圍血管所致[11],該征象在中央型PSP較常見,但要注意在其他良性腫瘤亦可見到。而尾征、暈征、空氣新月征的發生率均低于30%,尾征均見于中心型患者,其發生與PSP對肺門血管有生長趨向性有關[17]。“暈征”目前認為為病灶周緣出血有關[15];空氣新月征其病理基礎目前尚有爭議,有文獻認為是支氣管周圍的肺泡間質細胞的增生和透明樣變導致遠端空氣間隙的擴張所致[11]。本研究中尚見4例“暈征”及空氣新月征同時出現,該征象較具特征性[16],但十分少見。上述這些征象對PSP診斷的提示均有重要的意義。
本研究中有3例(9.1%)的患者為多發性病灶,與文獻[12]所報道的多發病灶的發病率基本一致(8.9%),至于多發病灶的產生機理未見相關文獻報道,亦見一些文獻把多發病灶看作是最大病灶的轉移。Shin等[18]報道1例位于右肺中葉的多發簇集樣排列結節周圍伴有磨玻璃樣密度影,該征象較罕見,本研究中未見此表現,筆者認為這種表現亦需要與繼發性肺結核進行鑒別。
三、硬化性肺細胞瘤與良性病變的鑒別診斷
本組患者顯示,盡管多數病灶術前診斷為良性病變(87,9%,29/33),但是正確診斷率不高,完全正確診斷率僅為21.2%(7/33)。根據其CT表現,可誤診為肺結核、錯構瘤、巨淋巴結增生癥、淋巴結結核、肺曲霉菌感染等良性病變。關于PSP與其他疾病的CT鑒別診斷的研究,文獻報道少見。
本組患者顯示,PSP病灶多境界清楚、光滑,最常見部位為下葉,30.3%的患者出現鈣化,與姚紅霞[15]的報道相似,并且可出現囊變(圖8),所以可能誤診為結核瘤和錯構瘤。胡新如和譚利華[19]的研究顯示,該病顯微鏡下鈣化發生率達65%,但CT檢查僅有30%發現鈣化。提示其鈣化并不少見,其鈣化可能是一漸進性過程,CT的鈣化發現率可能與病灶檢出時腫瘤的生長時間、大小等有關。結核球以年輕人多見,是結核分枝桿菌感染所致,臨床癥狀多見咳嗽、發熱及結核中毒癥狀,病灶好發于下葉背段及上葉尖后段,病灶周圍常常伴有衛星灶及索條影,增強掃描及延時掃描多表現為無強化或邊緣強化;而PSP以40~60歲的中年女性多見,是少見的良性腫瘤,多數無呼吸道癥狀而被偶然發現,病灶周圍一般沒有衛星灶,大多數患者CT增強掃描呈顯著強化且見延時強化,兩者有明顯差別。而錯構瘤,除爆米花樣鈣化外,內部出現脂肪亦是其典型特點,其強化程度常常低于PSP,且PSP中囊變的密度高于脂肪密度,強化多較錯構瘤明顯,這是兩者的鑒別點。由此可見,伴有鈣化的、境界清楚光滑的球形結節,除了考慮錯構瘤和結核球以外,PSP也是需要考慮的鑒別診斷。
本組患者中3例PSP表現為肺門部腫塊,由于其明顯強化,密度不均勻,可伴有鈣化及壞死,可能誤診為淋巴結結核及巨淋巴增殖癥。感染癥狀、增強掃描病灶內見大片狀或分房樣無強化的壞死區、較大腫塊且多為多發淋巴結腫大融合而成、境界多模糊、常同時伴有多發的淋巴結腫大、肺內及其他部位的結核,有助于淋巴結結核的診斷;而李多等[20]的研究提示,肺門部的巨淋巴增生癥的影像表現與PSP相似,可伴有斑點狀鈣化,增強掃描強化明顯,可發生于任何年齡,單中心型20歲多見,故兩者的鑒別需要病理學的檢查。正確地認識PSP的CT特點、擴大鑒別診斷的思維是影像科醫師需要做到的。
病灶周圍伴磨玻璃樣密度影及空氣新月征,且可以出現咯血,容易誤診為曲霉菌感染。但曲霉菌感染臨床多伴有呼吸道癥狀,并可見發熱等感染征象,實驗室檢查可能提示為真菌感染,CT掃描結節強化值沒有PSP高,病灶周圍的磨玻璃樣密度影多完全環繞于結節周圍;如果出現曲菌球,可出現空氣新月征,空氣新月征位于病灶內,其內結節不強化;而PSP病灶周圍的磨玻璃樣密度影多位于結節周圍的一側,很少完全環繞于結節周圍,空氣新月征位于病灶外,未見發熱等感染癥狀等能夠幫助鑒別。
綜上所述, PSP好發于40~60歲中年女性,CT上常表現為單發的邊緣規整的周圍型軟組織密度結節,大多數增強掃描表現為明顯強化及延遲強化,多伴有血管貼邊征,患者很少伴有淋巴結腫大,內部可見鈣化,可伴有尾征、暈征、空氣新月征,這些CT表現特征有一定的特異性,對診斷的提示有著重要的意義,并且有助于與結核球等疾病進行鑒別診斷。
[1] Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J Thorac Oncol,2015,10(9):1243-1260.
[2] 馮飛躍,程貴余,高樹庚,等.肺硬化性血管瘤的診斷和手術治療.中華醫學雜志,2012,92(17):1190-1193.
[3] 劉芬,方向軍,曾曄,等.肺硬化性血管瘤MSCT診斷及誤診分析.中國CT和MRI雜志, 2015,13(10):37-39.
[4] 謝冬, 姜格寧, 陳曉峰, 等. 肺硬化性血管瘤165例外科治療. 中華外科雜志, 2012, 50(2): 120-123.
[5] Chen BJ, Gao J, Chen H. Pulmonary sclerosing hemangioma:a unique epithelial neoplasm of the lung(report of 26 cases). World J Sung Oncol, 2013, 11(1): 85.
[6] 張小麗,趙強,馬昕,等.15例硬化性肺細胞瘤冰凍切片與臨床病理特征分析.臨床與病理雜志,2016,36(12):1965-1970.
[7] Suzuki H,Saitoh Y,Koh E.Pulmonary sclerosing hemangioma with pleural dissemination:report of a case.Surg Today,2011,41(2):258-261.
[8] Bae YS,Ro JY,Shim HS,et al.Pulmonary sclerosing haemangioma with metastatic spread to stomach.Histopathology,2012,60(7):1162-1164.
[9] Low SY,Teo F,Eng P,et al.Pulmonary sclerosing hemangioma:pitfalls in management.Asian Cardiovasc Thorac Ann,2011,19(2):139-142.
[10] Soo IX, Sittampalam K, Lim CH. Pulmonary sclerosing pneumocytoma with mediastinal lymph node metastasis. Asian Cardiovasc Thorac Ann,2017,25(7-8):547-549.
[11] Shin SY,Kim MY,Oh SY,et al. Pulmonary sclerosing pneumocytoma of the lung: CT characteristics in a large series of a tertiary referral center.Medicine (Baltimore),2015,94(4):e498.
[12] 梁波,蔡培坤.肺硬化性血管瘤的MSCT特征與病理分析.罕少疾病雜志,2015,22(1):35-38.
[13] 李正軍,董寶明,蔡定萍,等.硬化性肺泡細胞瘤的CT表現與病理對照研究.實用放射學雜志,2016,32(10):1525-1528.
[14] 付東,李興付,陳真平,等.肺硬化型血管瘤CT表現與病理對照.臨床肺科雜志,2016,21(2):338-339,343.
[15] 姚紅霞.硬化性肺泡細胞瘤 MSCT 征象與病理的相關性分析.實用放射學雜志,2017,33(2):206-209.
[16] Baysak A, Oz AT, Mogˇulko? N, et al. A rare tumor of the lung: pulmonary sclerosing hemangioma (pneumocytoma). Respir Med,2013,107(3):448-450.
[17] Nam JE, Ryu YH, Cho SH, et al. Air-trapping zone surrounding sclerosing hemangioma of the lung. J Comput Assist Tomogr,2002,26(3):358-361.
[18] Shin SY, Kim MY, Lee HJ, et al. Clustered pulmonary sclerosing pneumocytoma in a young man: a case report. Clin Imaging,2014,38(4):532-535.
[19] 胡新如,譚利華.肺硬化性血管瘤的CT征象與臨床病理研究.實用醫學影像雜志, 2015, 16(2):114-116.
[20] 李多,薛云龍,呂平欣.胸部單中心型巨淋巴結增生癥3例18F-FDG 符合線路顯像表現及文獻復習.醫學影像學雜志,2015,25(7):1174-1177.

