孟魯司特鈉對ITP模型小鼠T淋巴細胞亞群及晚期氧化蛋白產物的影響①
邢麗娜 任金海 王 穎 王福旭 溫樹鵬 郭玉潔
(河北醫科大學第二醫院血液內科,石家莊 053600)
特發性血小板減少性紫癜(Idiopathic thrombocytopenic purpura,ITP)是臨床上常見的出血性疾病,由毛細血管發生炎癥反應產生病變,屬于自身免疫性疾病[1]。免疫功能紊亂、血小板數量減少為ITP的主要癥狀,臨床上采用孟魯斯特鈉治療[2,3]。晚期氧化蛋白產物(Advanced oxidation protein products,AOPP) 作為一種具有促炎癥活性的物質,能引起巨噬細胞和單核細胞增殖,誘導TNF-α等促炎性細胞因子合成、分泌,促發機體免疫炎癥反應的發生[4]。目前關于孟魯斯特鈉對AOPP相關影響的研究尚未發現,因此本研究主要通過建立ITP模型小鼠,探討孟魯斯特鈉對機體免疫的影響與AOPP的影響,以闡明孟魯斯特鈉治療ITP的機制。
1 材料與方法
1.1材料
1.1.1實驗動物 SPF級BALB/c小鼠,體重18~22 g,雄性,購自南方醫科大學實驗動物中心。
1.1.2試劑 T淋巴細胞亞群試劑盒與CD3-FITC/CD4-APC/CD8-PE熒光素標記的單克隆抗體(北京同生時代生物技術有限公司);IL-6、TNF-α試劑盒(上海康朗生物科技有限公司);AOPP試劑盒(北京西美杰科技有限公司);水為超純水。
1.1.3儀器 酶聯免疫檢測儀(美國寶特公司);流式細胞儀(艾森生物有限公司);離心機(湖南湘鑫儀器儀表有限公司);細胞分析儀(貝克曼庫爾特公司)。
1.2方法
1.2.1ITP模型的建立[5]于造模第1、3、5、7天腹部注射豚鼠抗BALB/c小鼠血小板血清(APS),劑量為200 μl/20 g,建立小鼠 ITP 模型。以小鼠外周血小板降低至正常值25% 視為造模成功。
1.2.2動物分組與給藥 將40只雄性BALB/c小鼠隨機分為4組,分別為對照組、模型組、孟魯司特鈉低劑量組、孟魯司特鈉高劑量組,每組10只。于造模后第8天開始給藥。對照組不作造模處理,灌胃給予等體積生理鹽水;模型組灌胃給予等體積生理鹽水;孟魯司特鈉低劑量組灌胃給予孟魯司特鈉,劑量為3 mg/kg;孟魯司特鈉高劑量組灌胃給予孟魯司特鈉,劑量為12 mg/kg。給藥劑量按成人臨床用量按表面積比等效量計算,給藥體積為20 ml/kg體重,于每日按時給藥1次,連續給藥14 d。
1.2.3胸腺、脾臟指數的測定 各組小鼠于給藥后第15天稱重后,眼眶取血后,處死小鼠,剖開胸腔及腹部,取出胸腺、脾臟,用生理鹽水清洗后,濾紙吸去水分,稱重,分別計算各組小鼠的胸腺指數、脾臟指數,公式如下:胸腺指數=胸腺濕重(mg)/小鼠體重(g);脾臟指數=脾臟濕重(mg)/小鼠體重(g)。
1.2.4外周血小板計數 分別于造模后第8天,給藥后第15天通過尾靜脈取小鼠外周血,采用細胞分析儀進行血小板計數。
1.2.5外周血T淋巴細胞亞群的測定 各組小鼠眼眶取血約0.5 ml,加入肝素100 μl抗凝血,加入PBS緩沖液適量,1 500 r/min離心10 min 后,取上層血漿,然后2 500 r/min離心10 min,沉淀分離細胞,加入PBS緩沖液 0.1 ml制備單細胞懸液,分別加入CD3-FITC、CD4-APC、CD8-PE 2.5 μl于同一上樣管,同時設立不加任何抗體的對照組,放置10 min后,加入5 ml紅細胞溶解液,放置15 min,于2 500 r/min離心20 min,去上清液,加入PBS緩沖液,洗滌細胞2次,固定,采用流式細胞儀檢測CD3+、CD4+、CD8+水平。
1.2.6血清IL-6、TNF-α、AOPP的測定 各組小鼠眼眶取血約0.5 ml,靜置15 min,于離心機2 500 r/min下離心15 min后,分離血清,采用酶聯免疫吸附法檢測IL-6、TNF-α、AOPP水平。于96孔板中,分別加入標準品、樣品稀釋液和待測樣品100 μl,于37℃下放置60 min,洗滌,加入抗小鼠IL-6、TNF-α、AOPP抗體100 μl,37℃ 放置60 min,洗滌,加HRP標記的親和素100 μl,于37℃放置30 min,洗滌,加底物工作液(TMB) 100 μl,37℃避光放置15 min,加終止液100 μl。置于酶標儀在450 nm 波長下測定吸光度(OD值),根據標準曲線計算樣品中小鼠IL-6、TNF-α、AOPP含量。
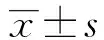
2 結果
2.1孟魯司特鈉對血小板計數的影響 造模后第8天,與對照組小鼠比較,各組小鼠的血小板計數均顯著下降(P<0.05);同一組小鼠給藥后第15天與造模第8天比較,孟魯司特鈉低、高劑量組小鼠的血小板計數顯著升高(P<0.05),且高劑量組小鼠血小板升高程度更明顯;給藥第15天后,與模型組比較,孟魯司特鈉低、高劑量組小鼠血小板計數顯著升高,結果見表1。
2.2孟魯司特鈉對胸腺指數、脾臟指數的影響 與對照組比較,模型組小鼠的胸腺指數、脾臟指數均顯著升高(P<0.05);與模型組比較,孟魯司特鈉低、高劑量組小鼠胸腺指數、脾臟指數顯著降低(P<0.05),結果見表2。
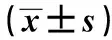


GroupsnPLT(×109 L-1)8 d afterestablish model15 d afterestablish modelControl group10109.40±34.05 114.85±40.28 Model group1032.78±5.981)29.45±6.321) Low dosage group1028.32±6.901) 64.26±15.921)2)3)High dosage group1029.99±5.371)95.30±20.552)3)
Note:PLT.Platelet count.Compared to control group,1)P<0.05;compared to model group,2)P<0.05;compared to 8th day after building ITP model,3)P<0.05.
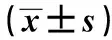


GroupsnCD3+CD4+CD8+CD4+/CD8+Control group1065.64±5.3842.37±5.2722.80±3.871.92±0.22Model group1055.77±4.751)29.86±3.951)31.86±4.861)0.94±0.251)Low dosage group1060.20±7.462)36.22±2.402)25.95±3.042)1.43±0.192)High dosage group1062.84±6.222)39.35±4.172)22.96±4.932)1.71±0.312)
Note:Compared to control group,1)P<0.05;compared to model group,2)P<0.05.
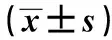


GroupsnIL-6(pg/ml)TNF-α(pg/ml)AOPP(pg/ml)Control group1089.09±13.5785.64±11.0968.93±9.36Model group10136.47±10.741)124.42±13.741) 85.23±12.521)Low dosage group10104.84±16.842)110.20±16.752)73.43±8.392)High dosage group1092.11±15.482)90.53±12.742)65.84±9.822)
Note:Compared to control group,1)P<0.05;compared to model group,2)P<0.05.
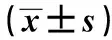


GroupsnThymus index(mg/g)Spleen index(mg/g)Control group101.82±0.633.54±0.90Model group103.21±0.931)5.10±1.231)Low dosage group101.99±0.682)3.99±1.172)High dosage group101.77±0.722)3.34±1.042)
Note:Compared to control group,1)P<0.05;compared to model group,2)P<0.05.
2.3孟魯司特鈉對外周血T淋巴細胞亞群的影響 與對照組比較,模型組小鼠CD3+、CD4+、CD4+/CD8+顯著降低(P<0.05),CD8+顯著上升(P<0.05);與模型組比較,孟魯司特鈉低、高劑量組小鼠CD3+、CD4+、CD4+/CD8+顯著上升(P<0.05),CD8+顯著下降(P<0.05)。結果見表3。
2.4孟魯司特鈉對血清IL-6、TNF-α、AOPP的影響 與對照組小鼠比較,模型組小鼠IL-6、TNF-α、AOPP水平顯著升高(P<0.05);與模型組小鼠比較,孟魯司特鈉低、高劑量組小鼠IL-6、TNF-α、AOPP水平顯著降低(P<0.05)。結果見表4。
3 討論
ITP是一種過敏性免疫疾病,主要表現為血小板的減少。本研究中,注射APS建立小鼠ITP模型8 d后,各組小鼠外周血小板數量均顯著下降,說明該方法可以成功復制ITP動物模型。脾臟指數和胸腺指數可以準確反映出機體的免疫能力,通過測定各組小鼠的臟器指數,結果表明ITP機體免疫功能異常,通過服用孟魯司特鈉可恢復到正常水平。此外,孟魯司特鈉可升高血小板的數量。
CD3+是成熟T淋巴細胞表面標志,CD4+為T輔助淋巴細胞,在機體免疫中起輔助作用,CD8+T為T殺傷細胞,起免疫抑制作用。血小板表面膜蛋白被抗原獲取后,專遞給CD4+T細胞,并活化B淋巴細胞,產生血小板抗體,因此,輔助T淋巴細胞在紫癜治療過程中發揮重要作用[6,7]。通過檢測T淋巴細胞亞群和細胞因子,發現ITP模型小鼠CD3+、CD4+、CD4+/CD8+水平顯著下降,表明ITP導致輔助T細胞和抑制T細胞比例失調,T淋巴細胞表達異常,服用孟魯司特鈉能夠使T淋巴細胞亞群比例恢復平衡。采用Pearson相關性分析,結果表明血小板數與CD3+、CD4+呈現負相關。
AOPP是一類尿毒癥毒素,是血清白蛋白被自由基和反應性氧系氧化后的產物,能夠激活單核細胞和中性粒細胞,刺激單核細胞和巨噬細胞產生IL-6。IL-6 作為炎癥介質及抗原誘導物,可使促進抗體分泌,參與自身免疫疾病的發生和發展全過程,活化的單核細胞是其主要來源[8]。此外,IL-6 能通過促進B細胞的成熟而分泌IgG、IgA、IgE等細胞因子,誘導炎癥反應[9]。AOPP還能刺激腫瘤壞死因子(TNF-α)合成、釋放[10]。TNF-α被激活后,激活中性粒細胞及巨噬細胞,增加其細胞毒性,釋放更多細胞因子IL-6和其他細胞炎性因子,加快炎癥進程。結果表明,模型組小鼠AOPP、IL-6、TNF-α水平均顯著升高,服用孟魯司特鈉后顯著下降,相關性分析結果顯示AOPP上升與IL-6、TNF-α水平上升呈現正相關。
ITP主要通過刺激機體免疫系統,使T淋巴細胞亞群失衡,積累OAPP,刺激IL-6、TNF-α等炎性細胞因子產生,刺激B細胞產生抗血小板抗體,損傷血小板。孟魯司特鈉可通過免疫調控作用,修復機體免疫系統,增強機體對抗原的清除能力,調整T淋巴細胞亞群平衡,減少OAPP積累,抑制血小板抗體分泌,減少血小板損傷破壞。此外,降低血清中IL-6、TNF-α等炎性因子的含量,可以進一步降低血管內皮細胞通透性,治療出血癥。
參考文獻:
[1] 石立鵬,劉明懷,彭方毅,等.特發性血小板減少性紫癜臨床研究進展[J].實用中醫藥雜志,2016,32(3):294-295.
Shi LP,Liu MH,Peng FY,etal.Clinical research progress of idiopathic thrombocytopenic purpura[J].J Pract Chin Med,2016,32(3): 294-295.
[2] Talaat RM,Elmaghraby AM,Barakat SS,etal.Alterations in immune cell subsets and their cytokine secretion profile in childhood idiopathic thrombocytopenic purpura (ITP)[J].Clin Exp Immunol,2014,176(2):291-300.
[3] 李玉霞,王朋朋,謝 鶴,等.孟魯司特鈉治療過敏性紫癜患兒療效觀察[J].深圳中西醫結合雜志,2016,26(16):82-84.
Li YX,Wang PP,Xie H,etal.Observation of the curative effect of menustrum sodium in children with allergic purpura[J].J Integ Chin Western Med Shenzhen,2016,26(16): 82-84.
[4] Bochi GV,Torbitz VD,Campos LPD,etal.In vitro,oxidation of collagen promotes the formation of advanced oxidation protein products and the activation of human neutrophils[J].Inflammation,2016,39(2):916-927.
[5] 何 昊,徐 玥,秦 蓓,等.免疫性血小板減少性紫癜動物模型建立方法與應用評價[J].現代生物醫學進展,2016,16(10):1971-1974.
He H,Xu Y,Qin B,etal.Establishment method and application evaluation of immune thrombocytopenic purpura animal model[J].Adv Modern Biomed Sci,2016,16(10):1971-1974.
[6] 張 靜,凌 云,曹祥山,等.特發性血小板減少性紫癜患者CD3+﹑CD4+和CD8+T淋巴細胞凋亡率的研究[J].臨床血液學雜志,2009,22(5):460-462.
Zhang J,Lin Y,Cao XS,etal.Pesearch of CD3+,CD4+and CD8+T lymphocyte apoptosis rate in patients with idiopathic thrombocytopenic purpura[J].J Clin Hematol,2009,22(5):460-462.
[7] Xie J,Cui D,Liu Y,etal.Changes in follicular helper T cells in idiopathic thrombocytopenic purpura patients[J].Int J Biol Sci,2015,11(2):220-229.
[8] 張 爽,鄭 冬,馬月輝.IL-6在代謝類疾病及癌癥中的功能研究進展[J].生物技術進展,2015,5(5):347-350.
Zhang S,Zheng D,Ma YH.Research progress in the function of il-6 in metabolic diseases and cancer[J].Biotechnol Progress,2015,5(5):347-350.
[9] Savin VJ,Sharma M,Zhou J,etal.Renal and hematological effects of CLCF-1,a B-cell-stimulating cytokine of the IL-6 family[J].J Immunol Res,2015,2015:714964.
[10] 孫 巖,吳雄飛,金錫御.新的尿毒癥毒素結合蛋白-晚期氧化蛋白產物結合蛋白分離成功[J].第三軍醫大學學報,2005,27(22): 2-3.
Sun Y,Wu XF,Jin XY.Successful isolation of new uremia toxin binding protein-late oxidative protein binding protein[J].Third Military Med Univ,2005,27(22): 2-3.

