免疫接種疫苗異常發熱反應時間及其 相關因素分析*
張慧 刁玉濤 武晶晶 王廣娟 1,
(1.濟南大學·山東省醫學科學院醫學與生命科學學院,山東 濟南 250062;2.山東省醫學科學院基礎醫學研究所,山東 濟南 250062; 3.山東省濟南市疾病預防控制中心免疫預防所,山東 濟南 250021)
生物技術隨社會發展不斷進步,同時國家擴大預防接種免疫規劃方案,從而使得接種疫苗的種類不斷增加,同時質量和接種率得到相應的提高。但是接種后也會出現一系列的反應,稱為疑似預防接種異常反應(adverse events following immunization, AEFI)。而AEFI是指在預防接種期間或免疫接種后可能會發生的懷疑和預防接種相關的反應或事件[1-2],且受到公眾更多的關注[3]。雖然大部分用于免疫預防的疫苗制劑是安全、有效的,但個別AEFI反應不可避免[4]。
在所有的AEFI中,發熱和局部紅腫最常見[5],以往研究只采用某種疫苗接種后不良反應的發生率來評價疫苗接種的質量,而忽視了不良反應發生的時效性。因此,本研究針對接種后最常見的發熱反應進行生存分析[6],進一步了解常見預防接種疫苗的發熱反應時間分布,對預防接種的安全性提供參考。
1 資料與方法
1.1 資料來源 通過中國AEFI信息管理系統監測收集2014~2015年濟南市所有接種國家免疫疫苗的個案數據1541例。
1.2 方法 將預防接種資料和臨床診斷為發熱的個案數據進行生存分析。
1.3 發熱臨床表現 發熱反應的判定標準為腋測法[7]測得患兒的體溫≥37.1 ℃,接種疫苗后體溫37.1~37.5℃為弱反應;37.6~38.5℃為中反應;>38.6℃為強反應。部分發熱一般持續1~2天,很少超過3天,個別出現在接種后4~22天。
1.4 統計學分析 納入的個案數據經過Excel 2003格式文件錄入與整理后,導入SPSS19.0軟件進行分析,先采用矩法對從預防接種到發生發熱反應的時間間隔分布做正態性檢驗,然后分析接種后到出現發熱反應時間間隔的生存曲線主要用Kaplan-Meier法,最后通過Breslow檢驗對不同疫苗發生發熱反應的生存曲線做假設檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 所有疫苗從接種到出現發熱反應的時間間隔 從預防接種到反應的時間間隔呈右偏態分布;利用矩法做假設檢驗同樣表明數據不符合正態分布,其均數10.31天;中位數1.00天。最集中的發熱反應主要在接種后的0~4天之間。
2.2 不同疫苗接種后發熱反應的發生率 在預防接種后,所有疫苗均出現發熱反應,總發生率為67.89%。麻疹疫苗的發熱率最高(96.23%),而最不容易發生發熱反應的是卡介苗(27.27%),見表1.
2.3 所有疫苗接種后發熱反應的時間間隔的生存曲線 分析各類疫苗從接種開始到發生發熱反應的時間間隔的生存曲線主要采用用的是Kaplan-Meier法。可得到各疫苗發生發熱反應半數發生時間為14.00天,95%的可信區間為(3.98, 21.99)天。
2.4 每種疫苗接種后發熱反應的時間分布 首先針對各疫苗從接種到發生發熱反應的時間間隔分布問題,根據頻數分布圖可看出不符合正態分布,進一步做正態性檢驗,結果顯示呈正態分布,應以中位生存(發生發熱反應)時間描述各疫苗的發熱反應時間分布。理論上各疫苗的半數發熱時間分布差異較大。通過對不同疫苗的發熱反應發生曲線做假設檢驗,各疫苗之間從接種到發生發熱反應時間間隔的分布差異具有統計學意義(P<0.05),說明各疫苗間導致發熱反應的特性存在顯著差異。白破、百白破(無細胞)、百白破IPV+Hib五聯和脊灰(滅活)疫苗的半數發熱反應時間為2~3天,說明這幾類疫苗較易出現發熱反應,其次為Hib疫苗。其它疫苗發生發熱的半數反應時間較長,故不易發生發熱反應。出現發熱反應的生存曲線出現交叉現象,有必要將各疫苗進行歸類合并后重新分析,見表2。
表1所有疫苗發生發熱反應的頻數分布
Table1Frequencydistributionoffeverresponsetoallvaccines
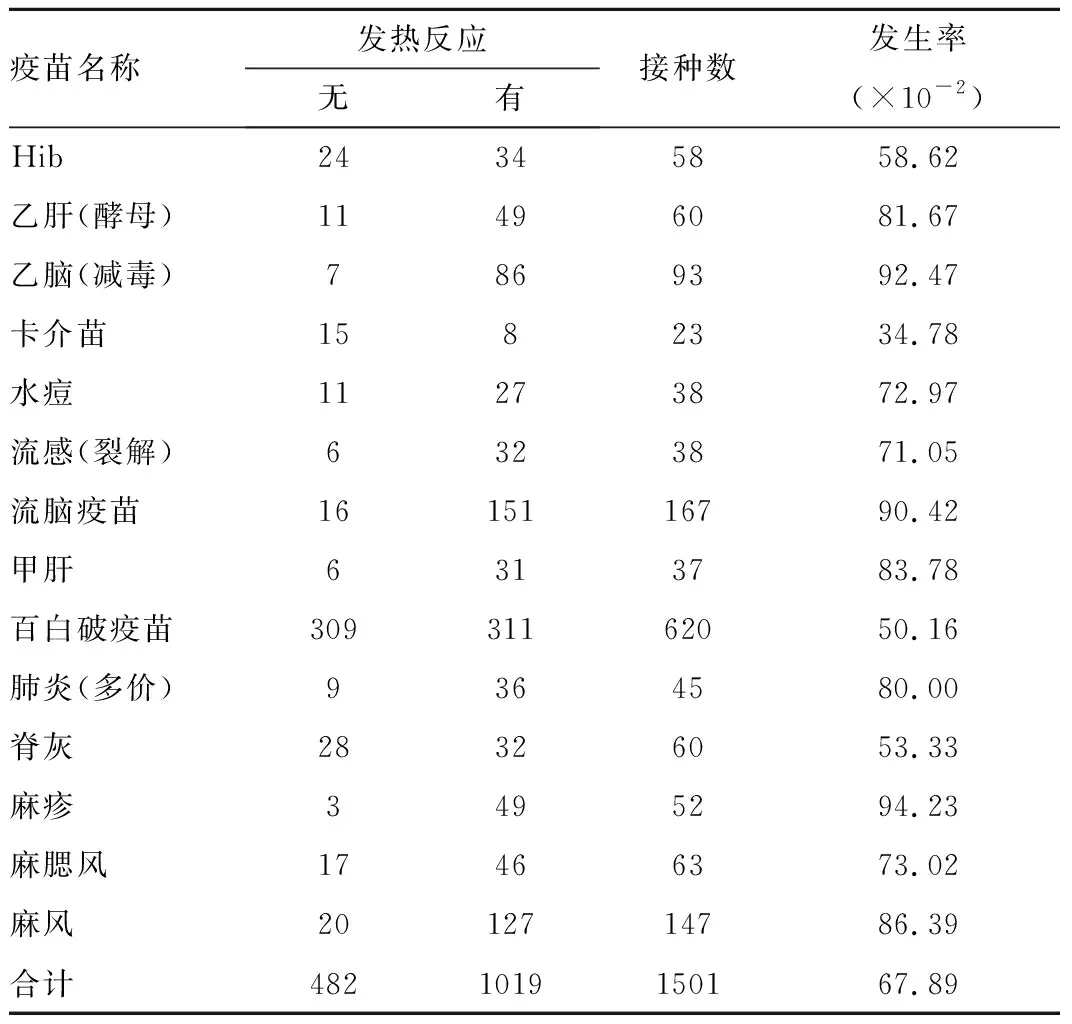
疫苗名稱發熱反應無有接種數發生率(×10-2)Hib24345858.62乙肝(酵母)11496081.67乙腦(減毒)7869392.47卡介苗1582334.78水痘11273872.97流感(裂解)6323871.05流腦疫苗1615116790.42甲肝 6313783.78百白破疫苗30931162050.16肺炎(多價)9364580.00脊灰28326053.33麻疹3495294.23麻腮風17466373.02麻風2012714786.39合計4821019150167.89
2.5 疫苗歸類合并后發熱反應的時間分布 將類似疫苗進行合并歸類:流腦系列包括流腦A+C(結合)、流腦A+C+Y+W135、流腦A+C群、流腦A群共計4種;甲肝系列包括甲肝(減毒)、甲肝(滅活)2種;百白破+脊灰系列包括白破、百白破(無細胞)、百白破IPV+Hib五聯、脊灰(減毒)、脊灰(滅活)共5種;麻腮風系列包括麻疹、麻腮風、麻風共3種;無法依相似程度歸類的疫苗包括Hib、乙肝(酵母)、乙腦(減毒)、卡介苗、水痘、流感(裂解)、肺炎(多價)共7種,歸到其它類別。進一步揭示了百白破+脊灰系列疫苗具有更短的半數發熱時間,平均6.00天,95%可信區間為(4.11,7.89)天,與其它疫苗的發熱時間分布具有顯著的統計學差異(2=112.119,P<0.01)。流腦系列、甲肝系列和麻腮風系列疫苗的生存曲線與其它類別疫苗交叉,說明這3類疫苗也可以歸類到其它疫苗系列,從而形成區分度具有統計學意義的2條生存曲線,分別表示其它系列疫苗和百白破+脊灰系列疫苗,見表3。

表2 各種疫苗的半數發熱時間(天) Table 2 Half of the various fever time
注:Hib,b型流感嗜血桿菌疫苗;為生存曲線的數據點太少而不足以估計半數生存(發熱)時間。
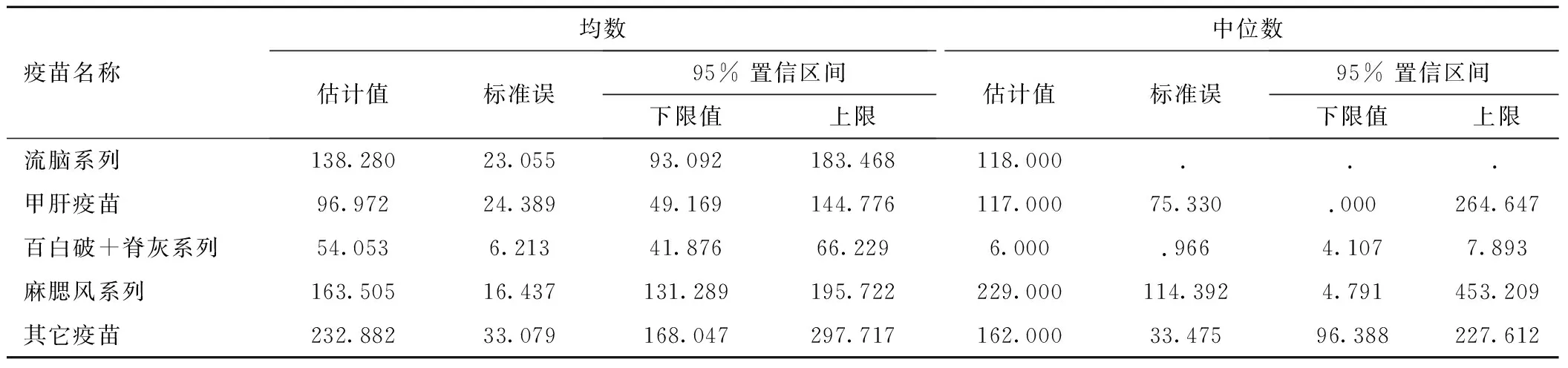
表3 各種疫苗系列的半數發熱時間(天) Table 3 Half of the various vaccine series fever time
3 討論
在AEFI一般反應中,發熱和紅腫報告率最高[5]。本研究監測的所有個案中所接種的疫苗均發生發熱反應,總發生率(67.89%),明顯高于深圳市南山區發熱總發生率(59.17%)[5],低于河北保定市(71.59%)[8],且低于同省相鄰城市泰安70.17%[9], 全國總發生率三年逐漸降低,分別為80.84%[10], 67.43%[11],65.40%[12]濟南市與11年全國總發生率(67. 43%)[11]相持平。
以前的相關研究僅以接種疫苗后出現不良反應的發生率來評價疫苗的質量和特性。而此次研究則注重通過生存分析得到接種各疫苗發生發熱反應半數發生時間,以此作為評價疫苗質量肯接種特性的新指標。本研究發現所有被監測疫苗接種后總的半數發熱時間為15.00天,95%的可信區間為(3.98, 22.02)天。從接種到發生發熱反應是預防接種中常見的一般反應,接種不同種類的疫苗發生發熱的時間也不一致。若發生發熱反應時間超過理論半數發生時間15.00天的,可能為預防接種偶合癥[13]所致。然而疫苗的本有性質并不能引起偶合癥,因此這并不屬于異常反應。對于預防接種來說,偶合癥只是偶然的與時間具有相關性,而不是因果關系。
本研究發現,單純從發生率考察,最容易發生發熱反應的是麻疹疫苗(MV),MV具有良好的免疫效果,全稱為麻疹減毒活疫苗,接種進入機體后,可能會出現發熱紅腫等反應[14]。因此,在接種此類疫苗時要做好預防工作。而卡介苗、流腦A+C+Y+W135、麻腮風等系列疫苗相對來說發熱反應并不明顯,但不能因此忽略接種時的注意事項,應避免預防接種所帶來的異常反應。
發熱是預防接種時所產生的一種常見的炎癥反應,但是隨著傳染病發病的減少和疫苗使用數量及品種的增加,廣大群眾和媒體對預防接種的關注已從是否患傳染病轉移到是否會因預防接種引起健康危害上來,尤其對于兒童預防接種。而Thoon等研究發現新加坡15.60% 的兒童AEFI可能或確定和疫苗接種有關[15]。曾有研究表明1例接種麻疹疫苗后,偶合癲癇,結合所有臨床表現以及有關檢查發現,以上均不說明與接種麻疹疫苗有因果關系,純屬偶合[16]。
2016年山東濟南非法經營疫苗系列案件影響甚大,主要暴露的是疫苗的儲存以及運輸過程中影響疫苗有效性的問題,但這都應該嚴格按照《疫苗流通和預防接種管理條例》[17]執行,必須達到WHO關于疫苗監管體系(National Regulatory Assessment,NRA)的要求[18]。
4 結論
本研究結果提示,發現百白破和脊髓灰質炎系列疫苗相對于其它疫苗具有更短的半數發熱時間,為及時有效的預防接種該類疫苗后出現的發熱不良反應提供參考。2011年山東省下發了《山東省預防接種異常反應具體補償辦法(試行)》[19],但由于對AEFI的調查診斷,全國并沒有統一標準,因此收集個案方面仍存在漏洞[20],所以本研究仍存不足。
【參考文獻】
[1]衛生部. 全國疑似預防接種異常反應監測方案[J]. 中國疫苗和免疫, 2011(1): 72-81.
[2]常利民, 劉大衛, 王華慶. 國內外疑似預防接種異常反應監測報告和診斷標準的研究現狀[J]. 中國疫苗和免疫, 2012(5):465-468.
[3]Osman Mansoor.WHO/WPRO immunization safety surveillance:guidelines for managets of immunization programmes un reporting and investigating adverse events following immunization.Manila:WHO/WPRO,1999:15-71.
[4]WHO. Global advisory committee on vaccine safety, December 2012[J]. Wkly Epidemiol Rec, 2013, 88(6): 65-72.
[5]崔利偉. 2005-2013年深圳市南山區疑似預防接種異常反應監測分析[J]. 現代預防醫學, 2015, 42(16):3022-3024.
[6]武晶晶. 濟南市2012-2013年疑似預防接種異常反應監測分析[D]. 濟南大學, 2016.
[7]萬學紅, 盧雪峰. 診斷學. 第8版[M]. 人民衛生出版社, 2013. 88.
[8]吳冰冰, 張玉璽, 賈磊,等. 河北省保定市2013-2015年疑似預防接種異常反應監測分析[J]. 中國疫苗和免疫, 2016(4):438-443.
[9]李文芳. 2008-2013年泰安市預防接種異常反應監測及分析[J]. 預防醫學情報雜志, 2016, 32(7):664-669.
[10] 武文娣,劉大衛,李克莉,等.中國2010年疑似預防接種異常反應監測數據分析[J].中國疫苗和免疫,2012,18(5):385-397.
[11] 武文娣, 李克莉, 鄭景山,等. 中國2011年疑似預防接種異常反應監測數據分析[J]. 中國疫苗和免疫, 2013(2):97-109.
[12] Wu WD, Liu DW, Li KL,etal. Analysis on surveillance data of adverse events following immunization in China,2012 [J]. Chinese Journal of Vaccines and Immunization, 2014,20 (1): 1-12.
[13] 中華人民共和國衛生部.預防接種工作規范[S].北京:衛生部疾控司, 2005:35.
[14] 刁連東. 主編.麻疹.第1版.上海:上海科學技術文獻出版社,2001,219-231.
[15] THOON KC,SOH SB,LIEW WK,etal.Active surveillance of adverse events following childhood immunization in Sin-gapore[J].Vaccine,2014,32(39):5000.
[16] 謝廣中. “預防接種與偶合癥”試題[J]. 上海預防醫學, 2008,20(5):134-134.
[17] 中華人民共和國國務院令.疫苗流通和預防接種管理條例 [S].2005,3,24.
[18] WHO/Immunization Vaccines and Biologicals(IVB).Joint Medical Products Assessment Tools of National Regulatory System Vaccines Assessment[S].Geneva,Switzerland,2004.
[19] 山東省衛生廳,財政廳,山東省預防接種異常反應具體補償辦法(試行)[Z].魯衛疾控發[2011]2號.201l.
[20] 常利民, 劉大衛, 李克莉,等. 全國2008~2010年接種疫苗后過敏性休克監測結果分析[J]. 中國疫苗和免疫, 2012(5):398-401.

