植物乳桿菌與解淀粉芽孢桿菌對食醋風味的影響
鄺格靈,張 潔,孔德華,潘志輝,趙國忠*
(1.天津科技大學 食品工程與生物技術學院 教育部食品營養與安全重點實驗室,天津 300457;2.天津市食品安全檢測技術研究院,天津 300308;3.廣州致美齋食品有限公司,廣東 廣州 510403)
食醋釀造歷史悠久,是一種以淀粉質原料為主,通過微生物發酵釀造的酸性調味品。食醋不僅作為調味品,還有各種食療、保健作用(如軟化血管、調節血糖、預防動脈硬化、抗氧化、抗癌、降血壓、治療糖尿病等[1-3])。我國食醋行業經過上千年的不斷發展,已成為生物技術產業的重要組成部分。固態發酵食醋由于大多使用多菌種固態開放式的發酵工藝,釀造微生物除了醋酸菌之外,還有乳酸菌、芽孢桿菌、酵母菌和霉菌等微生物的存在,不同微生物代謝產生的產物不同,如醋酸菌可將乙醇轉化為乙酸,構成食醋的主體骨架;乳酸菌可以代謝產生乳酸,改善食醋的口感,同時包括乳酸在內的眾多有機酸可以對乙酸起到緩沖作用,降低乙酸的刺激口感,使得食醋更加柔和。除此之外,芽孢桿菌、酵母菌和霉菌等微生物在釀醋過程中代謝產生的眾多風味物質也可為食醋風味的形成奠定基礎。
植物乳桿菌(Lactobacillus plantarum)是一種常見于發酵制品中的乳酸菌,能定植于腸道發揮有益作用[4]。在食品發酵過程中,乳酸菌將食品原料中的糖轉變為乳酸,同時產生抗菌肽、胞外多糖和其他代謝產物[5]。不僅如此,乳酸菌還能夠產生水解蛋白質的酶,將其水解為氨基酸,讓食醋的風味變得更加醇厚和柔和[6]。除此之外,在乳酸菌的生長代謝過程中還能產生少量的乳酸鏈球菌素,能有效抑制雜菌及多種致病菌的生長,提高產品的穩定性[7]。
芽孢桿菌(Bacillus)是一類好氧菌,可以通過三羧酸循環(tricarboxylic acid cycle,TCA)途徑產生有機酸。這些有機酸不僅可以使食醋中的刺激酸味變得柔和,還可以通過酯化反應與乙醇形成各酯類,從而增加食醋的風味。另外,它們還具有利用甘油產酸的能力,表明這些菌株具有多元醇的脫氫酶,此酶可將甘油脫氫產生具有淡薄的甜味的二羥基丙酮,讓食醋的香味變得更加濃厚[8]。此外,芽孢桿菌產生的大量蛋白酶可以將蛋白質水解成氨基酸,這些氨基酸對食醋的風味和顏色起著至關重要的作用[9]。芽孢桿菌在食醋中的應用研究較少,但是它卻是醋酸發酵中不可缺少的微生物類群之一,在食醋釀造中,其對食醋的酸度、風味的提高具有一定的作用[10]。呂艷歌等[11]采用16S rDNA序列分析法對山西老陳醋醋醅的產酸菌株進行鑒定,經分析后發現,醋醅中產酸菌主要以醋酸桿菌、乳酸桿菌和芽孢桿菌為主。本研究通過將植物乳桿菌(Lactobacillus plantarum)和解淀粉芽孢桿菌(Bacillusamyloliquefaciens)添加到食醋發酵體系當中,采用氣相色譜-質譜法(gas chromatography-massspectrometer,GC-MS)研究其風味物質變化,進而提高食醋的品質,對于我國食醋工業的發展具有重要意義。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與材料
釀酒酵母(Saccharomyces cerevisia)、醋酸菌(acetic acid bacteria)、植物乳桿菌(Lactobacillus plantarum)、解淀粉芽孢桿菌(Bacillus amyloliquefaciens):天津科技大學菌種保藏中心提供。
山西老陳醋醋醅來源:采集于山西雙園醋業有限公司。
1.1.2 化學試劑
α-淀粉酶(5萬 U/g)、糖化酶(5萬U/g):河北亞信生物科技有限公司;三磷酸脫氧核糖核苷(deoxyribonucleoside triphosphate,dNTP)、TaqDNA聚合酶(250 U):北京全式金生物技術有限公司。
1.1.3 培養基
MRS培養基[12-13]:蛋白胨10 g/L,牛肉膏10 g/L,酵母膏5 g/L,檸檬酸氫二銨2 g/L,葡萄糖20 g/L,乙酸鈉5 g/L,磷酸氫二鉀2 g/L,硫酸鎂0.58 g/L,硫酸錳0.25 g/L,瓊脂18 g/L,pH 6.2~6.6。
1.2 儀器與設備
QP2010型氣質聯用儀:日本SHIMADZU有限公司;T100 Thermal Cycler聚合酶鏈式反應(polymerase chain reaction,PCR)儀:美國伯樂 BIO-RAD公司;5424R離心機:德國Eppendorf有限公司;FE-20精密pH計、ME3002E電子分析天平:梅特勒-托利多儀器有限公司;MLS-3750立式壓力蒸汽滅菌鍋:日本SANYO公司;SP-250生化培養箱:南京實驗儀器廠;TG-20離心機:長沙英泰儀器有限公司;IKA VORTEX 1漩渦振蕩器:廣州易測儀器有限公司;DK-S12恒溫水浴鍋:上海森信實驗儀器有限公司;DK-8D電熱恒溫水槽:上海精密實驗設備有限公司。
1.3 方法
1.3.1 菌種的分離鑒定
菌株的分離[14-15]:先取1 mL醋醅樣品加入9 mL滅過菌的生理鹽水中,然后依次做梯度稀釋至10-1、10-2、10-3、10-4、10-5、10-6,然后用滅過菌的移液管吸取100 μL各濃度醋醅移至MRS培養基上,在37℃的恒溫培養箱中培養24~36 h后,觀察單菌落,挑取不同形態、大小的單菌落進行劃線純化,3次分離純化之后,對菌株進行革蘭氏染色鏡檢,并確定菌株形態,將鏡檢菌株接種在MRS液體培養基里于試管中進行傳代培養到20代,置于4℃冰箱保存,備用。
菌株的鑒定:對篩選得到的乳酸菌進行16S rDNA序列分析,確定其種屬。將活化好的菌液進行菌株的全基因組脫氧核糖核酸(deoxyribonucleic acid,DNA)的提取[16],然后對基因組DNA的16S rDNA區域進行PCR擴增,上游引物27F序列5′-AGAGTTTGATCCTGGCCTCA-3′,下游引物1492R序列:5′-GGTTACCTTGTTACGACTT-3′,擴增片段為1 500 bp。PCR體系50 μL:10×buffer 5 μL;脫氧核糖核苷酸三磷酸(dNTP)5 μL;上游引物(25 μmol/L)0.5 μL;下游引物(25μmol/L)0.5μL;TaqDNA聚合酶(250 U)0.5 μL;模板DNA 1.5μL;ddH2O37μL。PCR擴增條件為:95℃、3min;95 ℃、10 s;55 ℃、30 s;72 ℃、1 min;72 ℃、5 min,2~4反應步驟進行30個循環。擴增產物進行瓊脂糖凝膠電泳檢測其純度及濃度,將達到測序要求的擴增產物送至上海華大基因進行測序,將測序結果在美國國立生物技術信息中心(national center for biotechnology information,NCBI)上BLAST進行比對,并確定其種屬。
1.3.2 食醋的固態發酵
①米粉液化糖化
食醋固態發酵參考文獻[17]。按照1∶2(g∶mL)的料水比將大米粉調成漿液,用碳酸鈉調節漿液pH值為6.4±0.1。按照100 U/g大米粉添加α-淀粉酶,90℃保溫液化20 min,然后降溫至(59±1)℃。用濃H2SO4調節pH值至4.5±0.1,按照100U/g大米粉添加糖化酶,60℃保溫糖化4h,糖化完成后,降溫至(36±1)℃,即為糖化液。
②酒精發酵階段

表1 酒精發酵階段植物乳桿菌和解淀粉芽孢桿菌添加量Table 1 Addition ofL.plantarumandB.amyloliquefaciensduring alcohol fermentation process
按照2%葡萄糖水溶液與安琪酵母粉1∶7的質量比,將安琪酵母粉在30℃條件活化20 min,添加2%活化酵母液到糖化液中,再添加50%麩皮至糖化液中。添加L.plantarum和B.amyloliquefaciens菌液進行酒精發酵,添加量見表1。在(30±1)℃條件下進行酒精發酵,發酵時間為5 d。
③醋酸發酵階段
酒精發酵結束后,按照3%添加量添加活化好的醋酸菌,進行醋酸發酵。醋酸發酵期間,每天分3個時間段(8:00am、1:00pm和5:00pm)觀察溫度計溫度的上升情況,當溫度升至40℃時,需要進行第一次攪拌,以后每天翻醅一次,控溫在42℃以下。攪拌數次后,醅料溫度下降至35~38℃,此間,利用酸堿中和的原理[18],并以pH為指示終點每天測醋醅的酸度,當酸度不再上升或稍有下降的時候,結束醋酸發酵。
1.3.3 食醋發酵過程中的風味成分分析
①樣品預處理
先將固相微萃取(solid phase micro extraction,SPME)萃取頭置于氣相色譜儀進樣口處,于250℃條件下充分老化至沒有雜質峰。準確量取5 mL檢測醋樣置于15 mL的樣品瓶中,加入固體氯化鈉25 g,蓋上蓋子并將其置于40℃恒溫水浴中。將SPME萃取頭插入樣品瓶的頂空部分,對樣品中的香氣成分吸附富集40 min后將SPME萃取頭從樣品瓶中拔出,插入GC-MS的氣相色譜進樣口中,推出纖維頭,并于250℃條件下解吸2 min,準備樣品檢測和分析。
②氣相色譜檢測條件
DB-170色譜柱(30 m×0.25 mm×0.25 μm);載氣為氦氣(純度99.999%);流量為1 mL/min;分流比5∶1,SPME萃取頭插入進樣孔,溫度240℃解吸5 min。程序升溫:起始溫度35℃,保持30 min,以5℃/min的速度升至120℃,保持1min,再以10℃/min的速度升至220℃,保持2 min。
③質譜測定條件
質譜儀的接口溫度為280℃,離子源溫度為220℃,溶劑延遲時間1.5 min,電離方式為電子電離(electron ioniza tion,EI),電子能量70 eV,掃描質量范圍43~450 amu。通過HP-Chemstation System工作站采集和處理數據,先由譜庫初步鑒定成分,結合化學成分的保留時間、質譜、實際成分和保留指數等進行定性,采用面積歸一化法進行定量。
2 結果與分析
2.1 乳酸菌及芽孢桿菌的分離及鑒定
本研究從食醋醋醅樣品中分離得到18株菌,編號為C1~C18。采用16S rDNA序列分析法對篩選到的菌株進行序列分析,得到序列后在NCBI上進行BLAST比對分析,發現其中3株菌為霉菌,另外15株細菌與NCBI上的物種相似度均>98%。將該15株細菌構建系統發育樹,結果見圖1所示,這18株菌分別鑒定為:乳酸桿菌(Lactobacillus acidophilus),副干酪乳桿菌(Lactobacillus paracasei),植物乳桿菌(Lactobacillus plantarum),解淀粉芽孢桿菌(Bacillus amyloliquefaciens)和瑞士乳桿菌(Lactobacillus helveticus)。
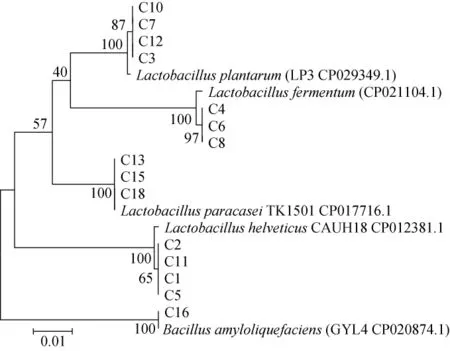
圖1 菌株C1~C18 16S rDNA的系統發育樹Fig.1 Phylogenetic tree of strains C1-C18 16S rDNA
菌株分解淀粉的能力在食醋發酵行業起非常重要的作用,另外,由于食醋發酵屬于植物類發酵,因此本實驗選擇解淀粉芽孢桿菌(Bacillus amyloliquefaciens)C16和植物乳桿菌(Lactobacillus plantarum)C7為研究對象,其培養24 h后的菌落形態描述見表2。由表2可知,菌株C7直徑大小約0.5 mm,邊緣平滑,凸起,呈乳白色。菌株C16直徑大小約2 mm,邊緣褶皺,不規則,半透明。
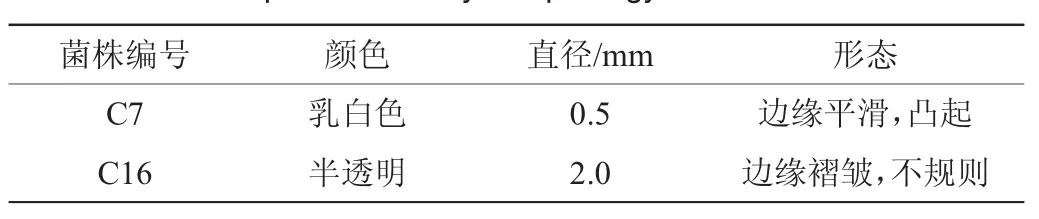
表2 菌株C7和C16菌落形態描述Table 2 Description of colony morphology of strain C7 and C16
2.2 食醋發酵過程中的風味物質分析
采用GC-MS分別對食醋的酒精發酵過程,醋酸發酵初期,醋酸發酵完成時樣品中的揮發性香氣成分變化進行了分析。對空白對照組、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16樣品中香味物質總數和不同酒醅香味物質類型相對含量進行比較分析。
2.2.1 酒精發酵階段風味物質分析
發酵至第5天時,酒精發酵已基本完成,取其樣品進行GC-MS檢測,分析其風味物質組成及含量,結果分別見表3和圖2。
由表3可知,對照組、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16的樣品中香味物質總數分別為31、31、30、38、35、29種。
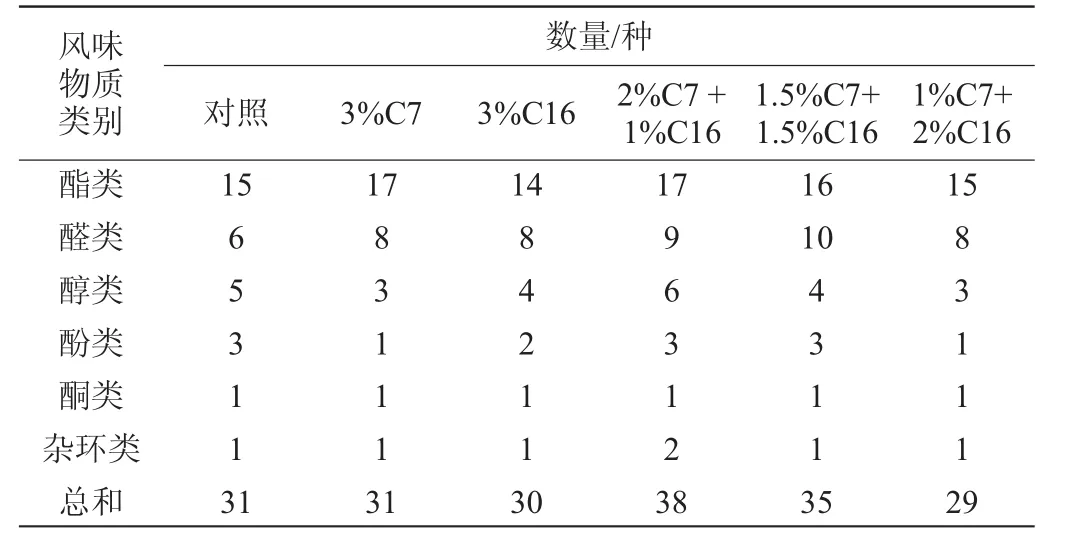
表3 菌株C7和C19對醋醅風味的影響Table 3 Effect of strain C7 and C19 on the flavor substances of vinegarPei

圖2 酒精發酵第5天六種不同醋醅風味物質類型相對含量的比較Fig.2 Comparison of the relative contents of flavor substances in six types of vinegarPeion the fifth day of alcohol fermentation
由圖2可知,醋酸發酵初期,6個樣品風味中占據主體地位的是酯類,醇類和醛類,且3%C7的酯的相對含量是6個樣品中最高的,達到15.3%,而1%C7+2%C16的酯的相對含量最低,為11.75%;醇類物質含量最高的是2%C7+1%C16組,為8.93%,最低的是3%C7的樣品,為4.43%;醛類物質含量最高是添加1.5%C7+1.5%C16樣品,為4.01%,最低的是對照樣品,相對含量為0.74%。因此,在酒精發酵階段,相對高含量的植物乳桿菌在混菌體系中產生更多的酯類和醇類風味物質。
2.2.2 醋酸發酵第1天風味物質分析
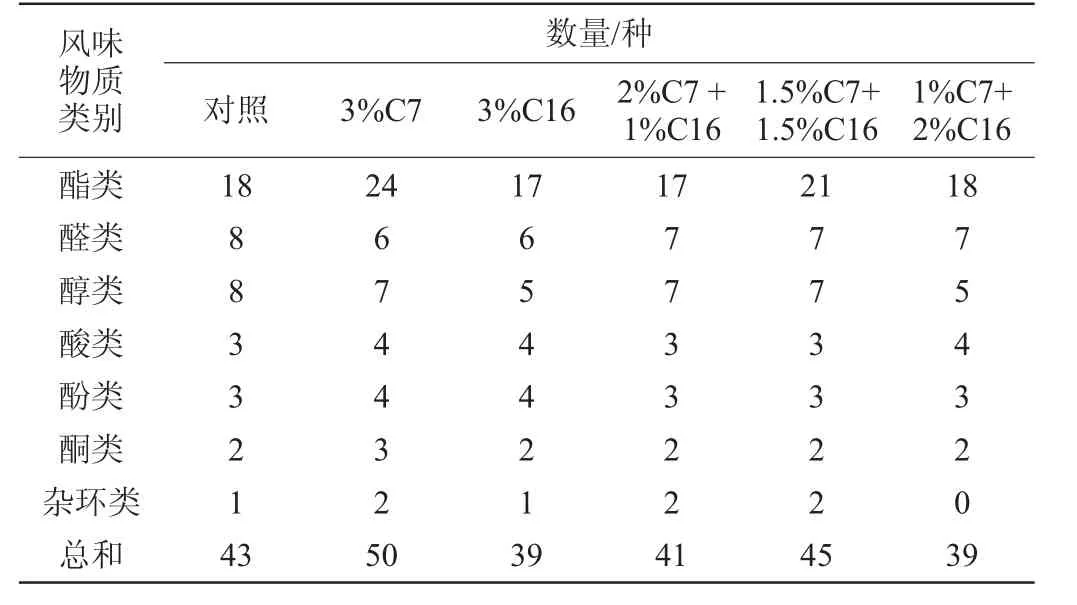
表4 菌株C7和C19對醋酸發酵開始時風味物質的影響Table 4 Effect of strain C7 and C19 on the flavor substances at the beginning of acetic fermentation
由表4可知,對照組、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16的樣品中香味物質總數分別為43、50、39、41、45、39種。
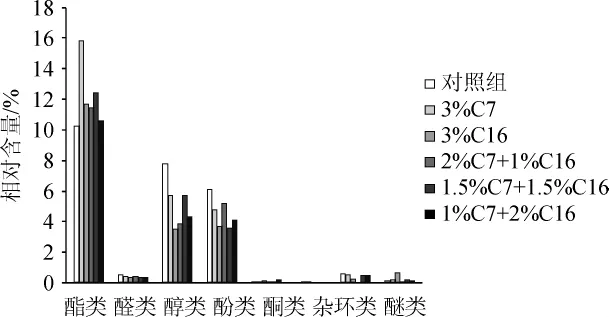
圖3 醋酸發酵第1天六種不同醋醅風味物質類型相對含量的比較Fig.3 Comparison of the relative contents of flavor substances in six types of vinegarPeion the first day of acetic fermentation
由圖3可知,在醋酸發酵初期,6個樣品風味中占據主體地位的是酯類物質,醇類和酸類,且3%C7中酯類香味物質相對含量最多,高達15.83%,而對照組酯類香味物質相對含量最少,僅為10.28%;醇類物質含量最高的是對照組,相對含量為7.78%,最低的是3%C16組,僅占3.54%;酸類物質相對含量最高的是對照組,占6.1%,最低的是1.5%C7+1.5%C16組,占3.6%。
2.2.3 醋酸發酵結束時(醋酸發酵終止)風味物質分析
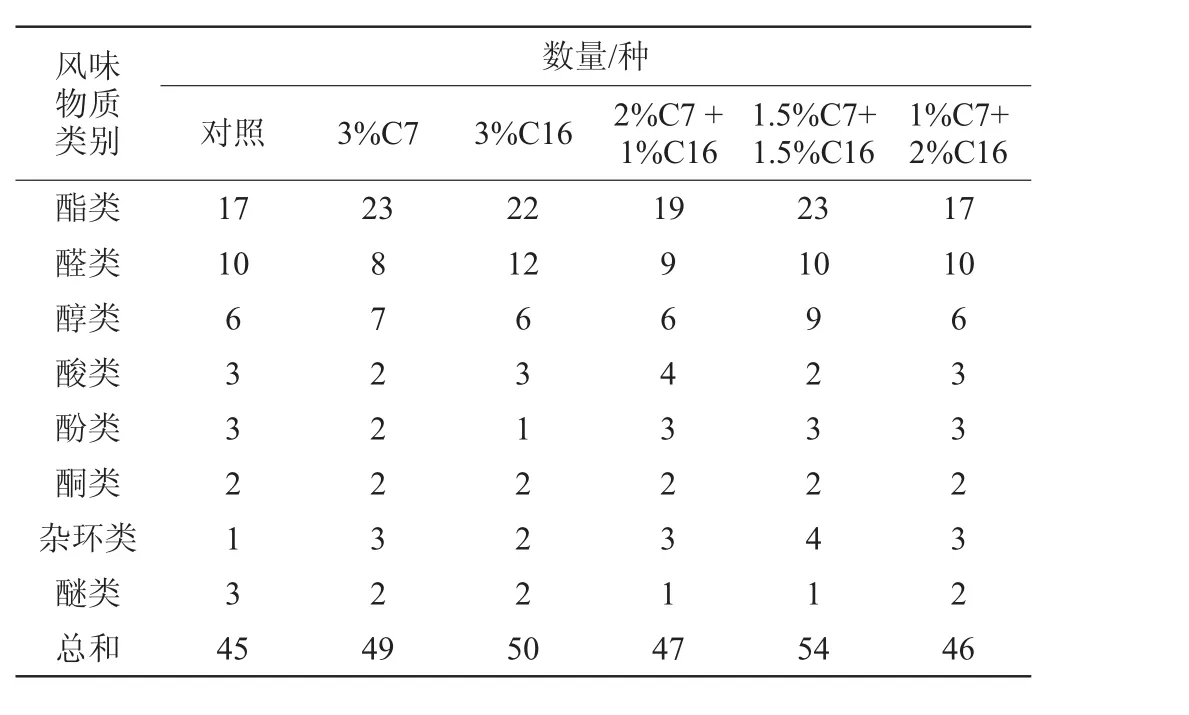
表5 菌株C7和C19對醋酸發酵終止時風味物質的影響Table 5 Effect of strain C7 and C19 on the flavor substances at the end of acetic fermentation
由表5可知,醋酸發酵階段隨著發酵時間的延長,樣品中風味物質的種類明顯增多。對照組、3%C7、3%C16、2%C7+1%C16、1.5%C7+1.5%C16和1%C7+2%C16的樣品中香味物質總數分別為45、49、50、47、54、46種。
由圖4可知,在醋酸發酵末期,除了對照組樣品風味中占據主體位置的是酸類以外,其余5個樣品風味中占據主體地位的均是酯類物質。6個樣品中酯類的相對含量最高的是3%C7組,占27.06%,最低的是對照組,酯類物質含量僅占18.62%,主要是乙酸乙酯。酸類的相對含量最高的是對照組,占26.62%,主要是乙酸,而最低的是1.5%C7+1.5%C16組,占17.26%;醇類物質相對含量最高的是1.5%C7+1.5%C16組,占10.75%,最低的是3%C16組,僅占4.51%;醛類物質含量最高的是3%C16的樣品,最低的是空白樣品。C7的添加,明顯提高了酯類的種類和含量。
3 結論
本研究從食醋醋醅中分離得到L.plantarum和B.amyloliquefaciens。利用這兩株菌與醋酸菌進行多菌種固態發酵,利用GC-MS檢測發酵過程中的風味物質。結果表明,在食醋發酵的混菌體系中,相較于空白對照組,其他組中香味物質的總數都高于空白樣品,而當添加1.5%植物乳桿菌和1.5%解淀粉芽孢桿菌時,可以得到最多數量的香味物質(54種)和最高的醇類物質含量(10.75%),其中含量最高為3-甲基-1-丁醇(6.13%);其他5個樣品酯類物質的含量也明顯高于空白樣品,當添加3%植物乳桿菌的時候,可以得到最高的酯類物質含量(27.06%),主要是乙酸乙酯;當添加3%解淀粉芽孢桿菌的時候,可以得到最高的醛類物質含量(3.05%),其中含量最高為苯甲醛(0.57%)。因此,該兩株菌有助于食醋風味物質的改善,擬為釀造風味優良、營養豐富的食醋提供理論依據。
[1]霍君生.食醋的醫療保健功能(上)[J].上海調味品,1999(2):30-31.
[2]霍君生.食醋的醫療保健功能(中)[J].上海調味品,1999(3):30-31.
[3]霍君生.食醋的醫療保健功能(下)[J].上海調味品,1999(3):27-28.
[4]ROSS P R,MORGAN S,HILL C.Preservation and fermentation.Past,present and future[J].Food Microbiol,2002,79(1-2):3-16.
[5]CAPLICE E,FITZAGERALD G F.Food fermentation role of microorganisms in food production and preservation[J].Food Microbiol,1999,50:131-149.
[6]ZHAOHL,LIZX,YANGXM,et al.Vinegar identification byultraviolet spectrum technology and pattern recognition method[J].Scientia Magna,2009,5(3):104-111.
[7]劉楊岷,張家驪,王利平,等.食醋風味成分比較研究[J].食品與機械,2005(5):40-42.
[8]李宜豐,王海洪,溫麗琴,等.食醋釀造中芽孢桿菌的活動及其作用初探[J].中國調味品,1988(5):25-27.
[9]聶志強,汪越男,鄭 宇,等.傳統食醋釀造過程中微生物群落的多樣性及功能研究進展[J].中國釀造,2012,31(7):4-5.
[10]呂艷歌,馬海樂,李云亮,等.山西老陳醋產酸菌的分離鑒定及系統學分析[J].中國食品學報,2013,13(12):163-171.
[11]陳天壽.微生物培養基的制造與應用[M].北京:中國農業出版社,1995:343-345.
[12]張 娜,郭元昕,王澤建,等.一株乳酸菌的鑒定,生物學特性與發酵培養基優化研究[J].食品工業,2012(12):136-140.
[13]吳方琴,王 超,潘苗苗,等.農家酸菜中優質乳酸菌的篩選分離及其產酸性能優化[J].中國釀造,2011,30(10):100-103.
[14]方 祥,胡文鋒,張輝華,等.乳酸菌的分離,鑒定及其生長特性[J].中國微生物學雜志,2000,12(5):262-264.
[15]許 偉.鎮江香醋醋酸發酵過程微生物群落及其功能分析[J].無錫:江南大學,2011.
[16]MILLER D N,BRYANT J E,MADSEN E L,et al.Evaluation and optimization of DNA extraction and purification procedures for soil and sediment samples[J].Appl Environ Microbiol,1999,65(11):4715-4724.
[17]杜連啟,吳燕濤.醬油食醋生產新技術[M].北京:化學工業出版,2010:212-217.
[18]ZHALNINA K,DIAS R,QUADROS P D D,et al.Soil pH determines microbial diversity and composition in the park grass experiment[J].Microbial Ecol,2014,69(2):395-406.

