不產桔霉素高產紅曲色素的基因工程紅曲菌株構建
李 琦,高健信,陳福生,李 牧*
(1.華中農業大學 食品科技學院,湖北 武漢 430070;2.廣東科隆生物科技有限公司,廣東 江門 529100)
紅曲菌(Monascus)是一種絲狀真菌,能夠合成豐富的次級代謝產物,如紅曲色素、莫納可林K、γ-氨基丁酸等,被廣泛應用于食品、醫藥、化工等行業[1-4]。其中,紅曲色素作為一種天然微生物色素,以其穩定性高、著色效果好、生產不受原料與季節限制等優勢被用作食品著色劑,在我國與東南亞地區已有著近兩千年的應用歷史[1]。紅曲色素是國內增長最快的食品著色劑品種之一,年產量已超過1萬t。
1995年有學者[5]發現,某些紅曲菌株可以產生一種毒素—桔霉素,污染紅曲色素產品,使紅曲色素產品的安全性受到了挑戰。根據現行國家標準GB 1886.181—2016《食品安全國家標準食品添加劑紅曲紅》規定,紅曲紅單位色價的桔霉素含量≤0.04 mg/kg。因此,控制紅曲色素產品中桔霉素的含量成為紅曲色素工業中的重要課題。
近年來,國內外學者通過多種方法來控制紅曲色素產品中的桔霉素含量,并取得了一些重要進展,主要包括低產桔霉素菌株的篩選、發酵條件優化以及基因工程改造。已有學者通過篩選獲得了低產桔霉素的紅曲菌株[6],此外,通過優化發酵條件也能夠控制桔霉素含量,如控制發酵過程pH值[7]、通氧量[8],以及利用低頻磁場也能夠抑制桔霉素的產生[9]。
近年來,隨著絲狀真菌基因組測序以及相關分子生物學技術的發展,紅曲菌的分子生物學研究也取得了突破。桔霉素的生物合成途徑涉及16個基因[10],其中聚酮合酶(polyketide synthase,PKS)是合成桔霉素的第一個關鍵酶,有學者將紅色紅曲菌(Monascusruber)中的該基因敲除,發酵產物中桔霉素的含量降低了99%[11]。因此,通過基因工程構建桔霉素合成基因的敲除菌株,能夠有效抑制桔霉素的合成,有利于紅曲色素的工業生產。
本研究在前期獲得了一株高產紅曲色素的紫色紅曲菌J01,在馬鈴薯葡萄糖肉湯(potato dextrose broth,PDB)培養基中培養13 d,色價可達到265 U/mL,高于目前已報道的大多數紅曲菌株[12],但該菌株也能產生一定量的桔霉素。因此,本研究首先分析了菌株J01中桔霉素合成基因的轉錄情況,并采用根癌農桿菌介導的轉移脫氧核糖核酸(transfer deoxyribonucleic acid,T-DNA)轉化技術敲除紫色紅曲菌(Monasucs purpureus)J01的桔霉素合成關鍵基因pksCT,構建pksCT基因敲除菌株J42,并對其菌落形態、生物量、發酵產物中的桔霉素含量與紅曲色素色價進行了分析。期望能夠構建具有工業應用意義的不產桔霉素高產紅曲色素的菌株,也為通過基因工程來改善絲狀真菌中次級代謝產物合成過程提供了借鑒意義。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
紫色紅曲菌(Monascus purpureus)J01、根癌農桿菌(Agrobacterium tumefaciens)EHA105:華中農業大學食品生物技術與安全實驗室保藏。
1.1.2 培養基
馬鈴薯葡萄糖瓊脂培養基(potatodextroseagar,PDA):馬鈴薯200 g,葡萄糖20 g,瓊脂15 g,加蒸餾水至1 L,121 ℃濕熱滅菌20 min。
PDB培養基:馬鈴薯200g,葡萄糖20g,加蒸餾水至1L,121℃濕熱滅菌20 min。
1.1.3 化學試劑
pSKH質粒、雙元載體pCAMBIA3300質粒:華中農業大學食品生物技術與安全實驗室保藏;限制性核酸內切酶XhoI(10 U/mL)、SacI(10 U/mL)、HindIII(15 U/mL):寶生物工程(大連)有限公司;TRIZOL:美國Invitrogen有限公司;乙腈(色譜純):美國Tedia公司;桔霉素標品(純度98%):阿拉丁試劑(上海)有限公司。
1.2 儀器與設備
LC-20AT高效液相色譜儀:日本島津公司;UV-1700紫外可見分光光度計:日本Shimadzu公司;ACQUITY UPLCXevo TQ MS高效液相串聯四級桿質譜聯用儀:美國Waters公司;SHD-250生化培養箱:上海精宏實驗設備有限公司;HZ200LB型搖床:武漢瑞華儀器設備有限責任公司。
1.3 方法
1.3.1 桔霉素合成相關基因的克隆
參考紅曲菌公布的桔霉素合成基因的序列信息,采用Oligo 6軟件設計引物(見表1),由于pksCT基因有7 000 bp,直接擴增錯配率較高,因此將其分3段擴增。

表1 桔霉素基因擴增引物信息Table 1 Primers for citrinin gene amplification
按照參考文獻[13]報道的方法提取紫色紅曲菌J01的總核糖核酸(ribonucleicacid,RNA),以總RNA為模板,反轉錄獲得互補脫氧核糖核酸(complementarydeoxyribonucleic acid,cDNA)。以cDNA為模板對桔霉素合成的相關基因進行克隆,并對序列進行分析。
1.3.2 桔霉素合成關鍵基因pksCT的序列分析
克隆得到pksCT基因送去測序,根據測序結果對其基因結構進行分析。采用Softberry軟件預測紫色紅曲菌J01桔霉素合成基因簇中pksCT基因的結構及其編碼的氨基酸序列。采用美國國家生物技術信息中心(national center of biotechnology information,NCBI)中的Blast功能對預測的基因的氨基酸序列進行比對分析。采用蛋白數據庫Pfam預測基因所編碼蛋白的活性結構域。
1.3.3 桔霉素合成關鍵基因pksCT的敲除
通過聚合酶鏈式反應(polymerase chain reaction,PCR)擴增技術,使用表2中的引物對HygF/HygR克隆質粒pSKH上的潮霉素B抗性基因hph,分別使用引物對CITF1/CITR1和CITF4/CITR4克隆紫色紅曲菌J01基因組中桔霉素編碼區的815bp上游同源臂(5'-UTR)和850 bp下游同源臂(3'-UTR)。通過重疊延伸PCR[14]技術,將3個片段進行融合,即得到敲除盒。采用SacI和HindIII分別雙酶切敲除盒和雙元載體pCAMBIA3300,純化后的酶切產物經T4DNA連接酶連接,得到敲除載體PC-CIT,將敲除載體轉入根癌農桿菌(Agrobacterium tumefaciens)EHA105中,與紅曲菌J01孢子在28℃共培養3~10 d。
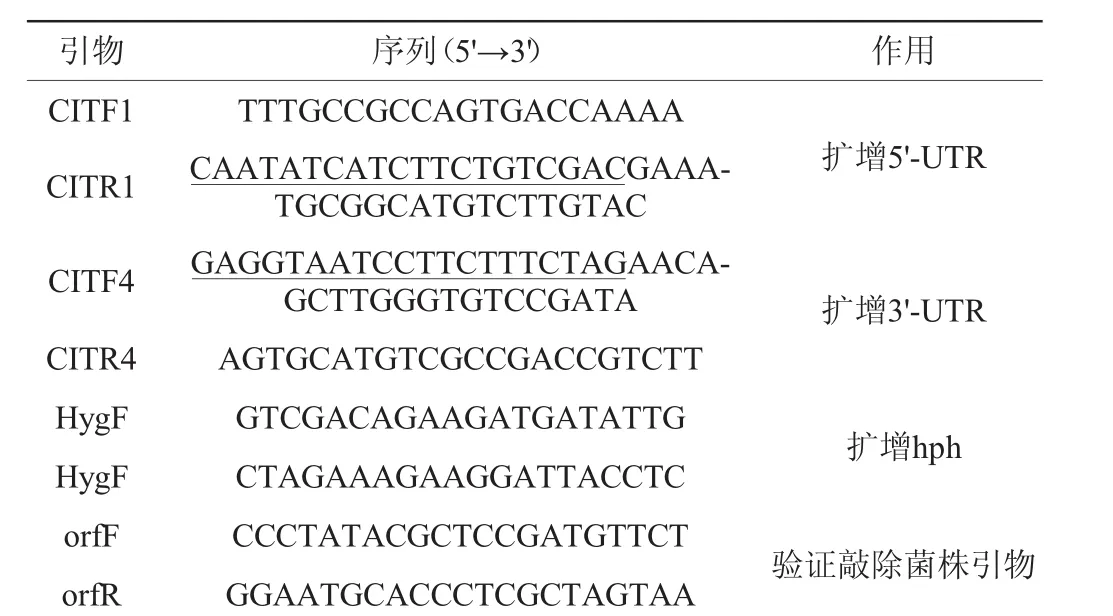
表2 本實驗使用的引物Table 2 Primers used in this experiments
1.3.4 基因敲除菌株的篩選與驗證
將基因敲除菌株接種到含有30 mg/L潮霉素的PDA平板上,28℃培養5 d,對菌株進行初步篩選。提取初步篩選到的基因敲除菌株的基因組DNA,以基因組DNA為模板,分別采用引物對HygF/HygR和orfF/orfRPCR擴增潮霉素抗性基因和orf基因片段,對基因敲除菌株進行驗證。
1.3.5 pksCT基因的Southern雜交驗證
在37℃條件下,利用限制性核酸內切酶XhoI酶切菌株J01和J42的基因組12 h,采用0.8%的瓊脂糖凝膠電泳10 h后轉移到Hybond+尼龍膜上,分別以hph基因(Probe 1)、pksCT基因的orf(Probe 2)作為探針在42℃條件下雜交16 h,進行免疫檢測與顯色。
1.3.6 菌落形態觀察
將紅曲菌J01和菌株J42接種到PDA斜面上,7d之后洗下孢子,制備孢子懸浮液并且將孢子懸浮液濃縮到106個/mL,接種1μL到PDA培養基上,28℃培養15d,觀察其菌落形態。
1.3.7 生物量測定
將菌株J01和J42按照1%(V/V)的接種量分別接種于40 mL PDB培養基中,于28℃,120 r/min條件下振蕩培養,發酵第15天時,將菌絲體和發酵液用濾布分離,并用蒸餾水多次洗滌菌絲體后將其轉移至已稱質量的離心管中,冷凍干燥至恒質量,計算菌絲體干質量。
1.3.8 桔霉素含量的測定
菌株的培養:按照1.3.7的方法進行培養。
桔霉素含量的測定:桔霉素的測定參考國標GB/T 5009.222—2016《紅曲類產品中桔青霉素的測定》中的免疫親和柱凈化-高效液相色譜法(high performance liquid chromatography,HPLC)進行測定分析。為使測定結果準確,將上述樣品按照文獻[15]報道的方法進行高效液相色譜串聯質譜(liquid chromatography tandem mass spectrometry,LC-MS/MS)分析。
1.3.9 紅曲色素色價的測定
菌株的培養:按照1.3.7的方法進行培養。
紅曲色素色價的測定:
(1)測定波長的選擇:紅曲色素主要由黃、橙、紅三種類型的色素組成,各類色素對應的最大光吸收波長在380nm、470 nm和520 nm附近,因此,分別選取380 nm、470 nm和520 nm波長處的吸光度值計算黃、橙、紅色素的色價。
(2)發酵液色素含量測定:用PDB培養基稀釋發酵液,使其吸光度值在0.15~0.80范圍內,分別測定波長380 nm、470 nm、520 nm處的吸光度值,按色價計算公式分別計算發酵液中黃、橙、紅色素的色價。
(3)菌絲體色素含量測定:取冷凍干燥的菌絲體0.01g,采用液氮研磨破碎后裝入2mL的離心管中,加入1mL體積分數為70%的乙醇水溶液,于60℃條件下水浴2h后,10000r/min離心5 min,取上清。用體積分數為70%的乙醇水溶液稀釋上清液,使其吸光度值在0.15~0.80范圍內,分別測定上清液在波長380 nm、470 nm、520 nm處的吸光度值,按色價計算公式分別計算菌絲體中黃、橙、紅色素的色價,其計算公式如下:
色價=A×總稀釋倍數。
式中:黃色素色價A為波長380 nm處的吸光度值;橙色素色價A為波長470 nm處的吸光度值;紅色素色價A為波長520 nm處的吸光度值。
(5)總色價:參考國標GB 1886.19—2015《食品安全國家標準食品添加劑紅曲米》中方法進行。
2 結果與分析
2.1 桔霉素合成相關基因的轉錄水平分析
在基因敲除之前,首先需要驗證潛在的目標基因是否能轉錄。據報道,紅曲菌桔霉素合成基因簇包括16個基因,分別為MRL7、MRL6、MRL5、MRL4、MRL3、MRL2、MRL1、pksCT、MRR1、MRR2、MRR3、MRR4、MRR5、MRR6、MRR7、MRR8,這些基因依次參與桔霉素的生物合成過程,且該合成過程已經基本清晰[10],因此,需要對所有與桔霉素合成相關的基因進行PCR擴增,分析其是否處于轉錄水平。以反轉錄得到的紫色紅曲菌J01的cDNA為模板,對紫色紅曲菌J01的桔霉素合成相關基因進行PCR擴增,結果見圖1。
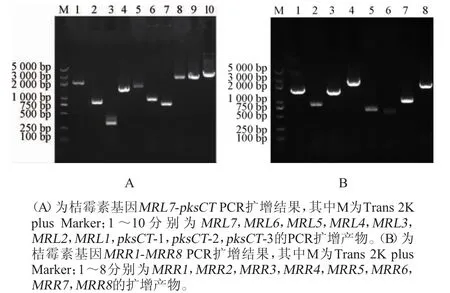
圖1 紫色紅曲菌J01桔霉素合成相關基因的PCR擴增結果Fig.1 PCR amplification results of citrinin-related syntetic genes fromM.purpureusJ01
由圖1可知,從紫色紅曲菌J01中克隆得到16個與桔霉素合成相關的基因,并且電泳條帶大小與表1預測結果基本一致,說明這些桔霉素合成相關基因處于轉錄水平。PCR產物送去(測序公司)測序,經序列分析,結果表明,紫色紅曲菌J01來源的16個與桔霉素合成相關基因與目前公布的桔霉素合成基因序列基本一致,進一步說明這些基因正常的參與桔霉素的合成,可被選擇為基因敲除對象。
2.2 紫色紅曲菌J01中pksCT基因的結構分析
根據目前報道的桔霉素生物合成途徑,pksCT基因編碼的蛋白為一種聚酮合酶(PKS),是合成桔霉素的關鍵酶,因此,分析了紫色紅曲菌J01中的pksCT基因。從J01菌株的cDNA中克隆得到pksCT基因,全長共7 521 bp,編碼2 435個氨基酸,其氨基酸序列與文獻報道的紫色紅曲菌中控制桔霉素生物合成的PKS(GenBank:BAD44749.1)序列覆蓋度達100%,相似度為95%。
通過Pfam軟件預測pksCT蛋白的結構域,結果如圖2所示。由圖2可知,pksCT蛋白包含多個關鍵的結構域,如起始單元酰基載體蛋白質轉酰基酶(starter unit acyl carrier protein transacylase,SAT)、β-酮基合成酶(β-ketosynthase,KS)、酰基轉移酶(acyltransferase,AT)、產物模板(product template,PT)、甲基轉移酶(methyltransferase,CMeT)、酰基載體蛋白(acyl carrier protein,ACP)、還原酶(reductase,R)。聚酮合酶(PKS)中這些結構域的功能各不相同,如:KS主要負責催化前體的縮合反應,使得聚酮鏈得以延長;AT主要負責前體的選擇;ACP主要負責前體和中間體的共價結合。聚酮合酶中KS、AT、ACP三個結構域是絕大部分PKS功能所必須的[16]。因此,敲除的目標基因片段至少要包括這三個部分,才能夠確保pksCT基因不再發揮功能。
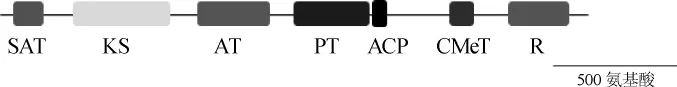
圖2 pksCT蛋白結構域分析Fig.2 Analysis of pksCT protein structural domain
2.3 桔霉素合成關鍵基因pksCT的敲除
采用根癌農桿菌介導的T-DNA轉化技術,利用紅曲菌自身的同源重組系統實現pksCT基因的敲除。首先通過PCR擴增驗證敲除載體是否轉化至根癌農桿菌,驗證結果見圖3A。由圖3A可知,在農桿菌中,存在5'-同源臂、hph抗性基因、3'-同源臂以及敲除盒的片段,并且條帶大小符合預期,說明敲除載體成功轉化到根瘤農桿菌中。
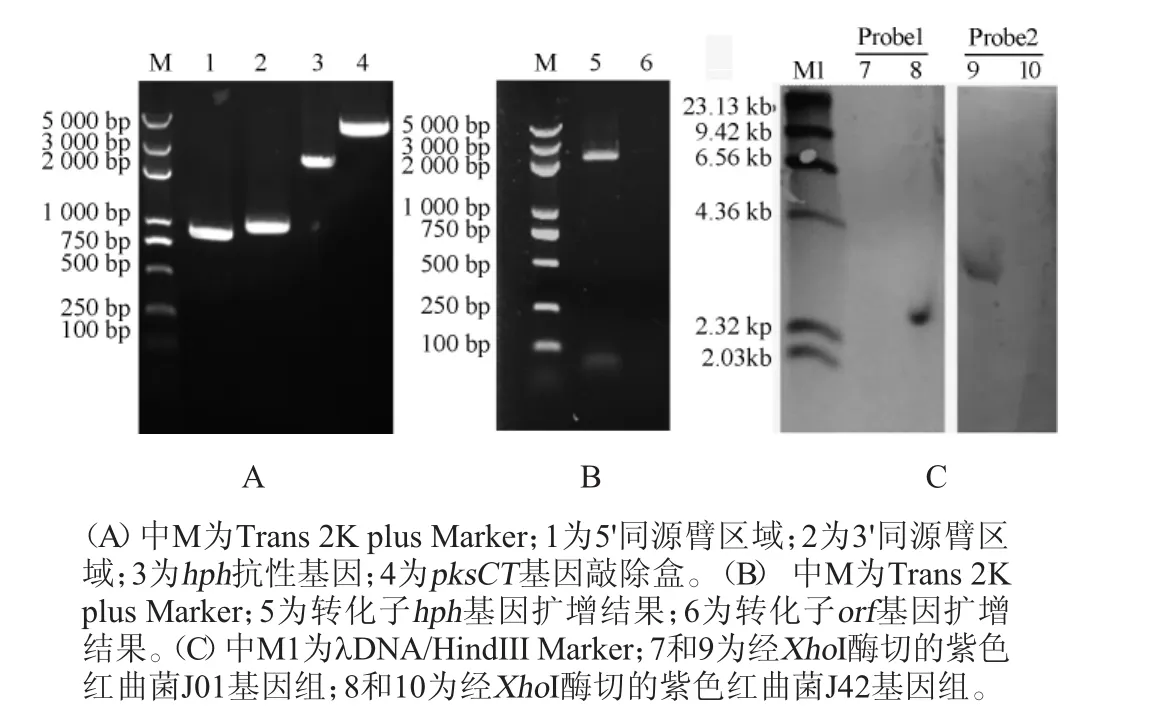
圖3 pksCT基因敲除載體擴增驗證(A)及菌株J42的PCR擴增結果(B)和Southern blot驗證(C)Fig.3 Verification ofpksCTgene deletion cassette amplication(A)and PCR amplication results of strain J42(B)and Southern blot verification(C)
然后通PCR擴增驗證紫色紅曲菌中的pksCT基因是否被敲除,PCR擴增結果見圖3B,由圖3B可知,PCR擴增得到了2.1 kb的唯一條帶,未擴增到缺失的orf基因,因此,可以將該菌株初步鑒定為敲除菌株,命名為J42。
最后,進一步對該基因敲除菌株進行Southern雜交驗證,結果如圖3C所示。由圖3C可知,以hph基因(Probe1)為探針,在敲除菌株中出現了單一雜交帶,而以orf基因(Probe2)為探針,則未出現雜交帶,說明pksCT基因已被抗性基因hph替換,且hph以單拷貝的形式存在于菌株J42中,說明菌株J42成功敲除pksCT基因。
2.4 基因敲除菌株與原始菌株的生長情況比較
菌落形態比較:將原始紅曲菌株J01和基因工程菌株J42點接到PDA培養基上,28℃培養15 d,觀察菌落形態,結果如圖4所示。由圖4可知,菌株J42的菌落顏色呈橙黃色,菌落直徑為6.8 cm,與原始菌株J01相比,無明顯差異,說明其生長情況較為一致。
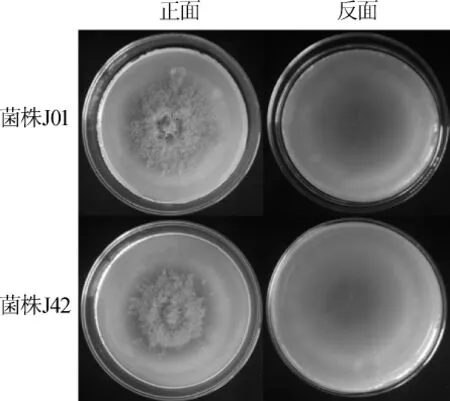
圖4 紫色紅曲菌株J01和J42菌落形態Fig.4 Colony morphology ofM.purpureusJ01 and J42
生物量比較:紅曲菌株J01和J42經PDB培養基培養15d,對菌絲體的生物量進行測定。菌株J42生物量為4.43g/L,菌株J01的生物量為4.12g/L,兩者之間無顯著性差異(P>0.05),進一步說明pksCT基因的缺失紅曲菌株的生長無顯著性影響。
2.5 桔霉素含量及紅曲色素色價的測定
2.5.1 桔霉素含量的測定
采用免疫親和柱凈化-高效液相色譜法測定菌株J01和J42菌絲體的桔霉素含量,結果見圖5。由圖5可知,紫色紅曲菌J01的桔霉素產量為5.1mg/kg。pksCT基因敲除后,菌株J42敲除菌株未檢出桔霉素,為進一步驗證實驗結果,對樣品進行了LC-MS/MS分析,其對桔霉素的檢出限為1.0 μg/kg,仍未檢測到桔霉素,并且在發酵液中也未檢測到桔霉素,說明pksCT基因的缺失阻斷了桔霉素的合成,這與SHIMIZUT等[17-18]的研究結果一致。
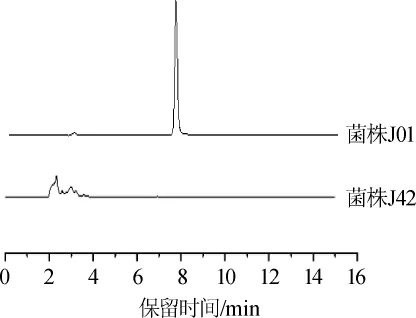
圖5 紫色紅曲菌J01和J42桔霉素產量的HPLC分析結果Fig.5 HPLC analysis results of citrinin yield ofM.purpureusJ01 and J42
2.5.2 紅曲色素色價的測定
采用紫外分光光度法,分別測定了紫色紅曲菌J01和J42發酵液和菌絲體色價,結果如圖6所示。由圖6可知,在發酵液中(圖6A、6C、6E),菌株J42的色價分別為0.93 U/mL、0.31U/mL、0.24U/mL,較J01相比無顯著性差異(P>0.05),在菌絲體中(圖6B、6D、6F),菌株J42的黃色素、橙色素和紅色素色價分別為1 877 U/g、773 U/g、1 068 U/g,顯著高于菌株J01(P<0.01),說明pksCT基因的缺失不會降低菌株的產色素能力。從總色價來看,敲除菌株J42的總色價為415 U/mL,是原始菌株的1.56倍,分析原因可能是pksCT基因敲除后,用于合成桔霉素的大部分能量供給了色素合成,促進了色素產量的提高。

圖6 紫色紅曲菌J01和J42菌株發酵液(A,C,E)和菌絲體(B,D,F)色價的比較Fig.6 Comparison of the color value in fermentation broth(A,C,E)and mycelium(B,D,F)ofM.purpureusJ01 and J42
3 結論
本研究在前期發現的一株高產紅曲色素的紫色紅曲菌J01基礎上,基于桔霉素合成基因序列測序與分析,依據桔霉素生物合成途徑,選擇聚酮合酶pksCT基因為敲除對象,通過基因工程方法成功將紫色紅曲菌J01基因組上的pksCT基因敲除,構建工程菌株J42。通過菌落形態觀察和生物量的測定,得出菌株J42與原始菌株J01的菌落形態及生物量無顯著性差異(P>0.05)。通過HPLC和LC-MS/MS檢測得出,菌株J42不產桔霉素,且紅曲色素總色價為415 U/mL,較原始菌株J01提高1.56倍。所以,本研究成功構建一株不產桔霉素高產紅曲色素的基因工程紅曲菌株J42。
[1]CHEN W,HE Y,ZHOU Y,et al.Edible filamentous fungi from the speciesMonascus:early traditional fermentations,modern molecular biology,and future genomics[J].Compreh Rev Food Sci Food Safety,2015,14(5):555-567.
[2]FENG Y L,SHAO Y C,ZHOU Y X,et al.Effects of glycerol on pigments and monacolin K production by the high-monacolin K-producing but citrinin-free strain,Monascus pilosusMS-1[J].Eur Food Res Technol,2015,240(3):635-643.
[3]楊 洋,陳 冬,達文燕,等.紅曲、紅曲霉和紅曲色素[J].生物學通報,2017,52(7):1-3.
[4]周文斌,賈瑞博,李 燕,等.紅曲色素組分、功效活性及其應用研究進展[J].中國釀造,2016,35(7):6-10.
[5]BLANC P J,LAUSSAC J P,BARS J L,et al.Characterization of monascidin A fromMonascusas citrinin[J].Int J Food Microbiol,1995,27(2-3):201-213.
[6]蔣冬花,馮青青,任 浩,等.高產莫納可林K低產桔霉素紅曲霉菌株的篩選和發酵條件初步優化[J].微生物學雜志,2016,36(6):10-16.
[7]XIONG X,ZHANG X,WU Z,et al.Optimal selection of agricultural products to inhibit citrinin production during submerged culture of Monascus anka[J].Biotechnol Bioproc Eng,2014,19(6):1005-1013.
[8]YANGJ,CHENQ,WANGW,et al.Effect ofoxygen supplyonMonascus pigments and citrinin production in submerged fermentation[J].J Biosci Bioeng,2015,119(5):564-569.
[9]WAN Y,ZHANG J,HAN H,et al.Citrinin-producing capacity of Monascus purpureusin response to low-frequency magnetic fields[J].Process Biochem,2017,53:25-29.
[10]HE Y,COX R J.The molecular steps of citrinin biosynthesis in fungi[J].Chem Sci,2016,7(3):2119-2127.
[11]季宏飛.紅色紅曲菌pksCT基因缺失株的構建及其固液態發酵生產紅曲色素的研究[D].南昌:南昌大學,2008.
[12]許楚旋,任 浩,章 婷,等.高產紅曲色素低產桔霉素紫色紅曲霉轉化子篩選與代謝產物分析[J].山西農業科學,2016,44(3):318-322.
[13]丁曉莉.紅色紅曲菌M7聚酮合酶與氧化還原酶在米曲霉中的異源共表達研究[D].武漢:華中農業大學,2015.
[14]YU J H,HAMARI Z,HAN K H,et al.Double-joint PCR:a PCR-based molecular tool for gene manipulations in filamentous fungi[J].Fung Genet Biol,2004,41(11):973-981.
[15]JI X,XU J,WANG X,et al.Citrinin determination in red fermented rice products by optimized extraction method coupled to liquid chromatography tandem mass spectrometry(LC-MS/MS)[J].J Food Sci,2015,80(6):1438-1444.
[16]ALICE Y C,NATHAN A S,KIM C Y,et al.Extender unit and acyl carrier protein specificity of ketosynthase domains of the 6-deoxyerythronolide B synthase[J].J Am Chem Soc,2006,128(9):3067-3074.
[17]SHIMIZU T,KINOSHITA H,ISHIHARA S,et al.Polyketide synthase gene responsible for citrinin biosynthesis inMonascus purpureus[J].Appl Environ Microbiol,2005,71(7):3453-3457.
[18]FU G,XU Y,LI Y,et al.Construction of a replacement vector to disrupt pksCTgene for the mycotoxin citrinin biosynthesis inMonascus aurantiacus and maintain food red pigment production[J].Asia Pac J Clin Nutr,2007,16(S1):137-142.

