馬鈴薯塊莖花色素苷合成相關R2R3 MYB蛋白基因的克隆和功能分析
談 歡 劉玉匯,* 李麗霞 王 麗 李元銘 張俊蓮,*
1 甘肅省作物遺傳改良與種質創(chuàng)新重點實驗室 / 甘肅農業(yè)大學園藝學院 / 甘肅省干旱生境作物學重點實驗室, 甘肅蘭州 730070;
2甘肅農業(yè)大學生命科學技術學院, 甘肅蘭州 730070
花色素苷是一類以花色基元為基本結構的水溶性色素, 主要分為飛燕草色素、芍藥色素和天竺葵色素等[1]。它們不僅可以使植物呈現出不同的色彩,還有助于昆蟲的傳粉、植物生長素的運輸以及保護葉片免受紫外線損傷, 同時具有抑制病蟲害等重要的作用。此外, 它還具有抗癌、抗氧化等保健作用和藥用價值[2], 因此近年來備受人們的關注。
花色素苷是類黃酮類次生代謝物質, 合成前體為苯丙氨酸。苯丙氨酸經苯丙氨酸裂解酶(PAL)、查爾酮合成酶(CHS)、查爾酮異構酶(CHI)、黃烷酮-3-羥基化酶(F3H)、黃烷酮-3'-羥基化酶(F3'H)、二氫黃酮醇還原酶(DFR)、花色素苷合成酶(ANS)或無色花色素雙加氧酶(LDOX)形成不穩(wěn)定的花色素苷, 再經類黃酮3-0-葡萄糖基轉移酶(UFGT)催化生成穩(wěn)定的花色素苷[3-4]。研究證實, 參與花色素苷合成的調控因子包括R2R3 MYB蛋白、bHLH蛋白和WD40蛋白三大類轉錄因子, 其中R2R3 MYB為最重要的轉錄因子, 其調控花色素苷合成已在蘋果和葡萄上證實[5-6]。R2R3 MYB中R2和R3基序能夠特異性識別DNA序列, R3 C端的螺旋結構能特異結合目標基因啟動子區(qū)順式作用元件中的核心序列[7]。植物bHLH轉錄因子能調控花器官發(fā)育和激素應答等[8-9],其最重要的功能是調節(jié)類黃酮和花色素苷的合成。
R2R3 MYB蛋白調控植物花色素苷的合成已在果樹[10]、小麥[11]、擬南芥[12]、甘蔗[13]等植物中報道, 例如, 蘋果R2R3 MYB蛋白中的MdMYB10使DFR基因表達量上調[14], MdMYBA使ANS的轉錄水平提高[15], MdMYB1激活結構基因UFGT和DFR,從而提高了蘋果花色素苷的含量[16]; 油桃中分離的MYB10能夠正向調控DFR基因的表達, 促進花青素在果實中大量積累[17]; 擬南芥 AtMYB75轉錄因子調控花色素苷的生物合成, 其異位表達促進類黃酮類物質生物合成相關基因的表達, 導致植物的大多數器官呈現紫色[18-20]。
馬鈴薯中有 117個 MYB類轉錄因子, 其中R2R3型MYB數量最多, 它參與植物次生代謝調控、激素刺激和環(huán)境脅迫應答等過程[21], R2R3 MYB轉錄因子能夠調控馬鈴薯薯皮和葉片中花色素苷合成途徑結構基因的表達, 從而促進花色素苷的積累[22-23]。生物或非生物因素均能影響花色素苷的生物合成,光照強度與StCHS、StDFR和StR2R3-MYB的表達正相關; 環(huán)境溫度與StPAL、StDFR和StR2R3-MYB的表達負相關[24-28]。本試驗以彩色四倍體馬鈴薯為研究對象, 分離了3個馬鈴薯R2R3 MYB基因, 并以煙草為受體進行穩(wěn)定遺傳轉化, 利用 qPCR進行轉基因煙草葉片中與花色素苷合成相關基因和轉錄因子的相對表達分析, 并分析 3個同源基因的功能。本研究為進一步探究馬鈴薯塊莖花色素苷合成的調控機制以及人工調控馬鈴薯塊莖花色素苷合成提供理論和方法。
1 材料與方法
1.1 試驗材料和試劑
馬鈴薯品種 “新大坪”(XD: 白皮白肉)、“黑美人”(HM: 紫皮紫肉)、“甘農薯5號”(GN: 紅皮白肉)和“青薯9號”(QS: 紅皮白肉, 紅色的維管束), 均在甘肅農業(yè)大學溫室內種植。其中 GN由甘肅農業(yè)大學培育, HM和XD是甘肅省當地栽培品種, QS由青海省農林科學院培育。分別在塊莖收獲期采集 4個品種薯皮和薯肉, 立即放入液氮速凍, 于–80℃冰箱保存?zhèn)溆谩R吧蜔煵萦筛拭C省作物遺傳改良與種質創(chuàng)新重點實驗室提供。
大腸桿菌 DH5α感受態(tài)細胞和 pGEM-T Easy Vector載體(抗性標記為氨芐青霉素)購自 Promega公司; 限制性內切酶、T4 DNA連接酶和TaqDNA聚合酶購自TaKaRa公司; PureLink Plant RNA Reagent Kit購自 Invitrogen公司; QuantiTect Reverse Transcription Kit購自Qiagen公司; DNA凝膠回收試劑盒購自北京天根公司; 其他生化試劑均為國產分析純。
1.2 3個StAN1基因編碼序列的克隆
將已報道的馬鈴薯StAN1的基因序列(AY841129)作為參考序列[29], 利用Oligo6設計引物StAN1-F (5′-ATGAGTACTCCTATGATGTGTA- 3′)和StAN1-R (5′-CTAATTAAGTAGATTCCATATATC-3′),克隆4個品種StAN1基因的編碼序列。用PureLink Plant RNA Reagent Kit試劑盒分別抽提4種馬鈴薯薯皮薯肉的總RNA。用Nanodrop ND-1000分光光度計(Thermofisher公司, 美國)測定 RNA純度和濃度, 并用 1%瓊脂糖凝膠電泳鑒定其完整性。利用QuantiTect Reverse Transcription Kit試劑盒進行反轉錄, 其中以Oligo(dT)20為引物, 在M-MLV反轉錄酶作用下合成cDNA第1鏈, 并在–20℃下保存。
PCR反應體系是由cDNA模板2 μL、10×buffer 2.5 μL、10 mmol L–1的上下游引物各 1 μL、TaqDNA聚合酶0.5 μL、ddH2O 18 μL組成。反應程序為94℃預變性5 min; 94℃變性50 s, 57℃退火50 s, 72℃延伸1 min, 35個循環(huán); 72℃延伸10 min。用1%瓊脂糖凝膠電泳檢測擴增產物。
將擴增得到的目的片段用瓊脂糖凝膠試劑盒回收純化, 并分別與 pGEM-T Easy Vector載體連接,轉化大腸桿菌 DH5α感受態(tài)細胞, 對所獲得的白斑通過滯后質粒、PCR擴增、EcoR I酶切鑒定后, 于–80℃下保存, 并將陽性克隆送到生工生物工程(上海)有限公司進行DNA測序驗證。
1.3 馬鈴薯 StAN1轉錄因子家族成員的生物信息學分析
用在線軟件 Expasy (http://au.expasy.org/tools/)中提供的ProtParam和ProtScale分別進行蛋白質分子式、分子量、等電點、脂肪系數、不穩(wěn)定系數和氨基酸親疏水性的分析, 用 SOPMA (https://npsaprabi.ibcp.fr/cgi-bin/npsaautomat.pl?page=npsa_sopma.html)預測蛋白質的二級結構。使用在線分析軟件InterPro: protein sequence analysis & classification(http://www.ebi.ac.uk/interpro/)進行保守性功能域分析。
以StAN1-R0為參比序列, 通過NCBI在線比對(http://blast.ncbi.nlm.nih.gov/Blast.cgi), 找出與其同源性較高的其他物種的氨基酸序列, 通過Clustal X2和 DNAMAN軟件進行氨基酸序列比對, 利用MEGA5.0軟件構建系統(tǒng)進化樹。
1.4 農桿菌介導葉盤法共轉化煙草及表達分析
利用EcoR I酶切位點將StAN13個同源基因的全長片段重組到植物表達載體pSAK277中, 再將構建體轉入農桿菌。使用農桿菌介導葉盤法[30]將StAN1-R0、StAN1-R1和StAN1-R3基因轉化到野生型煙草中, 通過 Kan抗性篩選和顏色判定初步篩選陽性抗性苗。根據特異性引物(F1: 5′-GGCCACATATC AAGAGAGGTGACTTTG-3′, R1: 3′-TCACATCGTT AGCTGTCCTTCCTGG-5′)對所對應的目的基因進行PCR擴增鑒定, 分別用1.5%瓊脂糖電泳檢測擴增產物, 根據鑒定結果最終獲得轉StAN1-R0、StAN1-R1和StAN1-R3基因的煙草株系分別為6、9和7株。
1.5 利用qPCR分析轉基因煙草中MYB基因的相對表達
分別提取轉StAN1-R0、 StAN1-R1和StAN1-R3基因煙草葉片的總RNA, 反轉錄獲得的cDNA作為qPCR擴增模板, 根據特異性設計qPCR引物(表1)。以NtEF-1α基因(序列號為 D63396)為內參, 在Mx3005p型實時熒光定量PCR儀中進行定量分析。反應體系包含濃度為 50 ng μL–1的 cDNA 2.0 μL、上下游引物 0.4 μL、Nuclease-Free Water 7.2 μL 和 GoTaqqPCR Master Mix 10 μL。反應程序為95℃預變性5 min; 95℃變性5 s, 60℃退火5 s, 72℃延伸10 s,循環(huán) 40次。每個樣品重復 3次, 反應結束后采用2–ΔΔCT[31]法分析數據。
1.6 轉基因煙草中花色素苷平均含量的分析
將不同轉基因煙草葉片樣品在液氮中充分研磨,取0.5 g轉至5 mL的離心管, 加入酸性甲醇提取液至滿管, 混勻, 4℃下黑暗放置24 h, 離心, 上清液轉入 25 mL的容量瓶, 殘渣中加入酸性甲醇提取液,懸浮混勻, 4℃下黑暗放置12 h, 離心取上清液。重復以上步驟 1次, 最后將浸提液定容至 25 mL。在400~800 nm 可見光的波長范圍內進行紫外-可見光吸收光譜的掃描, 確定其在可見光區(qū)的最大吸收波長。取1 mL花色苷提取液, 分別加入pH 1.0氯化鉀緩沖液和pH 4.5醋酸鈉緩沖液9 mL, 室溫平衡1 h,蒸餾水做空白對照, 分別在λmax和λ700下測定吸光值,代入公式計算花色素苷總含量[32-33], 最后求其花色素苷含量平均值。
2 結果與分析
2.1 StAN1基因序列的克隆和分析
從圖1可以看出, 總RNA的28S和18S條帶完整、清晰, 表明RNA的完整性良好。
以cDNA為模板, 通過PCR擴增, 從4個馬鈴薯品種的薯皮和薯肉中分別獲得了長度為735、777和837 bp的完整片段(圖2)。根據C端10個氨基酸序列組成的重復結構(R: TIAPQPQEGI)數目的不同(圖3), 分別命名為StAN1-R0、StAN1-R1和StAN1-R3(GenBank登錄號依次為AKA95391、AKA95392和AKA95392)。其中在WS中含有StAN1-R0, WF中含有StAN1-R1; PS和PF只含有StAN1-R1; RS1、RS2、WF1、WF2和WFV中含有StAN1-R3。序列比對分析發(fā)現這 3個序列間的同源性達到 88.85%。StAN1-R0、StAN1-R1、StAN1-R3與參考序列(AY841129)的同源性分別為 87.98%、94.57%和90.29%;StAN1-R0與StAN1-R1、StAN1-R3的同源性分別為 89.15%和 82.37%;StAN1-R1與StAN1-R3的同源性為89.57%, 二者同源性最高。

表1 定量PCR分析的引物序列Table 1 Primer sequences for qRT-PCR in this study
圖1 總RNA的電泳圖Fig. 1 Electrophoresis of the total RNA
2.2 馬鈴薯StAN1基因的生物信息學分析
2.2.1 馬鈴薯StAN1基因編碼蛋白質的一級結構預測 通過在線工具ExPASy中的ProtParam預測馬鈴薯StAN1基因編碼蛋白質的一級結構, 蛋白質分子式分別為 C1227H1936N362O365S14、C1284H2019N377 O390S15和 C1371H2164N402O423S15, 分子量分別為28 047.91、29 458.35和 31 527.60 Da。等電點(pI)分別為8.39、6.90和6.14, 等電點的差異表明, 3個同源基因與其他植物的MYB基因在編碼蛋白質穩(wěn)定性、功能或者調控方式上有所差異[34]。3個蛋白質分別有負電荷殘基(Asp+Glu) 30、32和34個, 正電荷殘基(Arg+Lys) 33、32和32個。蛋白質三維結構不
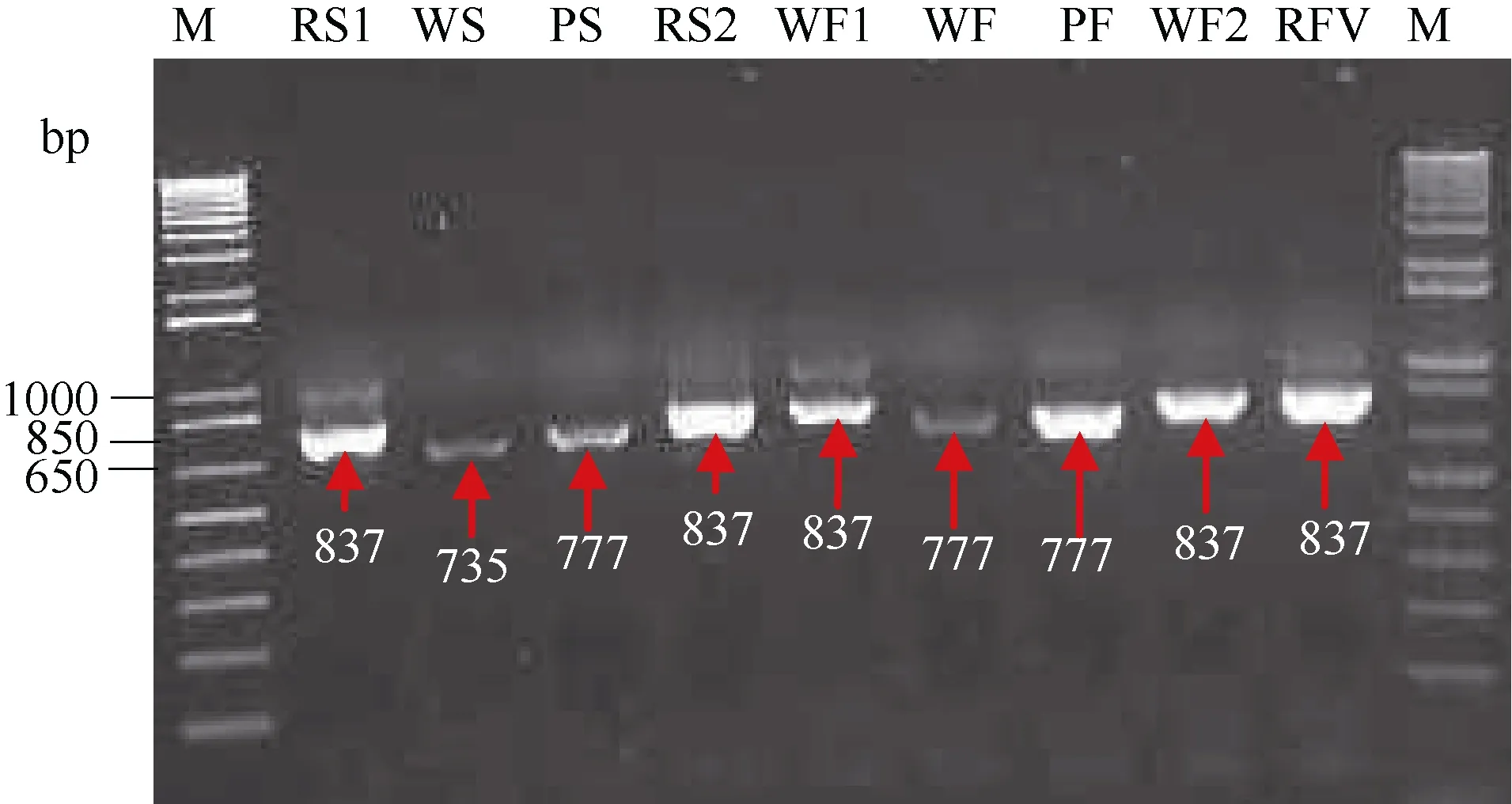
圖2 基因克隆過程的PCR產物電泳圖Fig. 2 PCR map of gene cloning

圖3 序列比對圖Fig. 3 Sequence comparison chart
穩(wěn)定系數(II)分別為46.97、48.64和50.76, 平均疏水性(GRAVY)分別為-0.693、-0.720 和-0.712, 脂肪系數分別為(AI)為79.14、74.88和76.15。蛋白質不穩(wěn)定系數均大于40, 三者表現為不穩(wěn)定狀態(tài)[35](表2)。
2.2.2 馬鈴薯StAN1基因編碼蛋白質的疏水性/親水性的預測和分析 蛋白質的疏水性可根據蛋白質的平均疏水性(GRAVY)值來預測, 當 GRAVY 大于 0時, 為疏水蛋白; 當GRAVY小于0時, 為親水蛋白[36]。
根據 ProtScale軟件預測, 三者的平均疏水性GRAVY均小于0 (表2), 故推測馬鈴薯R2R3 MYB蛋白均為親水蛋白。
2.2.3 馬鈴薯StAN1基因編碼蛋白質的二級結構的預測和分析 根據SOPMA軟件預測, 3種馬鈴薯StAN1基因編碼的蛋白質均由α-螺旋、β-螺旋、無規(guī)則卷曲和延伸鏈組成。3個蛋白均為無規(guī)則卷曲>α-螺旋>延伸鏈>β-螺旋(表 3)。

表2 馬鈴薯StAN1基因編碼蛋白質的一級結構預測Table 2 Primary structure prediction of potato StAN1 gene encoding proteins
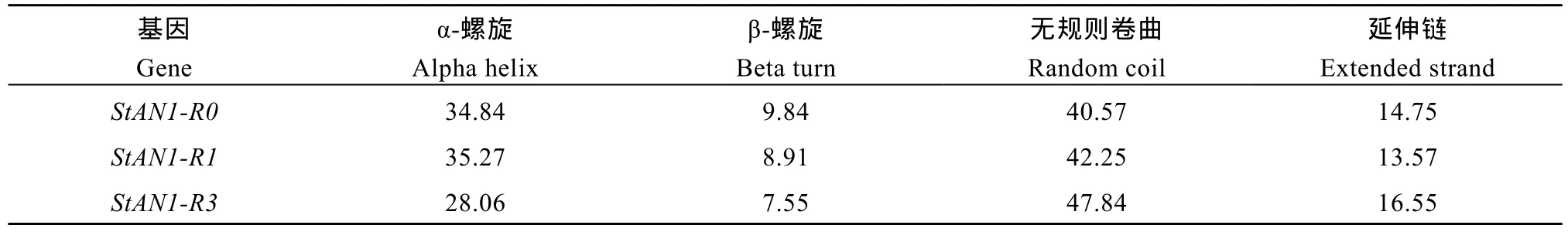
表3 StAN1基因編碼蛋白質的二級結構分析Table 3 Secondary structure analysis of StAN1 gene encoding protein (%)
2.2.4 馬鈴薯StANI-R0、StANI-R1和StANI-R3氨基酸同源性分析 多重序列比對結果顯示, 這 3個同源基因的編碼區(qū)均含高度保守的R2和R3 MYB結構域, 分別由48個和46個氨基酸組成, 該結構域與來自茄科植物和其他科屬植物 MYB轉錄因子的保守結構域具有很高的同源性(圖4)。系統(tǒng)進化分析表明, 與StAN1-R0智利番茄和多毛番茄同源基因相似性最高, 同源性為 53.0%; 與單子葉植物玉米和水稻同源基因相似性較低, 分別為33.2%和29.3% (圖5)。
2.2.5 轉StAN1基因煙草的鑒定及其花色素苷平均含量的分析 轉目的基因StAN1的煙草葉片顏色呈現紅色, 而CK的葉片為綠色, 轉基因煙草的葉片和葉脈顏色深度分別為StAN1-R1>StAN1-R0>StAN1-R3(圖 6-a, b)。對轉基因煙草植株進行目的基因的PCR鑒定, 結果進一步證實 3個目的基因已成功轉入野生型煙草中(圖7)。分別取轉StAN1基因煙草和CK各3個株系的葉片測定花色素苷的含量發(fā)現, 轉基因煙草葉片的花色素苷含量均明顯高于CK, 且3個轉基因煙草之間的花色素苷含量差異顯著(圖 8),轉StAN1-R1煙草葉片中花色素苷平均含量最高, 為
124.46 mg g–1FW,StAN1-R3中平均含量最低, 為89.51 mg g–1FW, 與表型相一致。
2.2.6 轉基因煙草中花色素苷合成關鍵基因的表達分析 從圖9-A可以看出, 外源基因StAN1在轉基因煙草中顯著上調表達, 且 3個基因的表達量之間無顯著差異, 而在對照煙草中檢測不到StAN1, 進一步說明外源基因StAN1已導入到煙草中。與 CK相比, 轉StAN1-R0、StAN1-R1和StAN1-R3基因煙草中參與花色素苷合成的相關基因表達量大幅上調,包括合成途徑中的早期表達基因NtCHS、NtCHI、NtF3H、NtF3’H和晚期表達基因NtDFR、NtANS、NtUFGT。其中NtDFR和NtANS在轉StAN1-R1煙草中的表達量顯著高于轉StAN1-R0和StAN1-R3煙草中的。此外, 與CK相比, 轉StAN1-R0,StAN1-R1和StAN1-R3煙草葉片中內源 NtbHLH轉錄因子(NtAN1a和NtAN1b)的相對表達量均大幅度上調(圖9-B~I), 說明 3個目的基因的轉入顯著增強了NtbHLH基因的表達, 其中StAN1-R1對其調控能力最強, StAN1-R3的調控能力最弱, StAN1-R0的調控能力介于兩者之間。

圖4 一些茄科植物與其他科屬植物的R2R3 MYB氨基酸序列多重比對Fig. 4 Multiple alignment of amino acid sequence of R2R3 MYB in some solanaceae plants and other subfamily
3 討論
四倍體馬鈴薯的栽培種遺傳背景復雜, 不同品種的彩色馬鈴薯所合成花色素苷的種類和數量也不同。MYB是參與調控植物花色素苷合成中涉及最廣泛的轉錄因子, 研究者已在多種植物中克隆分離出大量的與花色素苷合成積累有關的 MYB轉錄因子,且對其研究較為深入[37]。植物 MYB蛋白的結構域高度保守, 該結構域通常包括 1~4個重復的氨基酸R基序, 根據R基序的數量分為R1 MYB蛋白、R2R3 MYB蛋白、R1R2R3 MYB蛋白和4R MYB蛋白[10],其中R2R3 MYB在參與調控不同植物以及同種植物不同組織器官中的花色素苷合成與積累中尤為重要[38]。研究發(fā)現, 在馬鈴薯紅色薯皮和紫色薯皮中表達的基因D是二倍體馬鈴薯薯皮花色素苷合成的轉錄調控基因, 其編碼 R2R3 MYB-StAN1轉錄因子[25]。StAN1不僅調控薯皮顏色, 而且與 StJAF13轉錄因子協(xié)同調控馬鈴薯紅葉品種“Magenta Love”的葉片
顏色; 在另一個紅葉品種‘Double Fun’中, StbHLH1轉錄因子與StAN1和StJAF13共同調控葉片顏色[23]。
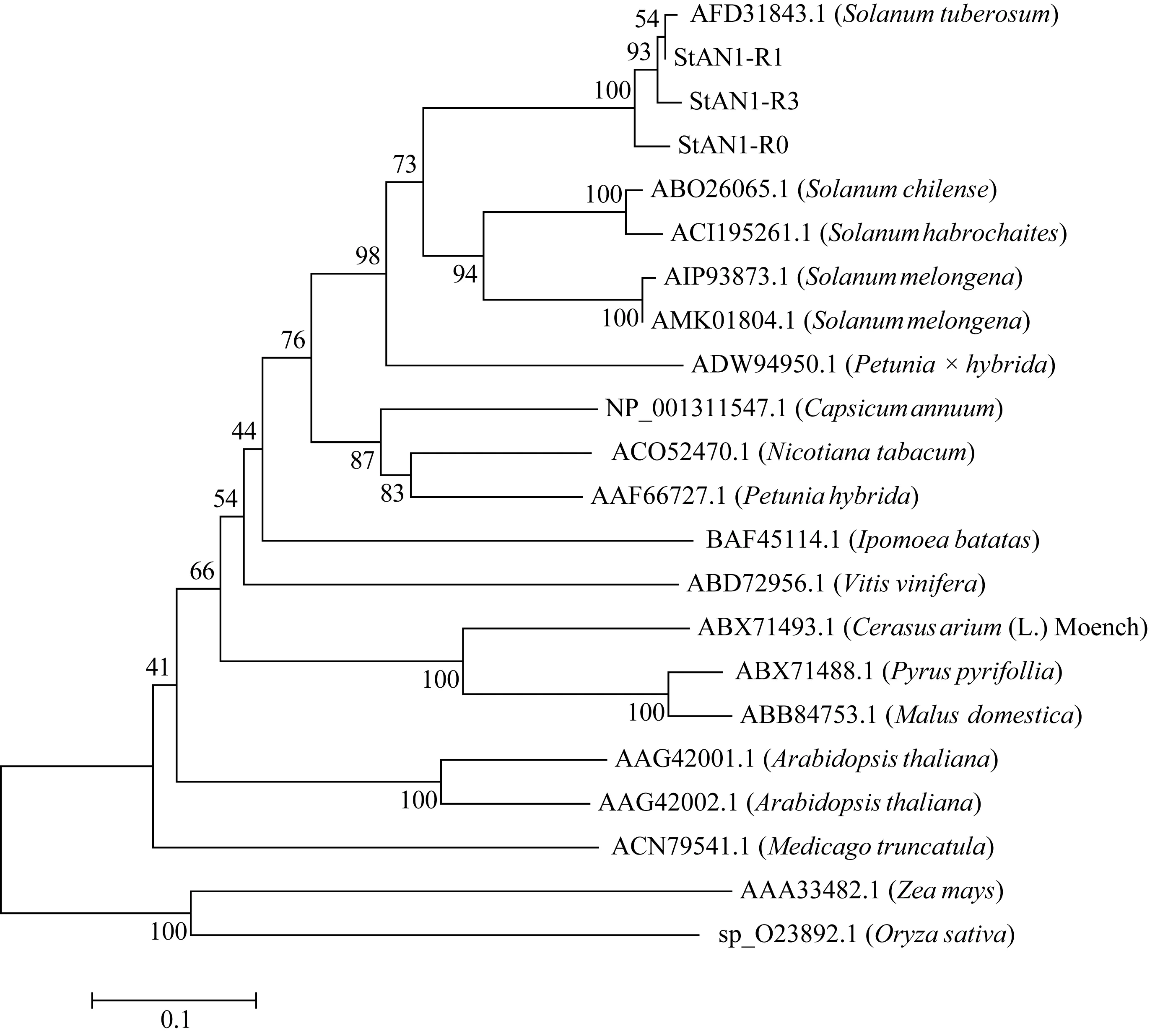
圖5 StAN1基因與一些茄科和其他植物R2R3 MYB轉錄因子家族氨基酸序列的系統(tǒng)進化樹分析Fig. 5 Phylogenetic tree analysis of the amino acid sequence of StAN1 genes and some R2R3 MYB transcription factor families in solanaceae and other plants

圖6 轉StAN1基因煙草的表型分析Fig. 6 Phenotypic analysis of StAN1 transgenic tobaccoa: 轉StAN1基因煙草的整株; b: 轉StAN1基因煙草的葉片。a: whole plant of StAN1 transgenic tobacco; b: leaves of StAN1 transgenic tobacco.
圖7 轉StAN1基因煙草的PCR鑒定Fig. 7 PCR identification of StAN1 transgenic tobacco

圖8 轉StAN1基因煙草與對照的花色素苷平均含量Fig. 8 Average content of anthocyanin in StAN1 transgenictobacco and control
本實驗從不同顏色的四倍體馬鈴薯塊莖中克隆分離了StAN1的 3個同源基因, 通過序列比對分析發(fā)現其區(qū)別在于 C末端 3個重復序列數目(R)不同,根據 R數目分別命名為StAN1-R0、StAN1-R1和StAN1-R3。通過進一步轉化煙草分析發(fā)現,StAN1-R0、StAN1-R1以及StAN1-R3均顯著調控煙草葉片花色素苷合成相關的結構基因, 使煙草葉片明顯積累花色素苷從而呈現紅色, 其中含有一個重復序列R的StAN1-R1調控能力最強, 煙草葉片呈現深紅色, 花色素苷含量積累最多, StAN1-R3調控能力最弱, 說明R在StAN1調控花色素苷能力方面具有重要功能。
另有研究表明, MYB轉錄因子需要與其他轉錄因子結合協(xié)同調控花色素苷的合成[39-40]。本研究發(fā)現轉StAN1-R0、StAN1-R1和StAN1-R3煙草葉片中NtbHLH基因顯著上調表達, 說明外源基因StAN1導入煙草后可以激活煙草內源轉錄因子NtbHLH的表達, 其表達量在轉StAN1-R1煙草中最高, 在轉StAN1-R3煙草中最低, 與煙草葉片中花色素苷含量相一致, 因此推測 NtbHLH也是調控花色素苷合成的重要轉錄因子, StAN1與NtbHLH協(xié)同調控煙草葉片花色素苷的合成。
綜上所述, StAN1轉錄因子調控花色素苷合成有兩個重要機制, 一是 C末端結構不同的 3個StAN1同源蛋白調控花色素苷合成的能力不同, 其中含一個重復序列R的StAN1-R1調控能力最強, 說明 R具有重要功能; 二是 StAN1顯著調控內源bHLH轉錄因子的表達, 推測其與bHLH轉錄因子協(xié)同調控花色素苷生物合成相關結構基因的表達, 從而促進花色素苷的合成與積累。
4 結論
本試驗克隆了馬鈴薯R2R3 MYB家族的3個同源基因StAN1-R0、StAN1-R1和StAN1-R3。StAN1-R0的分子量最小, StAN1-R3分子量最大。3個同源基因編碼的蛋白質均為不穩(wěn)定狀態(tài), 二級結構均由 α-螺旋、β-螺旋、無規(guī)則卷曲和延伸鏈組成, 均含有2個高度保守結構域R2和R3。與StAN1基因同源性最高的為智利番茄和多毛番茄, 同源性最低的為玉米和水稻。葉色深度為StAN1-R1>StAN1-R0>StAN1-R3>CK。花色素苷含量為StAN1-R1>StAN1-R0>StAN1-R3>CK。StAN1的異源表達激活了煙草葉片內花色素苷合成的早期生物基因(NtCHS、NtCHI、NtF3H和NtF3’H)和晚期生物基因(NtDFR、NtANS和NtUFGT)的表達, 同時也顯著增強了內源NtbHLH轉錄因子的表達, 其中, 含有一個R基序的StAN1-R1調控能力最強。本研究為更深入了解R2R3 MYB轉錄因子參與調控馬鈴薯塊莖花色素苷合成提供了理論基礎。

