TP53在不明原因復發性流產患者絨毛組織中的表達及其對人滋養層細胞生長的影響
朱效慧,孟 琴,馮世燕
(1.山東省臨沂市人民醫院婦產科,山東 臨沂 276000;2.臨沂醫專附屬醫院婦產科,山東 臨沂 276000)
復發性流產(recurrent spontaneous abortion,RSA)是指育齡婦女連續2次或2次以上自然流產,雖然RSA的發生率不足5%,但給患者造成了極大的影響,且會隨著RSA次數的增加而增加下次流產的風險[1]。目前已知的RSA的原因有內分泌異常、生殖道感染畸形及染色體異常等,然而仍然有50%左右的RSA未找到原因,稱為不明原因復發性流產(unexplained recurrent spontaneous abortion,URSA)[2]。URSA占RSA的60%~70%,由于發病的原因不明確,治療非常困難,也無針對性的治療措施,給患者的身心和經濟造成了沉重的負擔[3-4]。因此,研究URSA的發病機制,并找到安全高效的治療方法是解決URSA的關鍵。
腫瘤蛋白P53(tumor protein P53,TP53)起初被認為是一種抑癌基因。TP53能抑制或激活基因的表達和轉錄,避免基因發生突變。隨著對TP53研究的深入,研究[4-5]顯示:TP53在生殖中也起重要作用。研究[6-7]顯示:TP53多態性與RSA有關,若有發育毒性物質以氧化應激的方式起作用,TP53基因能保護胚胎發育,若發育毒性物質以激活細胞凋亡的方式起作用,TP53基因能導致胚胎的異常發育。但TP53對URSA的影響及機制目前尚未清楚。鑒于TP53基因在胚胎發育方面的作用,本研究擬探討TP53在URSA絨毛組織中的表達及其對人滋養層細胞生物學特性的影響,以期為后續URSA的研究提供理論依據。
1 資料與方法
1.1 一般資料 患者組:選取2014年9月—2015年6月山東省臨沂市人民醫院婦產科收治的URSA患者40例,年齡21~39歲,平均年齡30.4歲,孕期42~79 d,平均孕期59.2 d;所有患者尿人絨毛膜促性腺激素(HCG)呈陽性,B超檢測均顯示為宮內孕,無胎心音。對照組:選取同時期在山東省臨沂市人民醫院就診的實施人工流產的健康孕婦30例,年齡21~39歲,平均年齡29.3歲;孕期40~74 d,平均孕期49.2 d;所有研究對象尿HCG呈陽性,B超檢測均顯示為宮內孕,有胎心,胎兒正常發育。
1.2 細胞、試劑和主要儀器 人滋養層HTR-8細胞購自中國醫學科學院基礎醫學研究所細胞中心。胎牛血清、RPMI 1640培養基和胰酶均購自美國Gibco公司,青、鏈霉素購自美國Amresco公司,熒光定量試劑盒和反轉錄試劑盒購自日本TaKaRa公司,細胞凋亡試劑盒購自美國ACTGene公司,Bcl-2和Bax單克隆抗體均購自美國Millipore公司,Cleaved-Caspase3單克隆抗體購自福州邁新生物技術公司,BCA試劑盒購自碧云天生物技術有限公司。CO2細胞培養箱(HERAcell型)購自美國Thermo公司,倒置熒光顯微鏡(CK2-TRC-3型)購自日本Olympus公司,流式細胞儀(LSR Ⅱ)購自美國BD公司,垂直電泳槽(DYCZ-24EN)購自北京六一生物科技有限公司,128C型酶標儀購自奧地利CliniBio公司。
1.3 樣本收集和處理 所有樣本的采集均經過患者及家屬的知情同意。所有研究對象的絨毛組織均在無菌條件下通過負壓吸引術獲得,置于-80℃冰箱中保存。
1.4 細胞培養 從液氮罐中取出人滋養層HTR-8細胞,37℃水浴溶解,向凍存管中加入含有10%FBS、100 g·L-1鏈霉素和100 U·mL-1青霉素的RPMI 1640培養基培養。傳代3~4次調整細胞狀態,細胞融合度達到90%以上時,0.25%胰蛋白酶消化細胞,含10%FBS培養基終止消化,調整細胞密度為4×105mL-1,細胞接種于96孔板中,置于37℃、5% CO2培養箱中培養。
1.5 細胞轉染 按照美國Invitrogen 公司的LipofectamineTM2000轉染方法進行細胞轉染。HTR-8細胞分為3組:空白對照組,細胞中加入無血清的RPMI 1640培養基;空載體組,細胞中轉染合成的無干擾作用的siRNA;TP53-siRNA組,細胞中轉染合成的靶向抑制TP53的特異性siRNA。siRNA均由廣州瑞博奧生物科技有限公司設計并合成。取生長至對數期的HTR-8細胞,消化后接種于24孔板中進行培養。將siRNA轉染到HTR-8細胞中,37℃、5% CO2培養箱中培養3~4 h,換成含10%FBS的RPMI 1640培養基并觀察轉染效率,繼續培養細胞48 h。
1.6 RT-PCR法檢測絨毛組織中TP53 mRNA表達水平 取絨毛組織,在加入液氮的研缽中研磨成粉末后轉入經DEPC水處理的EP管中,按照說明書(美國Invitrogen 公司)加入1 mL Trizol裂解細胞,提取總RNA。紫外分光光度計檢測提取的總RNA質量,A(260)/A(280)值為1.8~2.0表明RNA純度高。通過逆轉錄試劑盒將總RNA反轉錄成cDNA,按照實時定量PCR試劑盒說明進行目的基因的擴增。以GAPDH為內參,根據RT-PCR法檢測的Ct值,采用2-△△ct方法計算 TP53 mRNA表達水平。實驗重復3次,取平均值。
1.7 Western blotting法檢測絨毛組織中和各組HTR-8細胞中TP53蛋白表達水平 絨毛組織在預先加入液氮的研缽中研磨成粉末,轉入已加入適量裂解液的離心管中,置于冰上裂解反應30 min,4℃、15 000 r·min-1離心15 min,收集上清。BCA試劑盒測定蛋白濃度。上樣緩沖液與蛋白樣品充分混勻,100℃變性5 min后進行SDS-PAGE電泳,電泳結束后轉印蛋白至PVDF膜上,5%脫脂奶粉室溫封閉2 h。分別以1∶500稀釋的TP53作為一抗,4℃孵育過夜,TBST清洗后加入1∶1 000稀釋的辣根過氧化物酶標記的二抗,37℃孵育1 h。TBST清洗,ECL發光劑顯影后用自動凝膠成像系統采集圖像。以目的蛋白與內參GAPDH蛋白的灰度值比值作為目的蛋白的相對表達水平。各組HTR-8細胞中 TP53蛋白表達水平檢測方法同上。 實驗重復3次,取平均值。
1.8 流式細胞術檢測細胞凋亡率 取轉染48 h細胞,胰酶消化成單細胞懸液,調整細胞濃度為4×105mL-1,取1 mL細胞懸液加入培養瓶中,37℃、5% CO2培養箱中培養48 h,觀察到細胞貼壁生長狀態良好時,收集懸浮及貼壁細胞,1 000 r·min-1離心5 min,AnnexinⅤ-FITC結合液重懸細胞,避光室溫孵育10 min,離心,棄上清,PI冰盒中避光孵育10 min。流式細胞術檢測空白對照組和TP53-siRNA組細胞凋亡率。
1.9 Transwell小室檢測細胞遷移數 取轉染48 h的細胞,接種于Transwell小室的上室,置于含10%胎牛血清的RPMI 1640培養基培養,下室加入含10%胎牛血清的RPMI 1640培養基培養,培養48 h后棄去培養液,用棉簽輕輕拭去膜上的細胞,HE染色后在倒置顯微鏡下進行遷移細胞計數。隨機計數5個高倍視野(×200)下侵襲至濾膜下表面的細胞數,計算平均值,實驗重復3次。
1.10 Western blotting法檢測凋亡相關蛋白Caspase3、Bcl-2和Bax蛋白表達水平 取轉染48 h的空白對照組和TP53-siRNA組細胞,提取細胞中的蛋白,BCA試劑盒檢測提取的蛋白濃度,采用1.5中方法檢測空白對照組和TP53-siRNA組細胞中Caspase3、Bcl-2和Bax蛋白表達水平。

2 結 果
2.1 2組研究對象絨毛組織中TP53 mRNA和蛋白表達水平 對照組和患者組絨毛組織中TP53 mRNA表達水平分別為1.000±0.000和3.549±0.326,蛋白表達水平分別為0.021±0.004和0.273±0.032,患者組絨毛組織中TP53 mRNA和蛋白表達水平均明顯高于對照組(P<0.01)。見圖1。
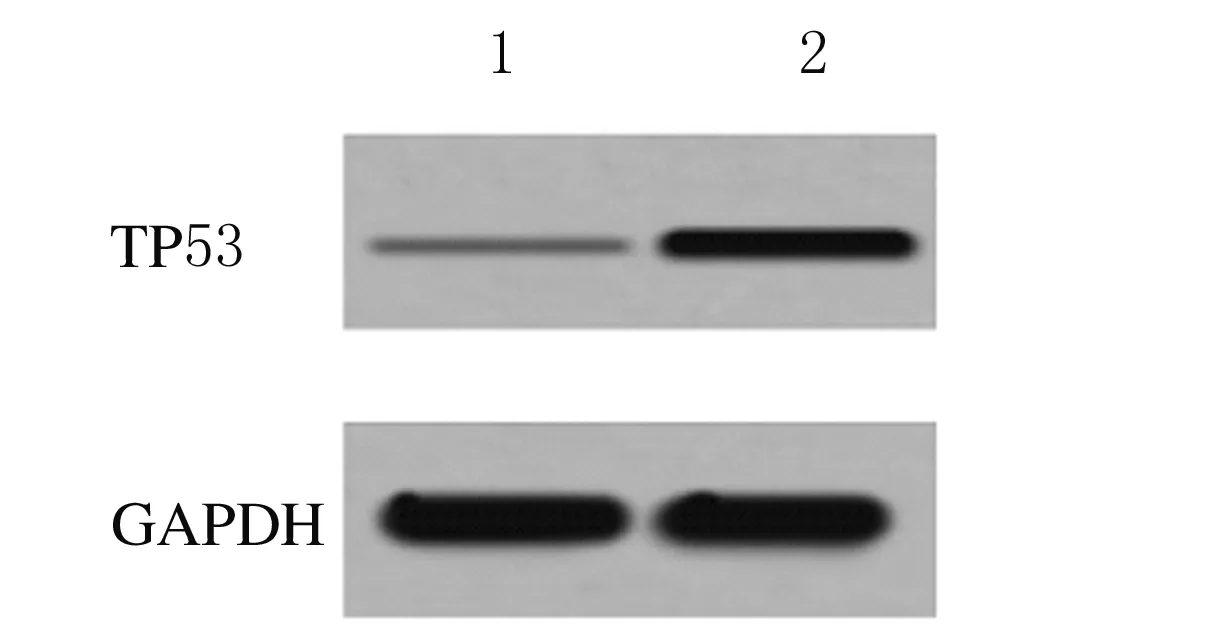
Lane 1: Control group;Lane 2:Patient group.
Fig.1 Electrophoregram of expressions of TP53 protein in villus tissue of subjects in two groups
2.2 Western blotting檢測轉染siRNA后各組細胞中TP53蛋白表達水平 細胞轉染48 h后, TP53-siRNA組細胞中TP53蛋白表達水平(0.112±0.009)明顯低于空白對照組(0.387±0.012)和空載體組(0.398±0.014)(P<0.01),空載體組與空白對照組比較差異無統計學意義(P>0.05 )。見圖2。
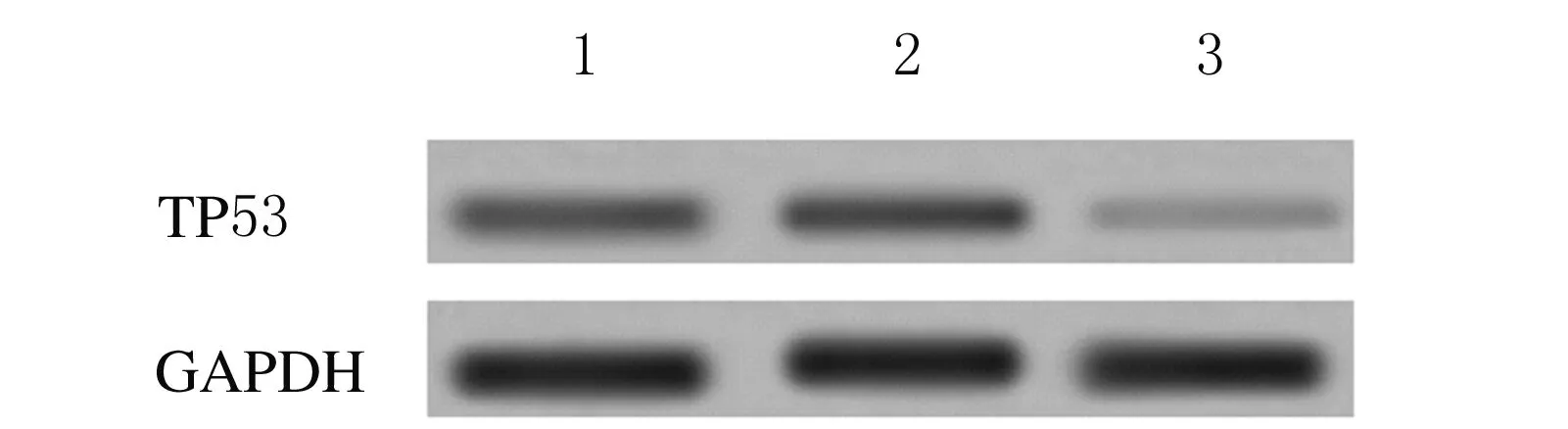
Lane 1: Blank control group;Lane 2: Vector group;Lane 3: TP53-siRNA group.
圖2 各組HTR-8細胞中TP53蛋白表達電泳圖
Fig.2 Electrophoregram of TP53 expressions in HTR-8 cells in various groups
2.3 各組細胞凋亡率 細胞轉染48 h后, TP53-siRNA組細胞凋亡率(3.46%±0.56%)明顯低于空白對照組(15.38%±1.21%)(P<0.01)。見圖3。
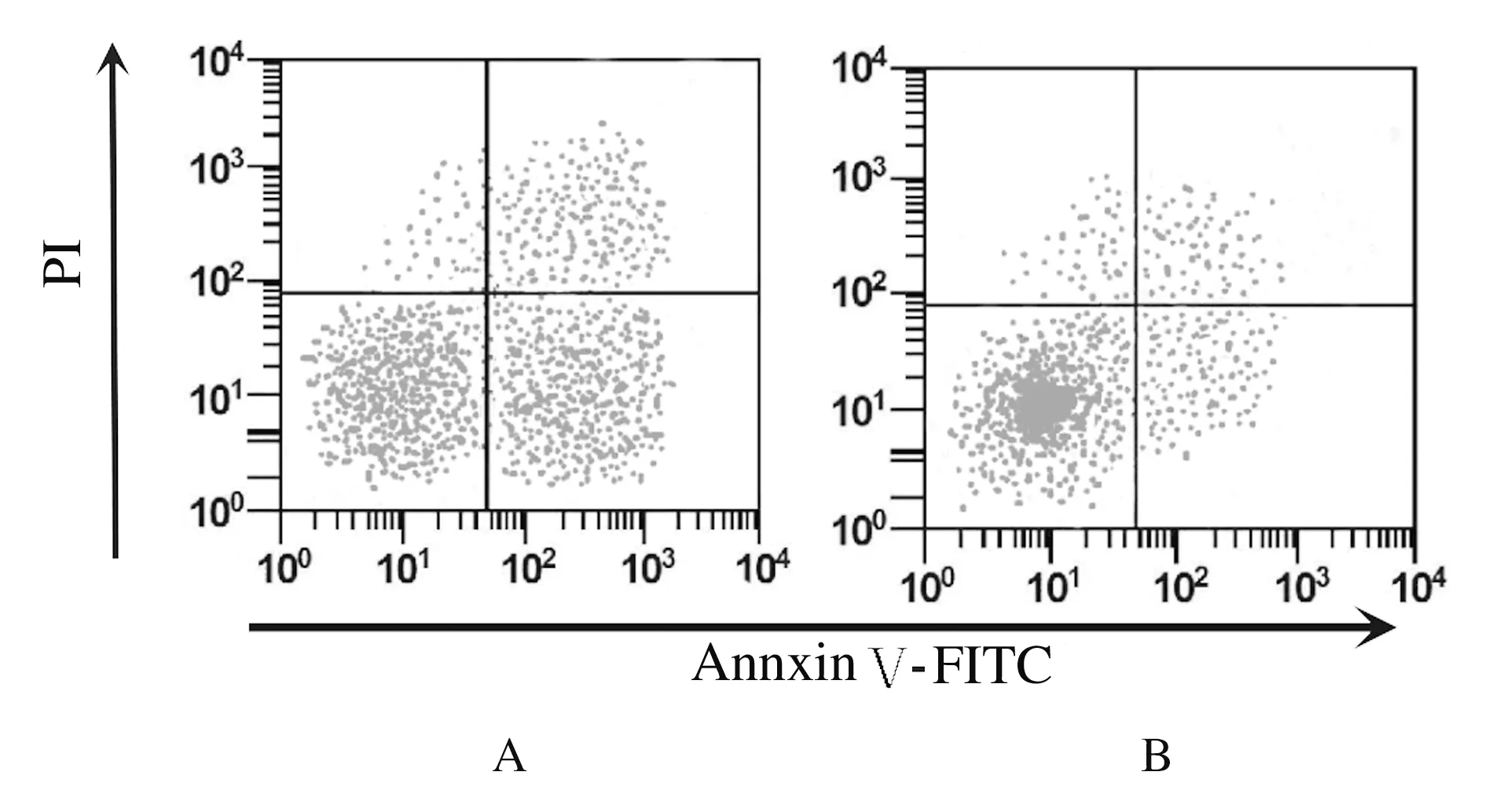
A: Blank control group;B: TP53-siRNA group.
Fig.3 Apoptoic rates of cells in two groups detected by flow cytometry
2.4 各組細胞遷移數 細胞轉染48 h后, Transwell小室檢測,空白對照組和TP53-siRNA組細胞遷移數分別為71.23±8.88和152.46±6.54,TP53-siRNA組細胞遷移數明顯高于空白對照組(P<0.01)。
2.5 各組細胞中Cleaved-Caspase3、Bax和Bcl-2蛋白表達水平 細胞轉染48 h后,與空白對照組比較,TP53-siRNA組細胞中Cleaved-Caspase3和Bax蛋白表達水平均明顯降低(P<0.01),Bcl-2蛋白表達水平明顯升高(P<0.01)。見圖4和表1。

Lane 1:Blank control group;Lane 2:TP53-siRNA group.
圖4 Western blotting法檢測各組細胞中Cleaved-Caspase3、Bax和Bcl-2蛋白表達電泳圖
Fig.4 Electrophoregram of expressions of Cleaved-Caspase3,Bax, and Bcl-2 proteins detected by Western blotting method
表1 各組細胞中 Cleaved-Caspase3、Bax和Bcl-2蛋白表達水平


GroupCleaved-Caspase3BaxBcl-2Blank control0.436±0.0320.372±0.0310.166±0.015TP53-siRNA 0.160±0.018? 0.141±0.017?0.415±0.036?
*P<0.01 compared with blank control group.
3 討 論
細胞凋亡與維持機體的正常生理功能及組織器官的發育有關聯,在妊娠孕卵的著床和胚胎的正常發育過程中發揮重要作用[8]。研究[9]顯示:滋養層細胞大量的凋亡可導致細胞侵入功能不足,可誘導患者絨毛組織中細胞發生凋亡,說明滋養層細胞凋亡過多可能是引起反復自然流產的原因。研究[10-12]顯示:TP53在生殖過程中扮演重要角色,可通過下調Bcl-2和上調Bax的表達啟動細胞凋亡,在URSA患者中TP53的表達升高,且能誘導人滋養層細胞凋亡。提示TP53可能與URSA有關。但目前TP53對URSA的影響及其機制尚未清楚。
本研究首先檢測了URSA患者絨毛組織中TP53的表達,結果顯示:URSA患者絨毛組織中TP53 mRNA和蛋白表達水平均明顯升高,與已往的研究[12]結果一致。RNA干擾技術是使特定基因表達沉默的一項新技術,目前在多種疾病治療、基因功能研究等方面廣泛應用[13-14]。鑒于TP53在URSA患者絨毛組織中的高表達,本研究通過RNA干擾技術沉默人滋養層細胞TP53表達,結果顯示:TP53受到干擾后人滋養層細胞凋亡率明顯降低,遷移能力升高,提示沉默TP53表達可降低URSA的發生率。
Caspase家族在細胞凋亡過程中起重要作用,Caspase3是該家族關鍵成員,也是能在胎盤組織中表達的Caspase[15-16]。研究[17-18]顯示:Caspase3在URSA患者絨毛組織中的表達水平明顯高于對照組,說明Caspase3表達水平升高可能是引起流產的原因。Bax和Bcl-2在細胞凋亡過程中起重要的調控作用,Bax促進細胞凋亡,Bcl-2抑制細胞凋亡,Bax/Bcl-2比值升高促進細胞凋亡,反之則抑制細胞凋亡[19]。通過調節Bax/Bcl-2比值可影響人滋養層細胞的凋亡[20]。本研究結果顯示:干擾TP53表達后Cleaved-Caspase3和Bax表達水平降低,Bcl-2表達水平升高,提示干擾TP53表達對人滋養層細胞凋亡的影響機制可能是通過調控Cleaved-Caspase3、Bax和Bcl-2表達實現的。
綜上所述,在URSA患者絨毛組織中TP53呈高表達,沉默人滋養層HTR-8細胞TP53表達能明顯促進細胞遷移和抑制細胞凋亡。本研究為探討URSA患者的診療途徑提供了理論基礎。

