2011—2017年中國中藥新藥注冊申請分析△
王汝琳
(安徽中醫(yī)藥大學 醫(yī)藥經(jīng)濟管理學院,安徽 合肥 230012)
中藥是中醫(yī)藥的重要組成部分,也是中醫(yī)藥得以發(fā)揮其作用的物質(zhì)基礎(chǔ),因而中藥的發(fā)展與創(chuàng)新對中醫(yī)藥的發(fā)展起著舉足輕重的作用。中藥注冊,作為傳統(tǒng)中醫(yī)藥典籍中的經(jīng)方名方走向現(xiàn)代藥品市場關(guān)鍵節(jié)點,是中藥發(fā)展最為關(guān)鍵的指標體現(xiàn)[1]。近年來,關(guān)于我國中藥新藥申請具體數(shù)量的分析文獻相對較少,有學者分別對2008—2013年[2]和2010—2015年[3]我國中藥新藥注冊申報審批情況,以及2010—2015年原國家食品藥品監(jiān)督管理總局(CFDA)批準臨床試驗的中藥品種概況[4]進行過分析。另外,還有學者從2011—2015年CFDA批準中藥品種的情況分析了我國中藥產(chǎn)品的開發(fā)趨勢[5]。但在2015年,隨著《國務(wù)院關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》以及一系列關(guān)于藥品審評審批制度改革的政策文件的發(fā)布,有關(guān)部門收緊化學藥品的注冊審評,并在政策上影響了中藥品種的注冊申請。另一個方面,2016年底《中華人民共和國中醫(yī)藥法》的通過以及2017年新版《藥品注冊管理辦法》修訂稿的發(fā)布,都對中藥新藥研發(fā)及申報產(chǎn)生了深遠影響。
由于在目前已發(fā)表文獻中暫未見對2015年以后的中藥注冊申請品種的梳理,本文在整理國家有關(guān)部門公開數(shù)據(jù)庫中的信息后,對2011—2017年國內(nèi)中藥新藥注冊申請的具體情況進行了分析,著重觀察2015年后一系列深化藥品審評審批制度的文件的出臺對中藥注冊申請的影響,并嘗試剖析其中可能存在的潛在規(guī)律及成因。
1 材料與方法
1.1 中藥新藥的界定
2007版《藥品注冊管理辦法》附件1“中藥、天然藥物注冊分類及申報資料要求”中規(guī)定:中藥及天然藥物注冊分為9類,其中注冊分類1~6的品種為新藥,注冊分類中第7類和第8類屬于按新藥申請程序申報,第9類為仿制藥[6]。
1.2 數(shù)據(jù)來源
本文數(shù)據(jù)主要來源于CFDA(www.sda.gov.cn),包括2011—2017年CFDA藥品審評中心(CDE)(www.cde.org.cn)“信息支持系統(tǒng)”中的相關(guān)數(shù)據(jù)庫以及CDE網(wǎng)站發(fā)布的年度藥品注冊審批報告,從中查詢和整理了2011—2017年CFDA和CDE受理和批準的中藥新藥品種數(shù)據(jù)。
1.3 研究方法
將從CFDA、CDE官網(wǎng)檢索出來的數(shù)據(jù)進行分類、整理,并分別對注冊申請數(shù)量、類別、劑型分布等情況進行梳理、統(tǒng)計、分析,找出其中可能潛在的規(guī)律及其成因。
1.4 統(tǒng)計數(shù)據(jù)說明
在從CDE的數(shù)據(jù)庫中查詢到的注冊數(shù)據(jù)中,對于“6類”中藥新藥,有些是直接以“6類”申請,有些是按照“6.1”“6.2”“6.3”等小類的方式申請。本文把“6類”和“6.1”“6.2”“6.3”統(tǒng)一按照6類中藥新藥進行統(tǒng)計。
2 2011—2017年我國中藥新藥申請情況
2.1 各類新藥申請數(shù)量
由表1可知,2011—2017年CDE共接收新的中藥品種注冊申請3398件,其中中藥新藥(包括按新藥申請)注冊申請628件,占總申請數(shù)量的18.48%。
由表2可知,2011—2017年中藥新藥注冊申請的品種數(shù)共628件,其中1~6類的中藥新藥申請數(shù)共533件,占總申請數(shù)的82.64%。在1~6類的中藥新藥申請品種中,6類申請數(shù)量最多,達434件,占全部申請品種數(shù)量的69.11%;其他類別按申請數(shù)量由大到小依次排序:5類,72件,占11.16%;1類,21件,占3.26%;4類,3件,占0.47%;2類,2件,占0.31%;3類,1件,占0.16%。
2.2 申請品種劑型
由表3可知,2011—2017年我國中藥新藥品種申請的劑型中,顆粒劑是申請品種最多的劑型,共172件,占所有劑型總量的29.30%;其次是膠囊劑,共164件,占總量的27.94%;再次是片劑,共110件,占總量的18.74%。顆粒劑、膠囊劑和片劑3個劑型占到總申請數(shù)量的75.98%。其他劑型按照數(shù)量由大到小依次排序為:外用膏劑(占比3.24%)、丸劑(占比2.73%)、口服液(占比2.56%)、注射劑(1.87%)、栓劑(1.36%)、內(nèi)服膏劑(1.19%)、貼劑(1.19%)。其他劑型如凝膠、糖漿、噴霧劑、合劑、滴眼劑、散劑等申請數(shù)量較少,占比低于1%。
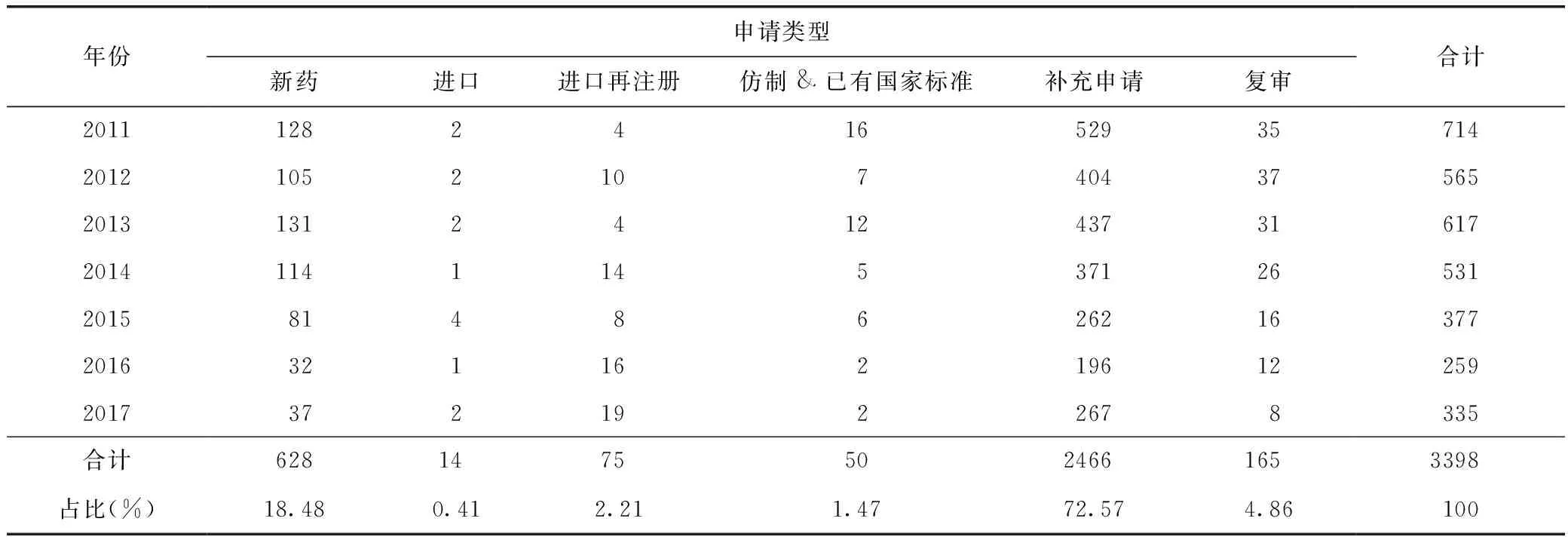
表1 2011—2017年我國中藥品種注冊申請的分類和數(shù)量 件
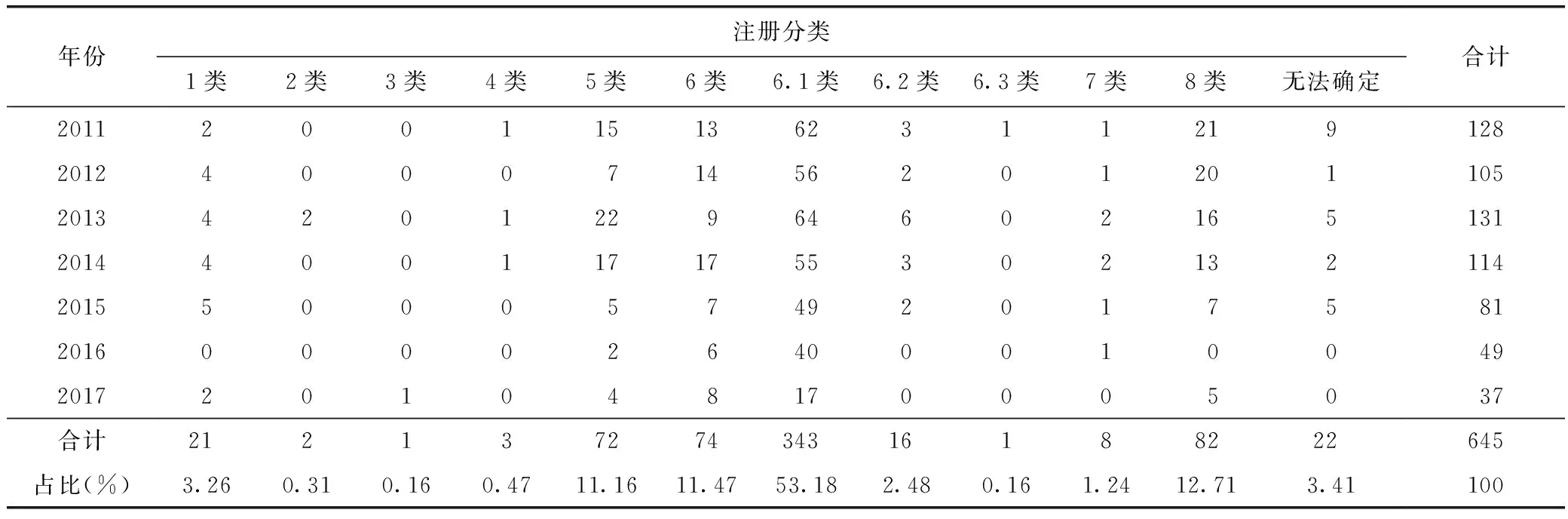
表2 2011—2017年中藥新藥(包括按新藥申請)注冊申請數(shù)量 件
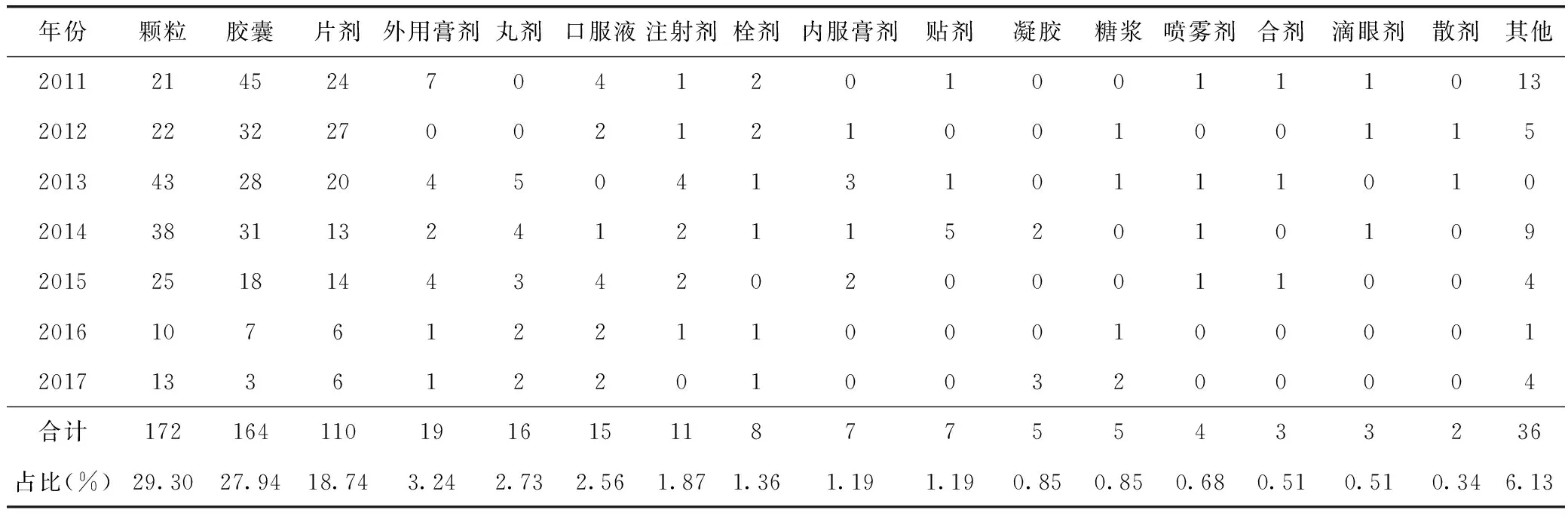
表3 2011—2017年中藥新藥注冊申請品種劑型分布情況 件
3 分析與結(jié)果
3.1 關(guān)于中藥注冊申請數(shù)量
從2011—2017年的中藥注冊申請數(shù)量來看,除補充申請和復(fù)審?fù)猓兴幾陨暾埖念愋鸵灾兴幮滤帪橹鳎嫉娇偭康陌顺梢陨希@是中藥與化學藥在注冊申請種類上的一個非常大的區(qū)別。這主要是由于在2008年頒布實施的《中藥注冊管理補充規(guī)定》中提高了對中藥改劑型和中藥仿制藥的研發(fā)標準,根據(jù)中藥的特點,進一步明確了對改劑型品種的注冊申請要求,強調(diào)必須通過臨床試驗來證明新劑型的科學、合理。同時,對于中藥仿制藥,也要求通過臨床試驗來證明與被仿制品種質(zhì)量的一致性,大大提高了中藥仿制的成本[7]。而對化學藥的一致性評價工作,直到2016年CFDA轉(zhuǎn)發(fā)國務(wù)院辦公廳發(fā)布的《關(guān)于開展仿制藥質(zhì)量和療效一致性評價的意見》,才真正開始分期分批進行。此外,無論是現(xiàn)行2007版《藥品注冊管理辦法》還是2017年發(fā)布的《藥品注冊管理辦法(修訂稿)》,都對中藥新藥的定義和范圍進行了嚴格的界定。一般而言,中藥改劑型和中藥仿制藥均不屬于按新藥申請的范疇,這兩者的高注冊標準間接導(dǎo)致在中藥注冊申請的類型中新藥占很大比例。
由圖1可以明顯觀察到,無論是中藥注冊申請總量還是中藥新藥申請數(shù)量在2015年均出現(xiàn)了明顯回落,在隨后的2016年中藥注冊受理數(shù)量進一步下降,直到2017年才出現(xiàn)回升。這主要是由于當年《國務(wù)院關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》以及一系列關(guān)于藥品審評審批制度改革的政策文件的發(fā)布,收緊了注冊受理和審批的標準,加強了監(jiān)管和處罰的力度。2015年7月中下旬,CFDA密集發(fā)布公告,要求注冊申請單位開展藥物臨床試驗數(shù)據(jù)的自查核查工作,同時也要求CDE進一步規(guī)范藥品注冊受理工作并加快解決藥品注冊積壓問題。此后,藥品監(jiān)督管理部門不斷加大對藥品臨床試驗的監(jiān)管力度,對申請人或者研究機構(gòu)在注冊申請時的弄虛作假行為嚴肅查處。同時,CDE在新藥注冊審評過程中的重點放在了對臨床研究數(shù)據(jù)和申請材料的審評。這樣使得中藥臨床研究的技術(shù)要求大幅度提高,也基本杜絕了臨床研究數(shù)據(jù)造假和虛報。上述監(jiān)管政策的出臺使得新藥注冊審批的難度大幅提升。此外,近年來不論是學術(shù)界還是監(jiān)督主管部門都在強調(diào)新藥注冊審批應(yīng)以臨床價值作為主要評價指標,這使得新藥研發(fā)機構(gòu)都在重新審視新藥立項的標準。上述兩個方面的因素造成了2015年后中藥新藥申請注冊數(shù)量的明顯下降。
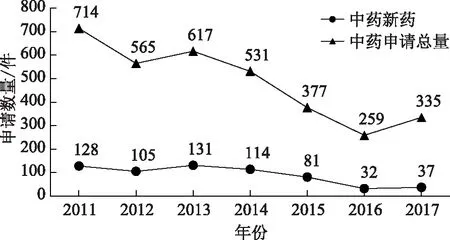
圖1 2011—2017年中藥注冊申請數(shù)量統(tǒng)計圖
3.2 關(guān)于中藥新藥注冊申請分類情況
由表2可以看出,在2011—2017年CDE受理的中藥新藥注冊申請中,中藥復(fù)方新藥(第6類)數(shù)量最多,占比最高;其次是以有效部位申請的新藥(第5類)。而注冊分類中的第2類、第3類和第4類,即新藥材及制劑、新的中藥材代用品、藥材新的藥用部位及制劑申請數(shù)量很少,在最近7年中總共只有6個。這個情況與目前我國中藥新藥研發(fā)的實際情況相符,這些注冊類別的中藥新藥開發(fā)難度較大,風險較高。
3.3 關(guān)于注冊申請品種劑型的選擇
由表3可以看出,企業(yè)申請的品種劑型按申請數(shù)量由多到少依次排序為顆粒劑、膠囊劑、片劑、外用膏劑、丸劑、口服液、注射劑、栓劑、內(nèi)服膏劑、貼劑。這些品種劑型申請數(shù)量的多少與其研發(fā)過程的難易有直接關(guān)系。另一方面,從國務(wù)院藥品監(jiān)督管理部門公布的上市品種數(shù)據(jù)情況來看,膠囊劑、片劑、糖漿劑等比較容易取得臨床試驗批件和生產(chǎn)批件,而注射劑等劑型則非常難以取得臨床和生產(chǎn)批件。近年來申請數(shù)量最多的顆粒劑在審批環(huán)節(jié)的通過率并不高,這可能與學術(shù)界針對顆粒劑生產(chǎn)工藝的科學性和質(zhì)量可控性的爭論有一定關(guān)聯(lián)。中藥6類新藥由于是復(fù)方制劑,每日服用量較大,這需要載藥量比較大的劑型來滿足較高的日服量。從載藥量角度來看,顆粒劑載藥量最大,其次是膠囊劑,再次是片劑,這可能是上述結(jié)果的原因之一。注射劑申請數(shù)量減少,則是由于近年來關(guān)于中藥注射劑嚴重不良反應(yīng)報告逐漸增多。國務(wù)院藥品監(jiān)督管理部門于2007年頒布了《中藥、天然藥物注射劑的基本技術(shù)要求》和《中藥注射劑安全性再評價工作方案》,2009年下發(fā)《關(guān)于開展中藥注射劑安全性再評價工作的通知》,2011年公布《中藥注射劑安全性再評價基本技術(shù)要求》,這一系列文件的頒布在很大程度上提高了中藥注射劑的安全性要求,而且CDE對審評過程掌握得也很嚴,因此近年來少見中藥注射劑的注冊申請。
4 討論
目前,我國中藥新藥注冊分類采用的主要法律依據(jù)仍是2007版《藥品注冊管理辦法》中對于“中藥、天然藥物注冊分類及申報資料要求”及其他相關(guān)法律文件。自該辦法實施以來,業(yè)界一直存在爭論,認為該辦法對于中藥注冊材料申報要求套用的是化學藥品注冊的管理辦法,無論是中藥還是化學藥品采用的均是基于藥物的純度和含量為標準的注冊分類,并沒有體現(xiàn)中藥的特色,限制了中藥的發(fā)展,加重了中藥和化學藥發(fā)展的不平衡。無論是1類、5類還是6類的藥物,只要其在治療相同疾病上具有相同的臨床價值,那么其新藥價值就應(yīng)是相同的。
2017年10月23日,CFDA正式發(fā)布了《藥品注冊管理辦法(修訂稿)》,并對修訂稿開始征求意見。在本次的征求意見稿中,臨床需求成為藥品注冊的主要導(dǎo)向。同時,中藥、天然藥物注冊分類也做出了較大調(diào)整,由原來的9類調(diào)整為5類:1類為創(chuàng)新藥;2類為改良型新藥;3類為古代經(jīng)典名方;4類為同方類似藥;5類為進口藥[8]。
其中“古代經(jīng)典名方”在征求意見稿中單獨作為一個注冊分類出現(xiàn),成為國家藥物研發(fā)體系的新成員,體現(xiàn)了我國對于經(jīng)方、名方開發(fā)的鼓勵和扶持。2016年出臺的《中華人民共和國中醫(yī)藥法》,在第三十條中也明確規(guī)定“生產(chǎn)符合國家規(guī)定條件的來源于古代經(jīng)典名方的中藥復(fù)方制劑,在申請藥品批準文號時,可以僅提供非臨床安全性研究資料”。這些條款從法律層面為中藥新藥,尤其是來自經(jīng)方、名方的中藥復(fù)方制劑,提供了由院內(nèi)制劑轉(zhuǎn)向上市流通的有效捷徑,保證了傳統(tǒng)中藥在堅持傳統(tǒng)中醫(yī)理論的基礎(chǔ)上實現(xiàn)現(xiàn)代化。
5 結(jié)語
中藥作為中醫(yī)藥得以發(fā)揮作用的重要物質(zhì)基礎(chǔ),其發(fā)展與創(chuàng)新對中醫(yī)藥的發(fā)展至關(guān)重要。本文分析了2011—2017年我國中藥新藥注冊申請情況,反映了之前一段時期我國中藥新藥研發(fā)和評價的一些實際情況,為《中華人民共和國中醫(yī)藥法》和新的《藥品注冊管理辦法》實施后的中藥新藥研發(fā)和評價工作提供一定的數(shù)據(jù)參考。

