藁本內酯上調miR-181b減輕氧化低密度脂蛋白誘導人臍靜脈內皮細胞炎癥損傷
黃志勇,田廣永,曹 玲,詹堅宏,趙丹丹,于云紅,周鳳華*
(1.南方醫科大學第三附屬醫院耳鼻咽喉頭頸外科,廣州 510630; 2.南方醫科大學中醫藥學院,廣州 510515; 3.廣東省人民醫院中醫科,廣州 510080)
動脈粥樣硬化(atherosclerosis,AS)是一種與內皮損傷、炎癥因子介導、脂質沉積浸潤有關的慢性炎癥反應[1-2]。雖然AS的發病機制復雜,但內皮細胞損傷是其公認的始動環節。氧化低密度脂蛋白(oxidative low density lipoprotein,ox-LDL)、腫瘤壞死因子(tumor necrosis factor,TNF-α)、白介素6(IL-6)、白介素8(IL-8)等均可損傷或激活內皮細胞,導致細胞的通透性增加,表面黏附分子如細胞黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)、血管細胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)和E-選擇素等表達增加,單核細胞通過內皮黏附分子黏附于損傷內皮表面,遷移為巨噬細胞,從而過度攝取脂質形成泡沫細胞,大量泡沫細胞堆積于血管內壁,最終導致AS的發生[3-5]。
藁本內酯(ligustilide,LIG),又名東當歸酞內酯,是川芎和當歸中主要的內酯類化合物,也是其主要的活性成分。LIG在神經保護、抗腫瘤、心腦血管、循環系統及免疫功能等方面均有較強的藥理作用。有研究表明LIG具有一定的抗AS作用[6],但其作用機制并不明確。本課題采用ox-LDL誘導人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVEC)損傷模型,通過研究LIG對HUVEC內炎性細胞因子表達調控作用,探討LIG保護內皮細胞及抗AS的藥理機制。
1 材料和方法
1.1 實驗材料
第二代人源HUVEC細胞(批號ZQ00446,上海中喬新舟科技公司)。
1.2 主要試劑與儀器
藥物:藁本內酯(純度> 98%,批號111737-201608,廣州市藥檢所,化學結構見圖1)用適量二甲基亞砜(DMSO)溶解后,再用PBS稀釋;ox-LDL(批號YB-002,廣州奕源生物公司)。

圖1 藁本內酯化學結構Figure 1 Structure of ligustilide
其他試劑:DMEM/F12培養基、胎牛血清(批號03/17、F7676,美國Gibco公司);CCK8試劑盒(批號CK04,上海東仁科技公司);Annexin V-FITC細胞凋亡檢測試劑盒(批號40302ES20,南京凱基生物公司);TNF-α、IL-6、ICAM-1及VCAM-1 ELISA試劑盒(批號CSB-E04740h、CSB-E04638h、CSB-E04574h、CSB-E04753h,武漢華美生物公司);RNAiso Plus、Prime ScriptTMRT Reagent Kit、SYBR Premix Ex TaqTM(批號9109、RR037A、RR420A,Takara公司);兔抗NF-κB p65抗體、兔抗GAPDH、小鼠抗兔二抗(批號8242、5174S、14708s,美國CST公司);miR-181b mimics、miR-181b inhibitor(批號5632、5634,上海吉瑪制藥公司)。引物均由廣州天駿公司合成。
儀器:超凈臺(香港力康生物醫療集團);細胞培養箱、MK3型酶標定量測定儀、反轉錄儀及熒光定量PCR系統(美國Thermo公司);Echo-Plus型全自動生化儀(意大利愛康公司);流式細胞儀(美國Beckman Coulter公司);TSl00-F型Eclipse Ti熒光倒置顯微鏡(日本Nikon公司);Image Station 2000MM多功能成像系統(美國Kodak公司)。
1.3 實驗方法
1.3.1 細胞分組
取對數生長期細胞進行實驗,將細胞隨機分為5組:對照組、模型組(100 μmol/L ox-LDL干預24 h)、LIG低濃度組、LIG中濃度組、LIG高濃度組。其中,LIG低、中、高濃度組細胞分別以10、20、40 μmol/L預先孵育2 h,再用100 μmol/L ox-LDL干預24 h。分別檢測細胞增殖及凋亡情況。
1.3.2 細胞增殖實驗
將第3代對數增長期細胞按1 × 105/mL密度接種于96孔板上,每組6個孔,常規培養24 h后更換培養基,分為空白組、陰性對照組、模型組、LIG低中高濃度組,其中LIG每組分別加入10、20、40 μmol/L LIG預先孵育2 h,每孔再加入5 g/L的CCK-8液10 μL,置于培養箱孵育1 ~ 2 h,然后于酶標儀460 nm處檢測OD值。計算公式如下:存活率(%)=(As - Ab)/(Ac - Ab) × 100%,其中,As、Ab和Ac分別是實驗組(含有細胞的培養基和藥物)、空白組(不含細胞的培養基)和陰性對照組的吸光度(含有細胞的培養基)。
1.3.3 細胞凋亡檢測
細胞分組干預后離心收集,加入100 μL binding buffer混勻,再加入5 μL Annexin V-FITC和5 μL PI染色液,輕輕混勻,室溫避光反應10 min,再加入400 μL binding buffer混勻,立即上流式細胞儀檢測(激發波長488 nm,發射波長530 nm),計算細胞凋亡指數。
1.3.4 炎性細胞因子檢測
采用ELISA法,將細胞接種于10 cm細胞皿,細胞分組處理同前。培養終止后,吸出培養液,用PBS充分洗滌后將其轉移到離心管,用PBS稀釋到10 × 106/mL,-20℃過夜(兩輪反復凍融破壞細胞),4℃、5 × 104r/min離心5 min,取上清液按說明書進行操作,分別計算細胞中TNF-α、IL-6、ICAM-1及VCAM-1的濃度。
1.3.5 實時熒光定量PCR
提取細胞總RNA,合成cDNA:總反應體系20 μL,組成為14 μL模板RNA,2 μL enzyme mix,5 × RT緩沖液4 μL,42℃反應60 min,95℃反應5 min,將合成好的cDNA保存于-20℃。熒光定量PCR:總反應體系20 μL由2 × PCR反應混合物10 μL、cDNA 1 μL、目的基因引物0.5 μL、20 × SYBR 1 μL與H2O 7.5 μL組成。95℃反應10 min,再轉向95℃ 10 s,60℃ 1 min共40個循環。目的基因與內參GAPDH的引物序列見表1,相對表達量用2-△△Ct表示,實驗重復3次。

表1 目的基因與內參的引物序列Table 1 Primer sequences for target genes and the internal control gene
1.3.6 免疫印跡實驗
提取細胞總蛋白,采用BCA法進行定量,按照每孔上樣50 μg蛋白進行SDS-PAGE電泳,積層膠和分離膠濃度分別為5%和12%,采用半干轉膜法轉膜70 min,將蛋白從膠上轉移到PVDF膜上,再用5%脫脂牛奶室溫封閉1 h,一抗4℃孵育過夜(1∶2000),二抗37℃孵育1 h(1∶5000),ECL法顯色成像,圖像采用Image Tool 3.0分析光密度值(IOD),實驗設立GAPDH為內參照,重復3次以上。
1.4 統計學方法

2 結果
2.1 藁本內酯對HUVEC細胞增殖及凋亡的影響
與對照組相比,ox-LDL能顯著誘導HUVEC細胞損傷,抑制細胞存活率,促進其凋亡。中、高濃度LIG預處理2 h能減輕HUVEC損傷,與模型組相比差異有顯著性(P< 0.01,表2),說明LIG具有減輕ox-LDL誘導的HUVEC細胞損傷作用。
2.2 藁本內酯對HUVEC內炎性細胞因子含量的影響
與對照組相比,ox-LDL能顯著增加細胞內TNF-α、IL-6、ICAM-1及VCAM-1等促炎細胞因子及細胞黏附分子分泌,進一步誘導細胞損傷。LIG各濃度組可明顯抑制這些細胞因子的分泌,與模型組相比差異有顯著性(P< 0.01,表3),提示LIG可能主要通過抑制炎性因子分泌,減輕細胞炎癥反應,從而減輕ox-LDL誘導的細胞損傷。LIG具有一定的抗炎作用,這也與文獻報道一致[7]。
2.3 藁本內酯對HUVEC內炎性因子及miR-181b mRNA水平的影響
為進一步探討LIG對TNF-α、IL-6等炎性因子的表達調控,本研究檢測了這些細胞因子的轉錄水平。中、高濃度LIG預處理組能顯著降低TNF-α、IL-6、ICAM-1及VCAM-1的轉錄水平,與模型組相比差異有顯著性(P< 0.01,表4),說明LIG能降低TNF-α、IL-6等炎性因子的轉錄水平,從而抑制HUVEC細胞分泌水平。同時,本研究還檢測了炎癥重要調節因子NF-κB的上游調控miRNA——miR-181b的mRNA水平,發現LIG中、高濃度組可以明顯降低NF-κB的水平和增加miR-181b的水平,因此推測LIG可能會通過調節NF-κB表達起到抗炎作用。
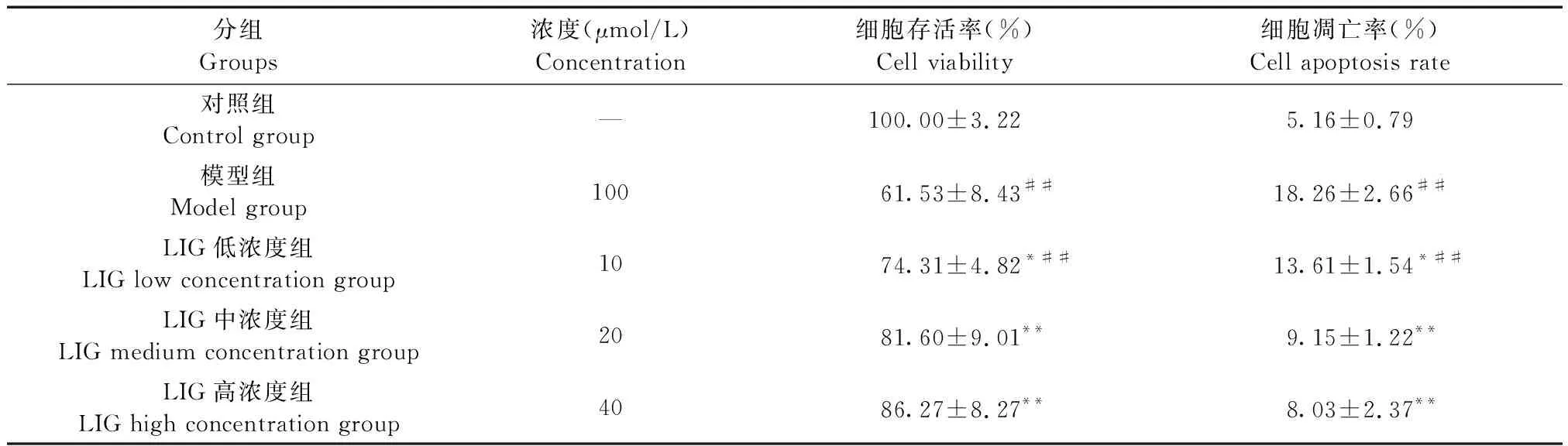
表2 各組細胞存活率及凋亡率Table 2 Viability and apoptosis rate of HUVEC in each group
注:與模型組相比,*P< 0.05,**P< 0.01;與對照組相比,#P< 0.05,##P< 0.01。
Note. Compared with the model group,*P< 0.05,**P< 0.01. Compared with the control group,#P< 0.05,##P< 0.01.

表3 各組細胞內炎性因子的含量Table 3 Levels of inflammatory cytokines in HUVEC of each group
注:與模型組相比,*P< 0.05,**P< 0.01;與對照組相比,#P< 0.05,##P< 0.01。
Note. Compared with the model group,*P< 0.05,**P< 0.01. Compared with the control group,#P< 0.05,##P< 0.01.

表4 各組細胞內炎性因子及miR-181b mRNA相對表達量Table 4 mRNA levels of inflammatory cytokines and miR-181b in each group
注:與模型組相比,*P< 0.05,**P< 0.01;與對照組相比,#P< 0.05,##P< 0.01。
Note. Compared with the model group,*P< 0.05,**P< 0.01. Compared with the control group,#P< 0.05,##P< 0.01.
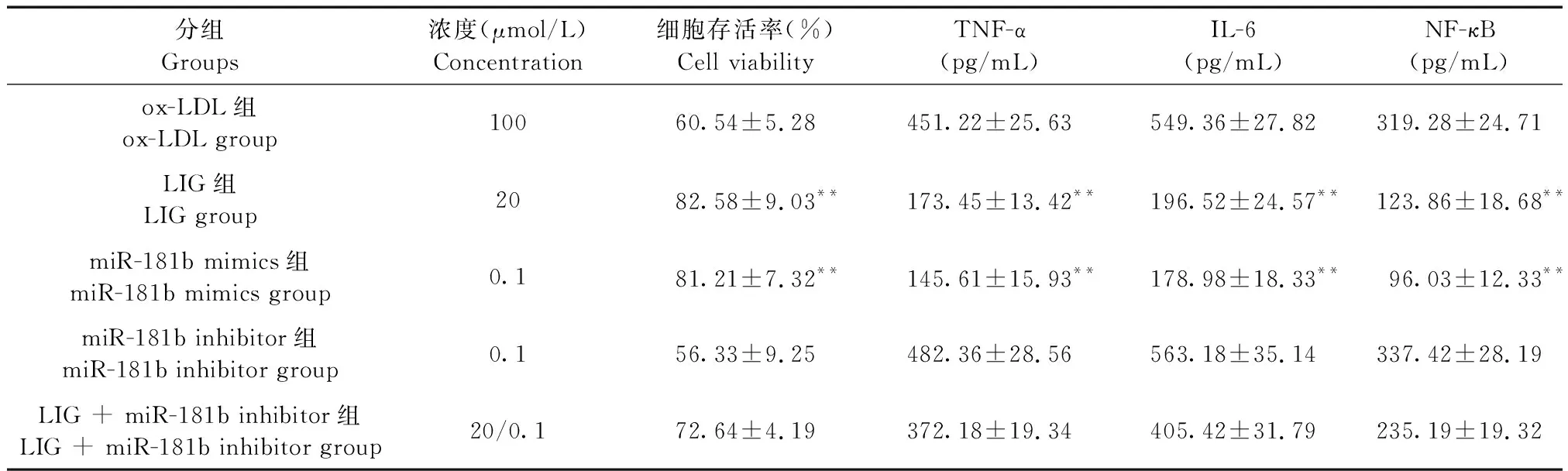
表5 各組細胞內炎性因子的濃度Table 5 Concentration of inflammatory cytokines in HUVEC of each group
注:與ox-LDL組相比,**P< 0.01。
Note. Compared with the ox-LDL group,**P< 0.01.
2.4 藁本內酯對HUVEC內NF-κB蛋白表達的調控
本研究采用Western blotting法檢測了細胞內NF-κB的蛋白水平,結果顯示,ox-LDL能顯著增加NF-κB蛋白表達,而LIG則能明顯降低其表達,與模型組相比差異有顯著性(P< 0.01,圖2)。為進一步探討LIG對HUVEC內NF-κB調節機制,本研究采用miR-181b mimics或miR-181b inhibitor分別激活或抑制細胞內miR-181b表達,結果發現,miR-181b mimics可以明顯抑制炎癥因子TNF-α、IL-6及NF-κB水平,而miR-181b inhibitor結果剛好相反,并且miR-181b inhibitor削弱了LIG對HUVEC細胞炎癥因子的調控作用(P< 0.01,表5),提示LIG很可能通過上調miR-181b表達,從而下調NF-κB表達,抑制細胞內炎癥反應。
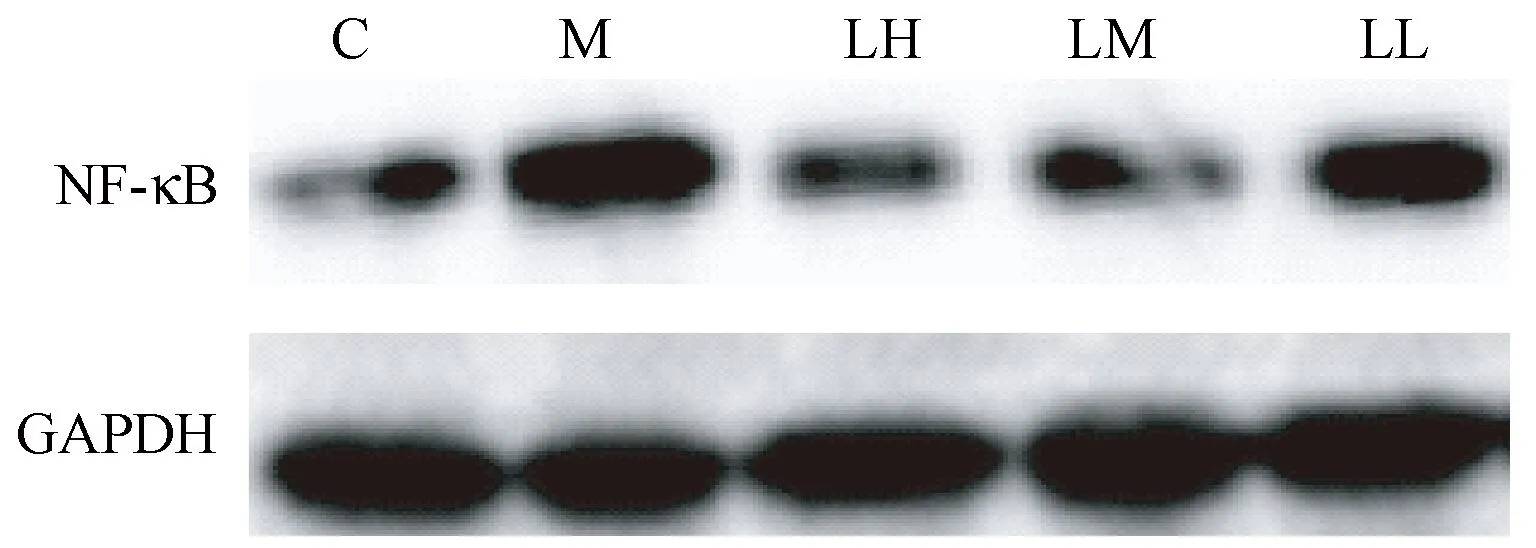
注:C:對照組;M:模型組;LH:藁本內酯高濃度組;LM:藁本內酯中濃度組;LL:藁本內酯低濃度組。圖2 各組細胞內NF-κB的蛋白含量Note. C: Control group; M: Model group; LH: High concentration of ligustilide group; LM: Medium concentration of ligustilide group; LL: Low concentration of ligustilide group.Figure 2 NF-κB protein level in HUVEC of each group
3 討論
動脈粥樣硬化(AS)是一種主要累及大中彈力血管的慢性、進行性、炎癥性疾病。炎性反應存在于AS的各個階段,從血管內膜的脂質沉積、斑塊形成、進展、再到破裂,血栓形成,核轉錄因子-κB(nuclear factor-κB,NF-κB)是調節炎癥最重要的轉錄因子。因此,抑制NF-κB信號可以延緩AS斑塊的進展[8-9]。
ox-LDL既可以誘導血管內皮細胞炎癥及氧化損傷,導致其功能降低。同時,ox-LDL還可以促進單核細胞分化成向巨噬細胞,并與巨噬細胞膜上的特異性受體Lox-1結合進入細胞內,越來越多的ox-LDL不斷被轉運至巨噬細胞內后即形成泡沫細胞,大量泡沫細胞堆積到血管內壁即形成AS鏡下可見的最早病變——脂紋[10-11]。本實驗中,ox-LDL可促進HUVEC細胞分泌TNF-α、IL-6、ICAM-1和VCAM-1增多,抑制細胞增殖,誘導細胞凋亡。說明ox-LDL可明顯誘導HUVEC出現炎癥樣損傷。
冠心病病人血清中TNF-α及IL-6的水平顯著高于正常人群,而在AS小鼠的血清中二者水平也明顯高于對照組小鼠,可以作為AS小鼠炎癥的血清標記物。血中TNF-α及IL-6濃度增高一方面可進一步增強血管及斑塊局部的炎癥反應,另一方面可不斷刺激血管內皮細胞,導致其生理功能受損,血管壁最內層的保護屏障被破壞,從而使得大量炎性細胞遷移、沉積于此。ICAM-1與VCAM-1可介導循環系統中白細胞特別是單核細胞與活化血管內皮細胞黏附并遷移聚集于內膜下,過度攝取脂質形成泡沫細胞,大量的泡沫細胞堆積逐漸形成粥樣斑塊[12-13]。
越來越多的研究表明,很多清熱解毒及活血化瘀類中藥都具有抗AS的功效,比如三七、丹參、黃連、虎杖、當歸等[14-16]。藁本內酯即是從中藥當歸、川芎中提取分離出的活性成分,動物實驗表明其具有抗AS損傷作用,然而其機制尚不明確。本實驗發現,藁本內酯具有保護HUVEC的藥理作用。10、20、40 μmol/L LIG預處理細胞2 h,可顯著減輕ox-LDL誘導的細胞炎癥損傷。LIG不僅能促進HUVEC增殖,抑制其凋亡,還能降低細胞內TNF-α、IL-6、ICAM-1與VCAM-1等細胞因子的分泌,有效抑制ox-LDL誘導的細胞炎癥反應。為探討LIG抗炎的具體機制,本研究檢測了HUVEC細胞內NF-κB及其上游miR-181b的表達水平。結果顯示,ox-LDL能顯著上調炎癥調控關鍵環節NF-κB mRNA和蛋白的表達,同時下調miR-181b的mRNA水平。miR-181b被證實是NF-κB上游的重要調控基因,在多種細胞或組織中均能調節NF-κB的表達。為驗證LIG是否通過miR-181b調節NF-κB表達,從而降低HUVEC細胞炎癥反應,本研究分別采用miR-181b mimics或miR-181b inhibitor上調或下調miR-181b水平,再觀察細胞增殖及細胞內炎性因子的分泌情況。數據顯示,miR-181b mimics能顯著減輕細胞損傷,降低炎性因子TNF-α、IL-6、NF-κB水平;miR-181b inhibitor則剛好相反。LIG和miR-181b inhibitor共同處理細胞后,削弱了LIG的細胞保護作用,同時增加了TNF-α、IL-6與NF-κB的濃度,說明LIG很可能通過上調miR-181b水平從而降低ox-LDL誘導HUVEC細胞炎癥水平,NF-κB是這一過程的重要中間環節。
由于時間和經費限制,此次本研究未能在動物水平驗證LIG抗AS的藥理作用是否與調控miR-181b/NF-κB途徑有關,這也將是本課題組后期工作的重要內容。

