澤瀉提取物對大鼠非酒精性脂肪肝的治療作用
龔 杰,丁 巖,干仲元,王慧雯,朱世敏,李漢清
(上海中醫藥大學教學實驗中心,上海 201203)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是一種無過量飲酒史、飲酒折含乙醇量小于140 g/周(女性< 70 g/周),以肝實質細胞脂肪變和脂肪貯積為特征的臨床病理綜合征,包括單純性脂肪肝以及由其演變的脂肪性肝炎(nonalcoholic steatohepatitis,NASH)和肝硬化,胰島素抵抗和遺傳易感性與其發病關系密切[1]。中醫認為病位在肝,病機特點以脾胃虛弱、肝郁氣滯、肝郁脾虛、腎精虧虛等為主,辨證以健脾化濕,疏肝健脾,化痰祛瘀等為治則,經典方劑柴胡疏肝散、二陳湯、茵陳五苓散、香砂六君子湯等,用藥頻次較高者為山楂、澤瀉、柴胡、何首烏、郁金、半夏、陳皮、茯苓、虎杖、大黃等[2]。
澤瀉為澤瀉科植物澤瀉Alismaorientale(Sam)Juzep的干燥塊莖,冬季莖葉開始枯萎時采挖,其性寒,味甘、淡,入腎、膀胱經,具有利水滲濕、泄熱、化濁降脂等功效,用于小便不利、水腫脹滿、泄瀉尿少、痰飲眩暈、熱淋澀痛、高脂血癥等病癥[3]。現代研究表明澤瀉主要化學成分為三萜類化合物(澤瀉醇A、澤瀉醇B及其衍生物)、倍半萜類化合物(澤瀉醇,環氧澤瀉烯,澤瀉萜醇A,B,C,磺酰澤瀉醇A,B,C,D等)、二萜類化合物以及一些類脂和糖類化合物;其主要藥理作用包括利尿,抗結石,抗高血壓、高血脂,抗動脈粥樣硬化,抗脂肪肝,免疫調節等[4-8]。
嚴偉倫[9]報道了60例患者的臨床試驗,發現澤瀉調脂顆粒方能減輕脾虛痰瘀型非酒精性脂肪肝患者神疲乏力、食物不振、腹脹、四肢困倦、胸脅脹滿等癥狀,其作用機制包括有效改善非酒精性脂肪肝患者的各項血脂水平(TC、TG、LDL-C、HDL-C)以及有效降低非酒精性脂肪肝患者的轉氨酶(AST、ALT)等。孫曉娜等[10]報道了100例患者的臨床試驗,結果發現澤瀉泄濁顆粒配合穴位貼敷能減輕非酒精性脂肪肝的嚴重程度,改善脂質代謝,保護肝功能。
雖然澤瀉對于非酒精性脂肪肝的治療效果已經明確,但是其作用機制報道較少。有研究表明脂質過氧化是內質網應激的誘導因素,內質網應激發生的過程主要是由于缺氧、氧化應激、錯誤合成蛋白質等多種因素誘發。內質網應激發生后,啟動了有關細胞信號轉導途徑抑制細胞蛋白合成,或者錯誤合成蛋白,對不能修復的細胞則通過內質網相關細胞凋亡機制誘導其凋亡以維持內環境穩態。過強和過長的內質網應激反應通過細胞能量耗竭、鈣穩態失衡、激活內質網應激相關細胞凋亡等機制使器官和組織產生損傷,其中內質網應激相關細胞凋亡是應激狀態下細胞損傷的主要機制。NAFLD發病機制的“二次打擊”假說又表明氧化應激造成的還原性谷胱甘肽水平下降可以引起JNK信號通路過度活化而誘導脂肪變性細胞死亡[11]。澤瀉作為臨床有效的抗脂肪肝藥物,不同的研究者做出了多方面探索,但卻沒有該方面機制的系統性研究。本文通過澤瀉提取物緩解內質網應激造成肝細胞損傷,從而達到對非酒精性脂肪肝的治療作用。
本研究通過體外HepG2細胞脂肪變性模型及大鼠非酒精性脂肪肝模型,對澤瀉提取物作用后重要生化指標、蛋白水平進行檢測,系統地總結澤瀉對于非酒精性脂肪肝的藥理作用機制,為臨床用藥進一步提供指導。
1 材料和方法
1.1 實驗材料
HepG2人肝癌細胞購自中國科學院干細胞庫。共16只雄性SPF級SD大鼠,體重(180±10) g,6 ~ 8周齡,由國家實驗動物種子中心上海分中心暨上海斯萊克實驗動物有限責任公司提供[SCXK (滬) 2017-0005]。實驗于上海中醫藥大學實驗動物樓SPF動物房進行[SYXK (滬) 2014-0008],動物飼養于動物房通風鼠籠中,環境溫度控制在20℃ ~ 22℃,濕度為50%,12 h∶12 h光亮和光暗循環。SD大鼠共分為四組,每組4只,分別為對照組,400、200、100 mg/kg AOE組。本實驗動物倫理編號:SZY201706008。所有操作均按照3R原則給予人道關懷。
1.2 主要試劑與儀器
澤瀉提取物由上海中醫藥大學中藥研究中心提供。澤瀉提取物的制備:將中藥澤瀉飲片成粗粉,分別用雙蒸水、50%甲醇和純甲醇煎煮,提取液濃縮回收,制備為澤瀉水浸膏、50%甲醇浸膏和澤瀉純甲醇浸膏。用含5%乙醇和7%聚丙烯醋酸纖維素鈉溶液作為澤瀉提取物增溶劑溶解浸膏,制得濃度均相當于每毫升1.0 g澤瀉生藥的3種提取物混懸液。
油酸(貨號:O1383)、棕櫚酸購自Sigma(貨號:P5585);改良油紅O染色試劑盒購自南京森貝伽生物科技有限公司;大鼠超氧化物歧化酶(SOD)ELISA試劑盒(貨號:SBJ-R0008)、大鼠天冬氨酸氨基轉移酶(AST)ELISA試劑盒(貨號:SBJ-R0117)、大鼠丙氨酸氨基轉移酶(ALT)ELISA試劑盒(貨號:SBJ-R0116)、大鼠甘油三酯(TG)ELISA試劑盒(貨號:SBJ-R0195)、大鼠高密度脂蛋白(HDL)ELISA試劑盒(貨號:SBJ-R0197)、大鼠低密度脂蛋白(LDL)ELISA試劑盒(貨號:SBJ-R0196)購自南京森貝伽生物科技有限公司;Anti-JNK1(phospho T183)抗體(貨號:ab47337)、Anti-JNK1抗體[EPR140(2)](貨號:ab110724)、Anti-β-catenin抗體(貨號:ab16051)、Anti-GRP78 BiP抗體(貨號:ab140318)、Anti-DDIT3抗體[9C8](貨號:ab11419)、Anti-STAT3抗體[9D8](貨號:ab119352)和Anti-XBP1抗體(貨號:ab37151)購自Abcam。
可見紫外分光光度計,上海尤尼柯公司(型號:WFZ UV-2100);低溫高速離心機,德國Eppendorf公司(型號:5430R);600 V電泳儀,美國GE Healthcare公司(型號:EPS601);SDS-PAGE電泳槽,北京六一公司(型號:DYCZ-24DN);qPCR擴增儀,美國ABI公司(型號:ABI 7500);病理切片機,上海徠卡儀器有限公司(型號:RM2016);倒置熒光顯微鏡,日本Nikon公司(型號:Nikon Eclipse Ti-SR)。
1.3 實驗方法
1.3.1 肝細胞脂肪變性模型建立
用油酸和棕櫚酸誘導HepG2細胞積累甘油三酯[12]。將油酸和棕櫚酸(OA∶PA=2∶1,摩爾比)混合后置于90°C以上水浴中加熱并不斷搖晃,5 ~ 10 min左右可完全溶解,趁熱移入DMEM完全培養基中,使油酸和棕櫚酸的終濃度為0.33 mol/L和0.17 mol/L。HepG2接種于孔板中,孵育過夜后,用DMEM低糖培養基進行細胞饑餓12 h,然后換成含0.5 mol/L NEFA的DMEM完全培養基培養24 h誘導HepG2細胞脂肪變性。
1.3.2 Western blot實驗
用混合脂肪酸誘導HepG2細胞脂肪變性后,加入生理鹽水和不同濃度的澤瀉提取物處理24 h后,收集細胞,含蛋白酶抑制劑的RIPA裂解液冰上裂解30 min得到蛋白樣品。BCA法測定總蛋白含量。100℃金屬浴變性10 min后,加入loading buffer上樣,跑電泳,轉膜后,5%牛奶封閉,按說明書比例加入一抗及二抗,加入底物,化學發光儀器上觀察條帶并計算灰度值。
1.3.3 非酒精性脂肪肝動物模型建立
SD大鼠喂以高脂飼料(10%豬油+ 2%膽固醇+ 88%標準飼料)及飲水[13],連續喂食8周。4只一組,分成四組,包括生理鹽水對照組及澤瀉提取物處理組(設置400、200、100 mg/kg澤瀉提取物分別為高、中、低劑量給藥組)。以灌胃方式給予藥物治療,每日2次,持續4周。對照組灌以生理鹽水。油紅染色陽性即為建模成功。
1.3.4 大鼠血清及肝組織采集
給藥4周后,全體大鼠連續禁食12 h。稱量體重,然后以1%戊巴比妥鈉(40 mg/kg)腹腔注射麻醉大鼠,腹主動脈取新鮮血液10 mL,4℃、3000 r/min離心5 min,取上清用于ELISA法生化指標測定;取血后,迅速解剖取得肝臟,PBS沖洗干凈血液后,置于含20倍體積TRIzol溶液的EP管中,液氮速凍后置于-80℃冰箱保存,用于總RNA提取、基因表達分析。
1.3.5 血清生化指標檢測
采集血清按照試劑盒說明書進行含量測定。
1.3.6 RT-PCR實驗
解剖所得肝組織加入20倍體積的TRIzol溶液并研磨。提取RNA后,按照反轉錄試劑盒步驟反轉錄為cDNA,并進行RT-PCR實驗。
1.3.7 油紅染色
解剖所得肝組織在OCT(聚乙二醇和聚乙烯醇的水溶性混合物)包埋后冰凍切片機切成15 μm的切片后,油紅染色判斷脂肪染色面積。
1.4 統計學方法
采用SPSS 17.0統計軟件進行統計分析。定量結果采用多個樣本油紅染色面積為準,組間比較采用單因素方差分析(one-way ANOVA),P< 0.05為差異有顯著性。
2 結果
2.1 油紅O染色判斷脂肪肝模型
高脂飲食誘發非酒精性脂肪肝模型組織中脂肪含量增高,肝細胞排列不規則,細胞內脂滴多為大泡,多囊泡型,油紅O染色后,脂肪滴多呈片分布,水溶性封片劑封片后,脂滴常匯集在切片表面(見圖1)。
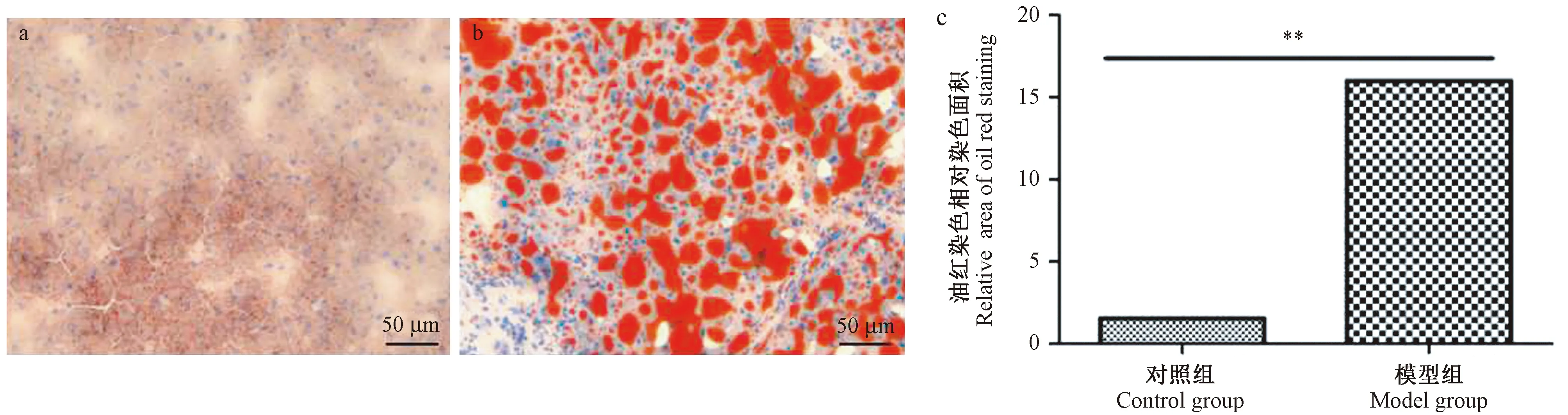
注:a:生理鹽水對照組;b:高脂飲食模型組;c:油紅染色相對染色面積定量結果。與對照組比較,**P< 0.01。圖1 油紅染色判斷脂肪肝模型(× 100)Note. a: Physiological saline control group; b: High-fat diet model group. c: Relative quantitative results of oil red staining. Compared with the control group,** P< 0.01.Figure 1 Evaluation of fatty liver model by oil red staining
2.2 Western blot檢測內質網應激標記蛋白水平
作為內質網應激的經典標記分子,當細胞發生內質網應激時會上調GRP78表達并且通過活化CHOP、JNK、caspase-12等通路誘導凋亡發生[14-15]。IRE-1/XBP-1信號通路是高度保守的內質網應激通路,內質網應激通過酶剪切作用活化XBP-1,后者的活化導致內質網伴侶分子表達增加[16-17]。內質網應激可以通過抑制FAK-STAT3通路引發線粒體功能紊亂[17]。如圖2 ~ 3所示,澤瀉提取物處理后,JNK1、p-JNK1、GRP78、CHOP和XBP-1表達水平明顯下降(P< 0.01),STAT3表達增加(P< 0.01),并且呈劑量依賴性。實驗結果說明澤瀉提取物可以抑制混合脂肪酸誘導HepG2細胞脂肪變性導致的內質網應激。

注:a:各組p-JNK1、JNK1、STAT3表達水平;b:各組STAT3表達定量結果;c:各組JNK1表達定量結果;d:各組p-JNK1表達定量結果。對照組:0 mg/kg AOE;低劑量組:100 mg/kg AOE;中劑量組:200 mg/kg AOE;高劑量組:400 mg/kg AOE。與高劑量組比較,* P < 0.05,** P < 0.01。圖3、6、7同。圖2 AOE處理后p-JNK1、JNK1、STAT3表達水平Note. a: Expression of p-JNK1,JNK1 and STAT3 in each group. b: Quantitative results of STAT3 expression in each group. c: Quantitative results of JNK1 expression in each group. d: Quantitative results of p-JNK1 expression in each group. Control group: 0 mg/kg AOE; low-dose group: 100 mg/kg AOE; moderate-dose group: 200 mg/kg AOE; high-dose group: 400 mg/kg AOE. Compared with the high-dose group,* P < 0.05,** P < 0.01. The same in Figures 3, 6 and 7.Figure 2 Expression levels of p-JNK1,JNK1 and STAT3 after AOE treatment
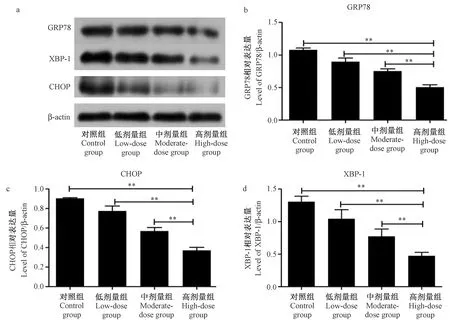
注:a:各組GRP78、XBP-1、CHOP表達水平;b:各組GRP78表達定量結果;c:各組CHOP表達定量結果;d:各組XBP-1表達定量結果。圖3 AOE處理后GRP78、XBP-1、CHOP表達水平Note. a: Expression of GRP78,XBP-1 and CHOP in each group. b: Quantitative results of GRP78 expression in each group. c: Quantitative results of CHOP expression in each group. d: Quantitative results of XBP-1 expression in each group.Figure 3 Expression levels of GRP78,XBP-1 and CHOP after AOE treatment
2.3 透射電鏡結果
混合脂肪酸作用于HepG2細胞后會導致細胞發生脂滴蓄積、空泡化等脂肪變性[19]。如圖4所示,經過澤瀉提取物處理,脂肪變性HepG2細胞中脂滴減少。

注:a:HepG2澤瀉高劑量組(400 mg/kg AOE);b:HepG2脂肪性病變組。箭頭指示肝細胞脂變。圖4 HepG2透射電鏡照片(× 3500)Note. a: HepG2 in the high-dose group (400 mg/kg AOE); b: HepG2 in the fatty degeneration group. Arrows indicate fatty degeneration of the liver cells.Figure 4 Transmission electron microscopy of HepG2
2.4 澤瀉提取物對SD大鼠肝脂肪性病變的影響
重度脂肪肝組織中脂肪含量高,肝臟組織細胞腫脹變形,通過高、中、低劑量的澤瀉治療后,從圖5中顯示,隨著藥物劑量濃度的增加,肝臟脂肪性病變隨之好轉。
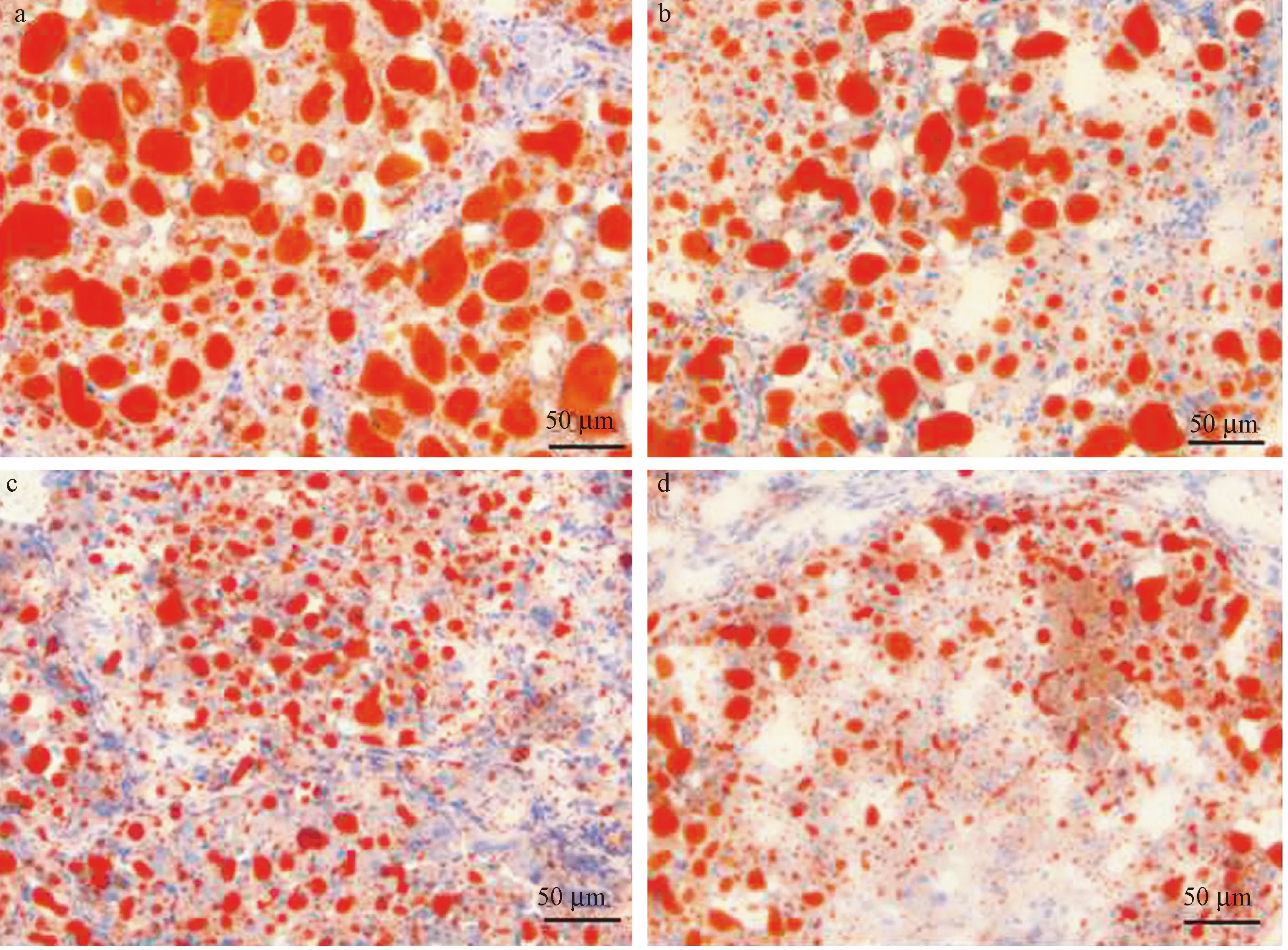
注:a:生理鹽水對照組;b:澤瀉提取物100 mg/kg處理組;c:澤瀉提取物200 mg/kg處理組;d:澤瀉提取物400 mg/kg處理組。圖5 油紅染色檢測澤瀉提取物對SD大鼠肝脂肪性病變的影響(× 100)Note. a: Physiological saline control group; b: 100 mg/kg of AOE treatment group; c: 200 mg/kg of AOE treatment group; d: 400 mg/kg of AOE treatment group.Figure 5 Effect of AOE on hepatic steatosis of SD rats detected by oil red staining
2.5 ELISA結果
脂肪蓄積發生在非酒精性脂肪肝早期病程中。脂肪蓄積導致肝細胞內質網應激、線粒體應激反應及自噬受損等脂毒性,以及TG、VLDL水平降低[20]。AST、ALT作為肝功能評價指標,其升高預示著肝損傷。非酒精性脂肪肝患者由于肝脂肪代謝紊亂會出現血清HDL降低和LDL升高[21-23]。如圖6結果所示,澤瀉提取物處理后,大鼠血清中AST、ALT、TG、LDL的表達水平呈劑量依賴性下降(P< 0.01),SOD、HDL表達升高(P< 0.01)。結果表明,澤瀉提取物對非酒精性脂肪肝肝損傷具有治療作用。

注:a:ALT檢測水平;b:AST檢測水平;c:SOD檢測水平;d:TG檢測水平;e:HDL檢測水平;f:LDL檢測水平。圖6 ELISA檢測血清生化指標Note. a: ALT detection level. b: AST detection level. c: SOD detection level. d: TG detection level. e: HDL detection level. f: LDL detection level.Figure 6 ELISA detection of serum biochemical indicators
2.6 RT-PCR結果
非酒精性脂肪肝會導致CYP2E1、CYP2A5上調表達[24-25]。如圖7結果顯示,澤瀉提取物處理后,肝組織內CYP2E1、CYP2A5基因表達水平明顯下降(P< 0.01),尤其是高劑量組。
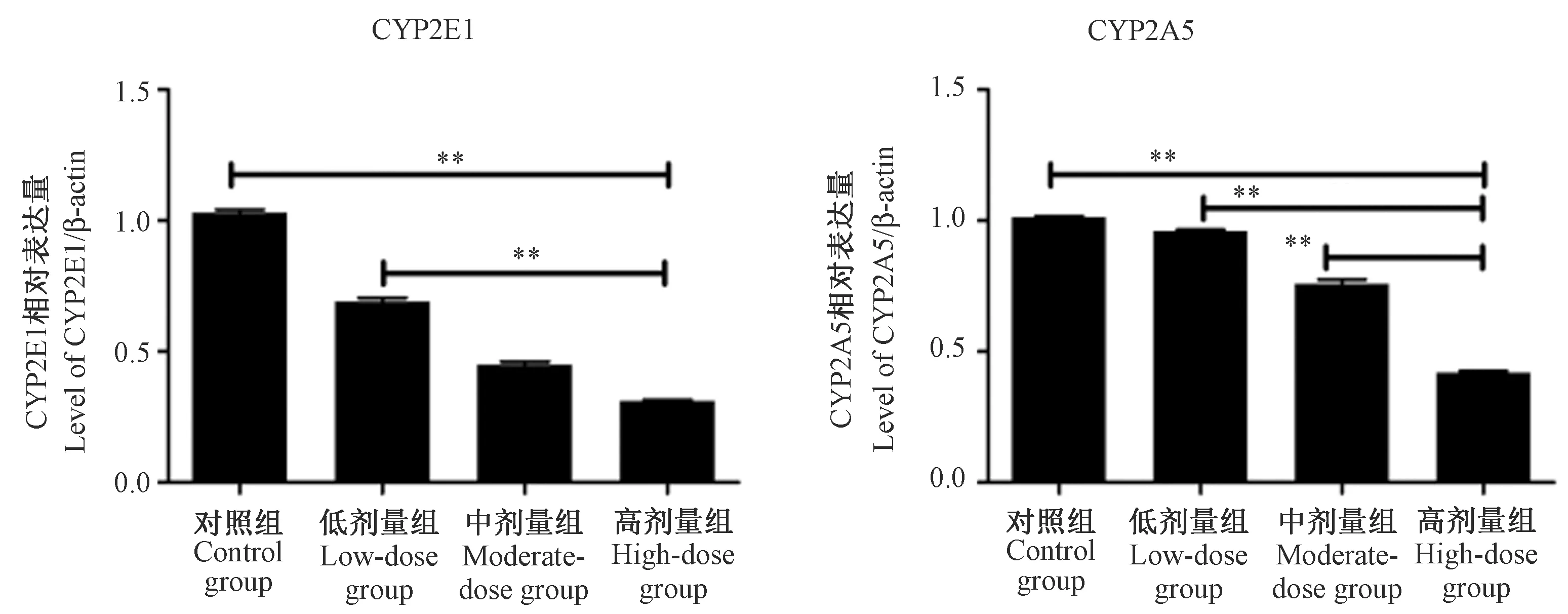
注:a:CYP2E1基因表達水平;b:CYP2A5基因表達水平。圖7 RT-PCR檢測CYP2E1、CYP2A5基因表達水平Note. a: CYP2E1 gene expression level. b: CYP2A5 gene expression level.Figure 7 RT-PCR detection of CYP2E1 and CYP2A5 gene expression levels
3 討論
近年來,因生活方式改變、營養過剩等,非酒精性脂肪肝的發病率呈逐年上升的趨勢[26]。30%的脂肪肝患者如果得不到有效治療會逐漸進展成非酒精性脂肪性肝炎;如果病情繼續進展,25%的非酒精性脂肪性肝炎可能發展成肝硬化或終末期肝病[27],對人類健康造成嚴重威脅。
臨床研究資料表明,痰瘀互結為非酒精性脂肪肝(NAFLD)的重要發病機制。丹參具有活血祛瘀之功,澤瀉功能除水濕、消痰濁,兩藥為中醫臨床治療NAFLD過程中使用頻率較高的中藥[28]。三萜類成分是澤瀉中的主要成分之一,在澤瀉的功效中起著非常重要的作用[29]。除了有效成分的確定,不同研究者從不同角度對其作用機制進行了探索性研究。
李金海[30]通過對應用異功澤瀉湯治療的52例非酒精性脂肪性肝炎患者及水飛薊賓膠囊治療的48例患者進行對照觀察,發現異功澤瀉湯在降低血脂、改善肝功能等方面均優于水飛薊賓膠囊,澤瀉可抑制外源性TG、TC的吸收,影響內源性TC代謝及抑制TG肝內合成,從而改善肝臟的脂肪代謝。王磊[31]通過對34例使用澤瀉飲合京三棱丸治療的非酒精性脂肪肝進行研究發現澤瀉飲合京三棱丸能有效改善TC、TG的水平,治療脂肪肝臨床療效顯著。姜國賢等[32]報道了32例口服調肝降脂(青蒿、柴胡、山楂、茯苓、澤瀉、法半夏、白芍、肉豆蔻、韭菜汁等)中藥治療非酒精性脂肪肝的臨床研究結果,發現澤瀉通過抑制外源性甘油三酯在肝內的合成,影響與膽固醇代謝有關的酶及抑制肝內甘油三酯合成等藥理作用而發揮抗脂肪肝效果。
隨后,又有不同的研究者從不同方面對澤瀉護肝功能進行了研究。唐外姣[33]報道了護肝清脂片(由澤瀉、山楂、三七、蒲黃、荷葉及陳皮六味中藥組成)通過上調大鼠肝臟中沉默信息因子SIRT1的mRNA及其蛋白的表達,可以顯著改善胰島素抵抗,同時減緩氧化應激/脂質過氧化損傷,抑制肝臟膠原沉積,有效調節血脂代謝紊亂以及抑制肝臟脂質沉積。Park等[34]報道了澤瀉乙醇提取物可以通過下調C/EBPβ表達,降低PPARγ和C/EBPβ表達水平來抑制OP9細胞脂肪分化。Jang等[35]報道了澤瀉塊莖甲醇提取物(MEAO)可以通過抑制肝脂肪生成基因、VLDLR等基因表達,增加ApoB分泌來減弱肝細胞內質網應激,阻止肝細胞病理性脂肪變性。曾璐[36]研究發現澤瀉醇A-24-醋酸酯能逆轉肝脂肪變性HepG2細胞的TNF-α和IL-6水平的增加。郭雨雅[37]報道了加味澤瀉湯對可能通過抑制TLR4/NF-κB、MAPK信號通路上MyD88、NF-κB、P65、p-P65、P38、p-P38、MAPK蛋白的表達,抑制肝臟炎癥的產生、緩解肝臟的損傷,對高脂飲食誘導的大鼠NAFLD模型有良好的治療效果。杜金梁等[38]報道了澤瀉提取物對油酸誘導建鯉脂肪肝細胞損傷中生化指標及CYP1A蛋白表達的影響。孫曉琦[39]報道了加味澤瀉湯可能通過改變NAFLD小鼠腸道微生物組成、改善腸粘膜屏障、降低肝臟內炎癥因子表達及減輕肝臟炎癥來發揮作用。
其它關于非酒精性脂肪肝的治療機制研究也有很多,對澤瀉治療NAFLD的藥理作用機制研究有很大的參考意義。田衛東[40]報道了阿托伐他汀能通過抑制Wnt/β-catenin信號通路改善大鼠非酒精性脂肪肝肝臟損傷。鄭培永等[41]報道了強肝膠囊和辛伐他汀可能通過改善瘦素抵抗,增加肝臟瘦索受體mRNA表達及P-JAK2和P-STAT3蛋白水平而對NAFLD大鼠肝臟脂質和炎癥有較好的治療作用。孫立云[42]報道了2 mmol/L DL-乙硫氨酸作用奶牛原代肝細胞24 h可成功制備脂肪變性肝細胞模型,10 μg/mL澤瀉作用48 h,可以降低肝細胞CYP450的表達,對脂肪變性肝細胞具有較好的保護作用。楊文強等[43]報道了脂肪乳灌胃可以通過上調Wnt3α、β-catenin、Collal mRNA表達誘導非酒精性脂肪肝大鼠肝纖維化。關麗嫦等[44]報道了高脂飲食可以通過誘導肝組織JNK1、p-JNK1蛋白表達水平升高,激活肝細胞內JNK信號通路同時抑制了脂聯素的生成,進而產生和加重NAFLD。
這些研究都為澤瀉治療NAFLD作用機制探索提供了重要依據,但是仍然沒有澤瀉作用機制的系統性研究。本文系統性地研究闡明了澤瀉對非酒精性脂肪肝的治療機制。但是本研究仍然存在不足,需要進一步實驗來驗證澤瀉對肝細胞脂肪蓄積的緩解作用及其機制,因為脂肪蓄積是肝損傷的根本原因。總之,本文通過研究不同濃度澤瀉對非酒精性脂肪肝血清生化指標、JNK信號通路及脂肪變性肝細胞內質網應激的影響系統地研究了澤瀉治療NAFLD的作用機制,為澤瀉臨床治療NAFLD提供了重要理論依據。

