枯草芽胞桿菌YB-05對小麥抗病性相關 防御酶系的誘導作用
孫潤紅, 徐俊蕾, 楊麗榮, 張 潔, 夏明聰, 武 超, 薛保國*, 吳 坤
(1. 河南省農業科學院植物保護研究所, 河南省農作物病蟲害防治重點實驗室, 農業部華北南部農作物有害生物綜合治理重點實驗室, 河南省作物保護國際聯合實驗室, 鄭州 450002; 2. 河南農業大學生命學院, 鄭州 450002)
小麥為禾本科植物,是世界上分布最廣泛的糧食作物,我國主要產于華北及東北地區。病害問題一直是影響小麥產量和質量的重要因素,小麥病害的防治是小麥生產的重中之重,也是提高小麥產量的重要途徑。化學藥劑長期使用或使用不當易導致病原菌抗藥性、環境污染及農藥殘留等問題。近年來,生物防治由于其安全、低毒等特點已成為國內外研究的熱點。拮抗細菌在植物病害防治中起到了非常重要的作用,無論是在自然發生的生物拮抗現象還是在生物防治中,細菌的生防效果都非常明顯[1]。在眾多的生防細菌中,枯草芽胞桿菌Bacillussubtilis憑借其易培養、環境適應能力強、對人畜無毒等優點而受到青睞[2-3]。植物對病害及其他逆境的抗性與多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)等多種酶的活性變化有關[4-6]。大量研究表明,生防菌可以誘導這些植物抗病相關防御酶產生變化,增強抗病能力[7]。易龍等研究發現,芽胞桿菌Bn-130菌液可誘導辣椒體內POD、PPO和PAL活性增高[8]。周林等采用灌根法接種枯草芽胞桿菌TR21發酵液、菌體及發酵上清液后,香蕉根系內POD、PPO和PAL活性均高于空白對照[9]。林陳強等發現,枯草芽胞桿菌CS16發酵液及上清液處理香蕉苗均能誘導香蕉葉片中SOD、PPO、PAL和POD等防御酶活性變化[10]。目前,國內生防菌對小麥抗病防御反應酶影響的研究尚未見報道,為此本研究選擇PAL、POD、SOD、PPO、CAT作為抗病性反應指標,研究了生防菌YB-05對小麥植株抗病相關酶的影響,以明確YB-05對抗病防御酶的誘導機制,為小麥生產中合理利用YB-05防治小麥真菌病害和深入研究YB-05的生防機制奠定理論基礎。
1 材料與方法
1.1 試驗材料
生防菌枯草芽胞桿菌BacillussubtilisYB-05為本實驗室分離得到,現保藏于中國微生物菌種保藏管理委員會普通微生物中心,保藏編號為CGMCC02NO.6498。
小麥全蝕病菌Gaeumannomycesgraminisvar.triticiGGT007為本實驗室從小麥根部分離得到,并在本實驗室保存。
小麥品種:供試小麥品種為‘鄭麥366’。
試驗所用培養基為PDA和PDB培養基。
1.2 試驗方法
1.2.1 菌株的制備及接種
將YB-05菌株在PDA平板中劃線活化,27℃下恒溫培養24 h,得到活化的YB-05菌株單菌落,然后挑取單菌落接種于PDB培養基中,27℃,125 r/min條件下振蕩培養48 h即得YB-05種子液,調節菌液濃度至106cfu/mL的菌懸液,備用。
1.2.2 小麥的催芽與誘導處理
挑選大小一致的小麥種子,首先用75%乙醇處理5 s,滅菌水沖洗3次,0.1%升汞消毒9 min,再用無菌水沖洗5次,然后將經消毒處理的小麥種子平鋪于直徑12 cm無菌平皿中,加入5 mL無菌水, 放置于室溫。1 d后將露白的小麥種子轉移至另一個鋪有無菌濾紙的平皿中(直徑12 cm),每皿放置約50粒種子,加入10 mL無菌水,放置于室溫。2 d后,將根長2~3 cm的發芽小麥轉移至滅菌組培瓶,處理組分別為每瓶接種5株小麥和5 mL 106cfu/mL YB-05菌懸液、5株小麥和5 mL GGT007菌懸液(0.5 g GGT007菌絲溶于5 mL PDB培養基中)、5株小麥和5 mL YB-05和 GGT007混合懸液(0.5 g GGT007菌絲溶于5 mL YB-05菌懸液中),對照組為5株小麥和5 mL PDB培養基。
分別于處理后24、48、72、96、120 h取小麥幼葉和小麥根提取粗酶液,檢測不同時間小麥體內相關防御酶的活性變化。
1.2.3 誘導抗性測定
分別取0.1 g 葉片和根部用于提取粗酶,PAL、POD、SOD、PPO、CAT等酶活均按照酶活性試劑盒(蘇州科銘生物技術有限公司)步驟,利用可見光分光光度計檢測與誘導植物抗病性密切相關的防御酶活性(PAL、PPO、SOD、POD、CAT)變化。
2 結果與分析
2.1 YB-05發酵液對小麥葉片和根部苯丙氨酸解氨酶(PAL)活性的影響
由圖1可知,經YB-05發酵液誘導后,各濃度處理組的小麥葉片和根部PAL活性均高于對照處理組。空白對照組小麥葉片和根部的PAL活性最低,在試驗期間無明顯變化。Y+G處理組小麥葉片中PAL活性明顯高于其他3組處理,并在處理后的96 h達到峰值,為46.705 U/g,為對照組的1.74倍,與對照組差異顯著。Y處理組小麥葉片的PAL活性在72 h時達到峰值,為35.195 U/g,為對照組的1.65倍,與對照組差異顯著。G處理組小麥葉片的PAL活性在試驗期間也有顯著變化,在48 h酶活性達到峰值,為39.325 U/g,為對照組的1.41倍,與對照組差異顯著。Y+G處理組小麥根部中PAL活性明顯高于其他3組處理,并在處理后72 h達到峰值131.536 U/g,為對照組的1.65倍,與對照組差異顯著。Y和G處理組小麥根部的PAL活性均在96 h時達到峰值,為112.324 U/g和102.576 U/g,分別為對照組的1.33、1.21倍,與對照組差異顯著。因此,YB-05發酵液和全蝕病菌均能誘導小麥葉片和根部中PAL的活性增強,且YB-05發酵液和全蝕病菌共同處理的活性高于單獨處理,可見YB-05發酵液和全蝕病菌共同誘導對PAL具有協同增效作用。
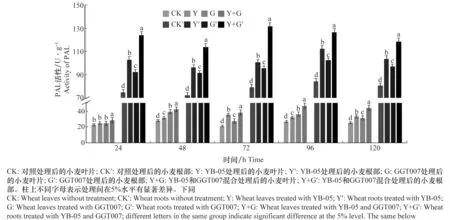
圖1 生防芽胞桿菌YB-05及全蝕病菌GGT007對小麥PAL活性的影響Fig.1 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on PAL activity in wheat
2.2 YB-05發酵液對小麥葉片和根部過氧化氫酶(CAT)活性的影響
生防菌及病原菌共同處理后小麥葉片和根部CAT活性如圖2所示。Y+G處理組小麥葉片CAT活性在試驗期間均高于其他3組處理,且在72 h達到峰值,為1 259.565 U/g,為對照組的2.42倍。G處理組中小麥葉片的CAT活性在96 h達到峰值,為784.102 U/g,為對照組的1.33倍。Y處理組小麥葉片CAT活性變化規律與Y+G處理組一樣,在72 h達到峰值,為974.094和1 259.565 U/g,為對照組的1.87和2.42倍。3組處理CAT活性均高于空白對照,且Y+G同時處理的小麥葉片CAT活性比單獨Y或G處理的小麥葉片CAT活性高。沒有進行任何處理的對照組小麥葉片CAT活性在120 h內變化不大。Y+G處理組、Y處理組以及G處理組小麥根部CAT活性在96 h分別達到206.241、184.518、173.46 U/g峰值,與對照組相比CAT活性顯著增高,峰值分別是對照組的1.74、1.56、1.46倍,與對照組差異顯著。對照組小麥根部CAT活性變化范圍不大。比較4個處理組CAT活性變化,結果顯示,Y+G處理組小麥葉片和根部的酶活性均顯著高于其他3個處理組,誘導效果最佳。
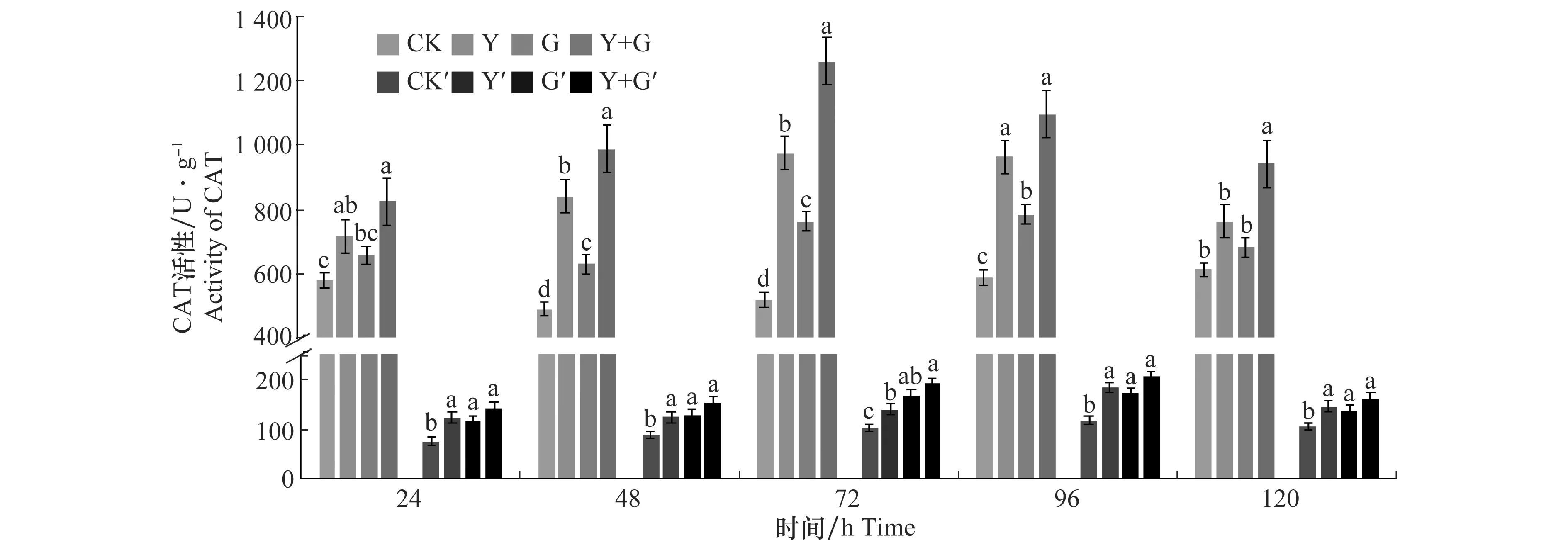
圖2 生防芽胞桿菌YB-05及全蝕病菌GGT007對小麥CAT活性的影響Fig.2 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on CAT activity in wheat
2.3 YB-05發酵液對小麥葉片和根部過氧化物酶(POD)活性的影響
枯草芽胞桿菌YB-05和小麥全蝕病菌誘導小麥葉片POD活性變化見圖3,由圖可知,Y+G處理組、Y處理組以及G處理組小麥葉片POD活性在第48 h分別達到16 829.274、13 785.902 5、11 653.265 U/g峰值,與對照組相比POD活性顯著增高,峰值是對照組的2倍左右。Y+G處理組、G處理組的小麥根部POD活性在72 h時分別達到峰值56 424.79、52 715.86 U/g,Y處理組在24 h達到峰值48 555.945 U/g是對照組的1.52、1.42、1.7倍,差異顯著。試驗期間對照組小麥葉片和根部POD差異不大。同時接種生防菌YB-05和病原菌GGT007的小麥葉片和根部的POD活性比單獨接種生防菌YB-05或病原菌GGT007的POD活性高。說明同時添加YB-05發酵液和小麥全蝕病菌GGT007對小麥葉片和根部POD活性顯著高于其他3個處理組,誘導效果最佳。
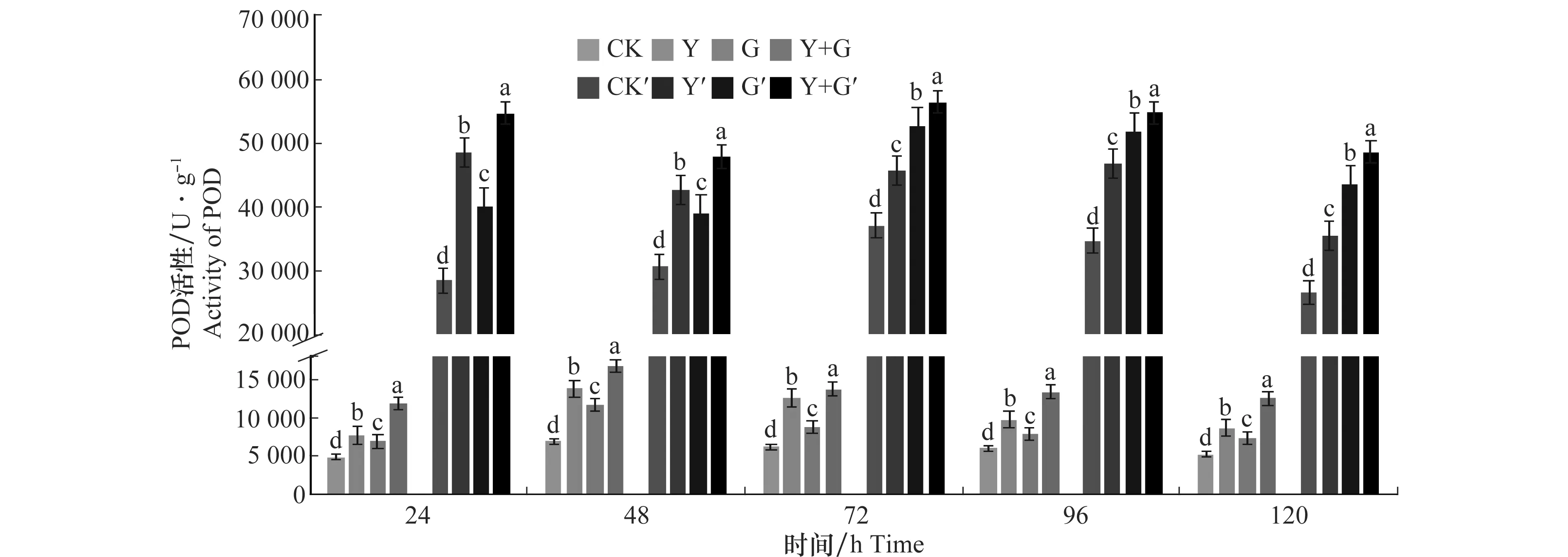
圖3 生防芽胞桿菌YB-05及全蝕病菌GGT007對小麥POD活性的影響Fig.3 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on POD activity in wheat
2.4 YB-05發酵液對小麥葉片內超氧化物歧化酶(SOD)活性的影響
SOD活性檢測結果(圖4)所示,Y+G處理組小麥葉片SOD活性呈下降趨勢,且在誘導后24 h達到峰值104.687 U/g,為對照組的2.27倍。Y處理組、G處理組小麥葉片SOD活性均在96 h達到峰值,分別為對照組的1.63倍和1.91倍,達到73.52、86.32 U/g,與對照組差異顯著; Y+G處理組小麥根部SOD活性在試驗期間均高于其他3組處理,且在72 h達到高峰,峰值為1 977.04 U/g。Y處理組小麥根部SOD活性變化規律與Y+G處理組一致,在72 h達到峰值,為1 493.43 U/g。G處理組中小麥根部的SOD活性在96 h達到峰值,為1 246.89 U/g。3個處理組Y、G和 Y+G處理小麥根部SOD活性均高于對照,且Y+G同時處理SOD活性比單獨Y或G處理的SOD活性高。沒有進行任何處理的對照組無論根或葉的SOD活性在120 h內變化不大。
2.5 YB-05發酵液對小麥葉片內多酚氧化酶(PPO)活性的影響
枯草芽胞桿菌YB-05和小麥全蝕病菌對小麥葉片和根部PPO活性的影響結果見圖5。Y+G處理組的小麥葉片PPO活性在96 h時達到峰值97.44 U/g,是對照組的2.4倍,差異極顯著。Y處理組、G處理組小麥葉片的PPO活性均為先增高后降低的趨勢,均在72 h達到峰值84.2、72.58 U/g,分別為對照的1.96倍、1.69倍,與對照組差異顯著。Y+G處理組小麥根部PPO活性明顯高于其他3組處理,并在處理后的72 h達到峰值22.564 U/g,為對照組的2.07倍,差異顯著。Y處理組和G處理組的PPO活性與Y+G處理組變化趨勢一致,均在72 h時達到峰值17.786 U/g和14.265 U/g,分別為對照組的1.63、1.31倍,與對照組差異顯著。結果顯示YB-05發酵液和全蝕病菌GGT007均能誘導小麥葉片和根部PPO活性增強,且兩者共同處理的活性高于單獨處理,可見枯草芽胞桿菌YB-05發酵液和全蝕病菌共同誘導對PPO具有協同增效作用。
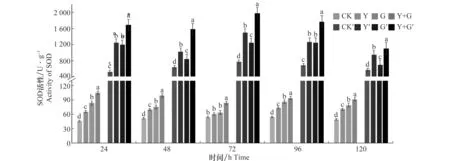
圖4 生防芽胞桿菌YB-05及全蝕病菌GGT007對小麥SOD活性的影響Fig.4 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on SOD activity in wheat
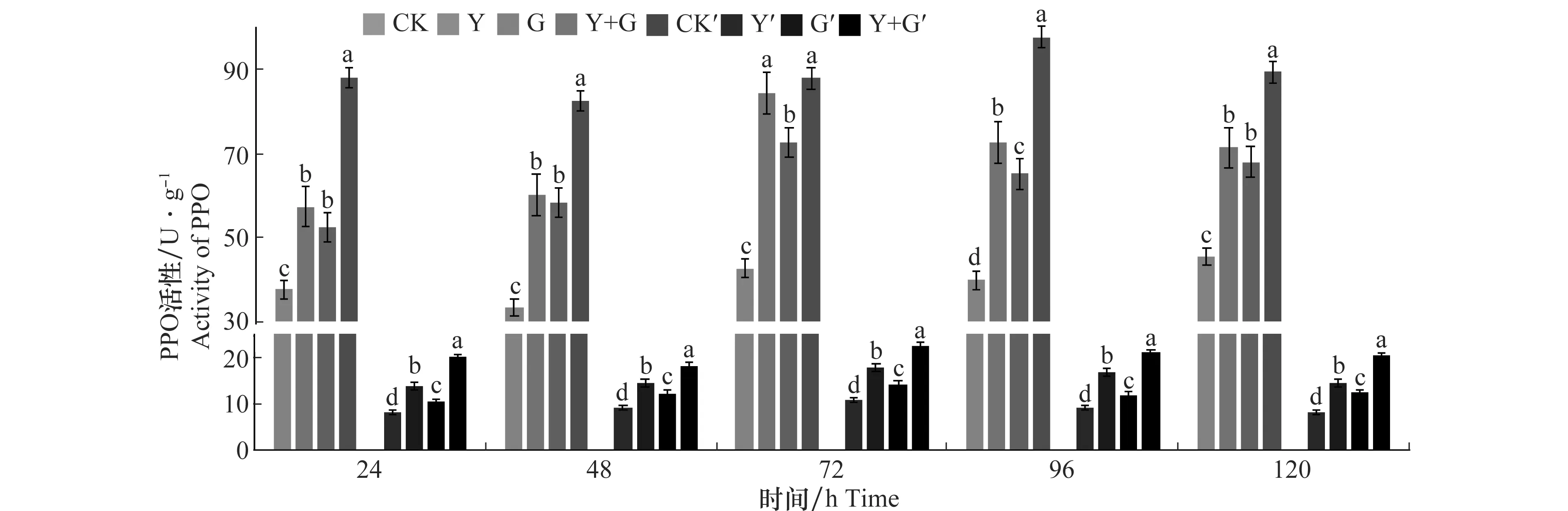
圖5 生防芽胞桿菌YB-05及全蝕病菌GGT007對小麥PPO活性的影響Fig.5 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on PPO activity in wheat
3 結論與討論
當植物受病原菌侵染或誘導處理后,與抗病反應相關的保護性酶活性升高是誘導抗性產生的重要機制之一,其中CAT、SOD、POD、PAL和PPO是植物體內與抵制病原微生物侵染有關的重要酶,其活性的變化通常作為衡量植物體內防衛反應的重要指標[11]。

在本試驗中,施用生防菌YB-05和接種小麥全蝕病菌后,利用可見光分光光度計檢測與誘導植物抗病性密切相關的防御酶活性(PAL、PPO、SOD、POD、CAT)變化。結果顯示,小麥經生防菌與病原菌混合處理、病原菌處理、生防菌處理后,葉片和根部與植物防御抗病相關的PPO、POD、SOD、PAL、CAT防御酶活性均比對照組高,說明無論接種生防菌或小麥全蝕病菌,都能刺激小麥體內防御酶活性的增加,從而達到抵御病害侵染的效應,增強其抗病性。其中生防菌與病原菌混合處理后抗性相關酶活最高,葉片中PAL、POD、SOD、PPO、CAT酶活峰值分別在96、48、24、96和72 h達到46.705、16 829.274、104.687、97.44和1 259.565 U/g,為對照組的1.74、2.44、2.27、2.40和2.42倍。根部PAL、POD、SOD、PPO、CAT酶活峰值分別在72、72、72、72和96 h分別達到131.536、56 424.79、1 977.04、22.564和206.241 U/g,為對照組的1.65、1.52、2.57、2.07、1.74倍。表明枯草芽胞桿菌YB-05和小麥全蝕病菌均能誘導小麥葉片和根部的防御酶活性增強,兩者共同處理后小麥葉片和根部5種防御酶活性均高于單獨處理,說明枯草芽胞桿菌YB-05和小麥全蝕病菌GGT007共同誘導具有協同增效作用。
目前防治小麥全蝕病菌主要以化學防治為主,但長期大量使用化學藥劑使得抗藥性不斷增強,農藥殘留易造成食品安全問題,同時會加劇環境污染。生物農藥以其對人畜及生態環境無害的特點越來越受到人們的關注,而天然生防微生物以其獨特的作用機理一躍成為生物農藥發展熱點。枯草芽胞桿菌YB-05是河南省農業科學院植物保護研究所通過對其16S rDNA基因序列的分析發現的一種對小麥全蝕病菌具有顯著抑制作用的菌株,本試驗發現誘導抗性可能是枯草芽胞桿菌YB-05防治小麥真菌病害的重要機制之一。但對其發酵液在田間的防病效果還有待評價。因此,后續的研究有必要通過大田試驗以明確其抗病潛能,驗證其抗性誘導機理,為實現該菌株的開發應用提供技術支持。

