Bcl2及Bak1重組表達腺病毒對MG63細胞的影響
黃宏興 柴爽 黃紅 萬雷 張志海 王吉利
1. 廣州中醫藥大學附屬骨傷科醫院,廣東 廣州 510240 2. 廣州中醫藥大學,廣東 廣州 510405
骨質疏松癥(osteoporosis,OP)是一種以骨量減少及骨微結構損壞,導致骨脆性增加,易于發生骨折為特征的全身性骨骼疾病。該病的發生與骨形成和骨吸收失衡密切相關,在骨重建過程中,吸收的骨量多于形成的新骨而造成骨重建脫偶聯,是骨質疏松發生的病理基礎[1]。過去的研究多關注破骨細胞過度活化,但近年來成骨細胞功能異常在骨質疏松發病中的作用越來越受到重視[2-5]。研究發現,成骨細胞凋亡在骨質疏松癥的發病過程中起著非常重要的作用[6]。關于細胞調亡的研究提示Bcl2(B-cell lymphoma-2)蛋白家族是調控細胞線粒體調亡途徑的關鍵因子,Bak1(BCL2-antagonist/killer 1)作為Bcl2家族的促凋亡蛋白,對線粒體凋亡途徑中線粒體外膜的通透化非常重要[7]。為進一步研究成骨細胞凋亡在骨質疏松骨形成中的機制,本研究采用Bcl2、Bak1重組腺病毒載體單獨或共轉染人骨肉瘤細胞MG63,并檢測其對細胞及相關蛋白的影響。
1 材料與方法
1.1 材料
1.1.1細胞及重組腺病毒載體:人成骨肉瘤細胞(MG63,由中國科學院上海細胞所細胞庫提供)、Bcl2、Bak1重組腺病毒載體(本課題組前期已構建)。
1.1.2主要試劑和儀器:DMEM培養基、胎牛血清、Pen/Strep(均購自美國Gibco公司,批號分別為C11995500BT、10099-141、15140-122),噻唑藍(MTT)檢測試劑盒、Triton-100、EGTA(美國Sigma公司,批號M2128),堿性磷酸酶(alkaline phosphates,ALP)活性檢測試劑盒(上海碧云天生物有限公司,批號P0321),Calcium Orange TM Indicators(美國Molecular Probes公司),蛋白酶抑制劑/磷酸化抑制劑、ECL發光液(德國Merck公司),抗骨橋蛋白(osteopontin,OPN)抗體、抗Runx2抗體、抗腫瘤壞死因子-α(tumor necrosis factor -α,TNF-α)抗體(美國Abcam公司,批號分別為ab91655、ab23981、ab6671),抗結締組織生長因子(connective tissue growth factor,CTGF)抗體(美國Santa公司,批號Sc-25400),羊抗兔二抗(美國Jackson公司,批號111-035-003)蛋白Marker(美國Fermentasa公司),細胞培養箱(法國NaPCO公司)酶標儀(美國Thermo公司),Aria Ⅱ流式細胞儀(美國BD公司),ChemiDoc MP凝膠成像系統(美國Bio-Rad公司)。
1.2 方法
1.2.1細胞活性檢測:收集對數生長期MG63細胞,制成細胞懸液,調整細胞濃度為1×104個/mL。96孔板中每孔加入200 μL細胞懸液,設置空載腺病毒干預組(A組)、Bcl2重組腺病毒轉染組(B組)、Bak1重組腺病毒轉染組(C組)、Bcl2、Bak1重組腺病毒共轉染組(D組),每組設置3個復孔。培養24 h后,用Bcl2、Bak1重組腺病毒單獨或共轉染MG63細胞(MOI=50)。轉染48 h后,棄舊培養基后再補充新鮮培養基,并分別向每孔中加入10 μL 5 mg/mL MTT溶液,繼續于細胞培養箱內培養4 h后終止培養,按照試劑盒說明書操作步驟測定各孔吸光度A,根據各組A計算細胞活性:(A實驗組/A正常細胞組)×100%。
1.2.2細胞ALP活性檢測:收集對數生長期MG63細胞,制成細胞懸液,調整細胞濃度為1×105個/mL。于6孔板中每孔加入2 mL細胞懸液,同上分為4組,每組設置3個復孔。常規條件下培養24 h后,用Bcl2、Bak1重組腺病毒單獨或共轉染MG63細胞(MOI=50)。轉染48 h后,棄舊培養基,消化收集細胞,提取細胞總蛋白,12 000 rpm離心30 min,取上清,考馬斯亮藍蛋白定量。按照ALP活性檢測試劑盒說明書操作步驟操作,在405 nm或400~415 nm范圍內檢測各孔吸光度。按照以下公式計算堿性磷酸酶活性:由標準曲線計算的酶活×稀釋倍數(2.5)/蛋白濃度(μg/μL)。
1.2.3細胞內鈣離子濃度檢測:選取對數生長期MG63細胞,以1×105個/孔接種到6孔板中,常規條件下培養24 h后,用Bcl2、Bak1重組腺病毒單獨或共轉染MG63細胞(MOI=50)。48 h后消化收集細胞,PBS洗滌細胞沉淀3次。取細胞懸液,加入Calcium Orange Indicator(溶于DMSO,濃度為2 mmol/L)至終濃度為10 μmol/L,置細胞培養箱中孵育1 h,上機測定每管細胞懸液樣品的熒光強度(Ex/Em 549 nm/576 nm),記為F值。加入10% Triton-100后再加入1 mmol/L CaCl2,吹打均勻避光孵育10 min,測定熒光值即Fmax。加入20 μL EGTA,吹打均勻后避光孵育10 min,測定熒光值即Fmin。按照公式計算細胞內游離鈣離子濃度:[Ca2+]free=Kd×[(F-Fmin)/(Fmax-F)]。公式中Kd為熒光劑與Ca2+形成配合物的解離常數,Kd=185 nmol/L。
1.2.4細胞成骨相關蛋白檢測:收集對數生長期MG63細胞,同1.2.2步驟分組轉染培養,48 h后消化收集細胞,加入20 μL RIPA(含有0.2 μL PMSF)裂解液裂解30 min,4 ℃,12 000 rpm離心30 min,轉移上清到新的預冷的EP管中,-20 ℃保存備用。BSA法測定總蛋白含量。計算含40μg蛋白的溶液體積即為上樣量,在蛋白標本中加入適當體積的5×蛋白上樣緩沖液,沸水浴5 min。進行10% SDS-PAGE凝膠電泳及轉膜,加入CTGF、OPN、Runx2、TNF-α抗體,4 ℃孵育過夜。用TBST在室溫下脫色搖床上洗3次(每次5 min)后,加入二抗(1∶3000),室溫下孵育30 min。采用ECL法顯色,圖像處理軟件分析各條帶的灰度值。
1.3 統計學處理
采用SPSS 20.0統計軟件進行分析,計量資料采用均數±標準差表示,資料滿足正態性及方差齊性,采用單因素方差分析,組間兩兩比較采用SNK-q檢驗,不滿足方差齊性則采用Dunnett’sC檢驗,以P<0.05判斷為差異有統計學意義。
2 結果
2.1 重組腺病毒轉染對MG63細胞活性的影響
結果顯示Bcl2重組腺病毒轉染可明顯增強細胞活性,Bak1重組腺病毒轉染可降低細胞活性(P<0.05),共轉染可增強細胞活性,但差異無統計學意義(P>0.05),見表1。
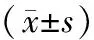
表1 各組重組腺病毒轉染對MG63細胞活性、ALP活性及鈣離子濃度的影響Table 1 Comparison of the cell viability, ALP activity and Ca2+ concentration among the groups after MG63 cells being infected with recombinant
注:與A組相比,**P<0.05;與B組相比,##P<0.05;與C組相比,△△P<0.05。
2.2 重組腺病毒轉染對ALP活性的影響
重組腺病毒轉染后,B組ALP活性升高,C組ALP活性降低,差異有統計學意義(P<0.05),D組ALP活性雖有升高,但差異無統計學意義(P>0.05),見表1。
2.3 重組腺病毒轉染對細胞內鈣離子濃度的影響
流式檢測細胞內鈣離子濃度提示與A組相比,B組鈣離子濃度降低,C組鈣離子濃度升高(P<0.05),D組鈣離子濃度升高,但差異無統計學意義(P>0.05),見表1。
2.4 重組腺病毒轉染對成骨相關蛋白的影響
與A組比較,B組CTGF、OPN、Runx2蛋白相對表達量均明顯升高,TNF-α表達量則降低(P<0.05),C組各蛋白相對表達趨勢與B組相反(P<0.05),D組CTGF、Runx2相對表達量升高,OPN、TNF-α相對表達量降低,但差異無統計學意義(P>0.05)。見表2、圖1。
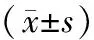
表2 各組重組腺病毒轉染對MG63細胞成骨相關蛋白的影響Table 2 Comparison of the protein expression among the groups after MG63 cells being infected with
注:與A組相比,**P<0.05;與B組相比,##P<0.05;與C組相比,△△P<0.05。
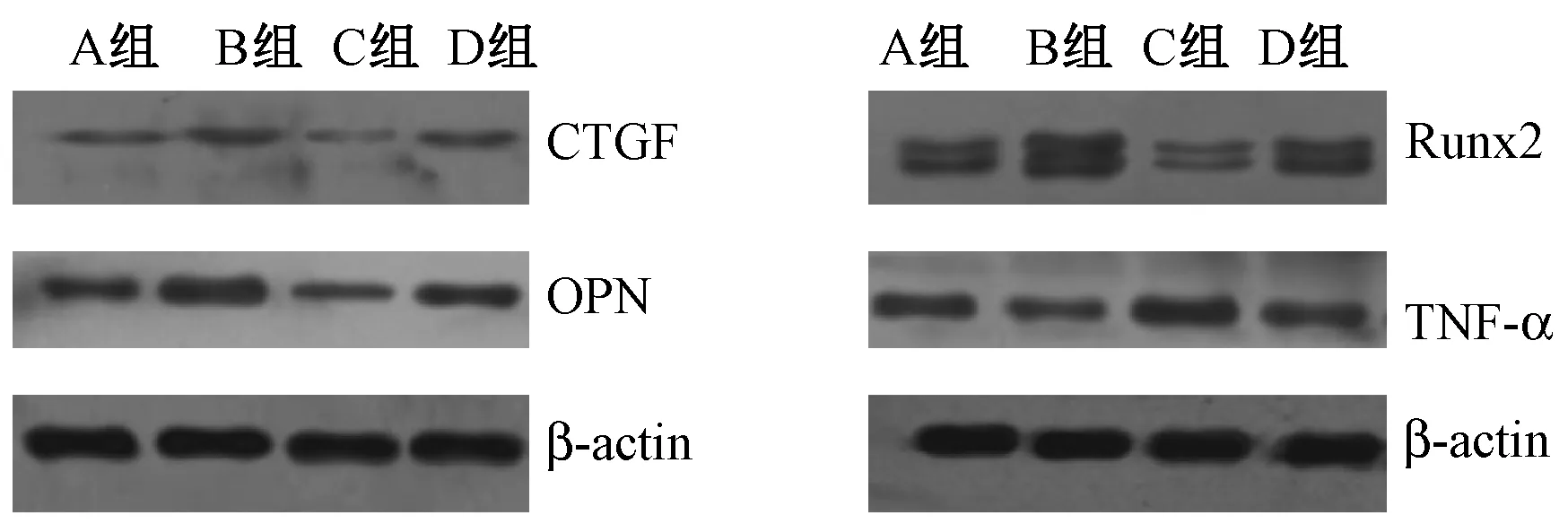
圖1 各組重組腺病毒轉染對MG63細胞成骨相關蛋白的影響Fig.1 Comparison of the protein expression among the groups after MG63 cells being infected with recombinant adenovirus
3 討論
Bcl2家族蛋白在調控線粒體途徑細胞凋亡中起重要作用,Bak1、Bcl2蛋白均為家族成員,其中Bcl2蛋白位于線粒體外膜、內質網膜和核膜,能夠抑制細胞的凋亡,Bak1蛋白是定位于線粒體外膜上的促凋亡蛋白成員[8]。至于促凋亡和抑凋亡Bcl2家族蛋白是如何相互作用來調控線粒體外膜的通透性和細胞色素C釋放的,一般認為,在正常情況下,Bak1與Bcl-xl結合而受到抑制,在凋亡刺激誘導下,BH3-only亞家族蛋白被激活并轉移到線粒體上,與抑制凋亡蛋白Bcl2/Bcl-xl等相互作用,釋放促凋亡蛋白Bax、Bak;或BH3分子直接同Bax/Bak相互作用,在線粒體上形成蛋白孔道,導致細胞色素C從線粒體中釋放而誘導發生細胞調亡[9]。最新研究發現,Bax/Bak雙缺失的細胞具有完全的細胞死亡機制,棉酚通過誘導Bcl2和Bcl-xl構象變化誘導Bax/Bak非依賴的細胞凋亡[10],而PAO和二萜類化合物能誘導促凋亡蛋白Bim上調,與發生構象變化的Bcl2相互作用形成蛋白復合體,介導Bax/Bak非依賴的細胞凋亡[11]。
成骨細胞具有活躍的分泌功能,能合成和分泌骨基質中的多種有機成分,對骨生長有重要作用。絕經后骨質疏松患者以及脊髓損傷后骨質疏松動物模型來源的成骨細胞,成骨細胞活力下降[12]。本課題組前期研究亦發現與非骨質疏松者相比,骨質疏松癥患者骨骼肌線粒體通透轉換孔活性、松質骨Bak1的表達明顯升高,Bcl2的表達則明顯降低[13-14],意味著更多促凋亡物質的刺激或通過,更快地誘導細胞凋亡。在此基礎上,本課題組構建了Bcl2、Bak1重組腺病毒載體,并分別單獨或共轉染人骨肉瘤細胞MG63,發現Bcl2重組腺病毒載體轉染可增強細胞活性、ALP活性,降低鈣離子濃度;Bak1重組腺病毒載體轉染可產生相反的作用;共轉染后則對MG63細胞活性、ALP活性、鈣離子濃度無明顯影響。提示過表達Bcl2可通過抑制Bax/Bak的促凋亡作用來抑制細胞凋亡,從而引起細胞活性、ALP活性增強,細胞內鈣離子濃度降低。過表達Bak1可通過提高線粒體外膜通透性促進細胞色素C釋放來促進細胞凋亡,從而引起降低細胞活性、ALP活性增強,升高細胞內鈣離子濃度。當二者共過表達時,雖然Bcl2與Bak1不直接形成聚合體,但Bak1促細胞凋亡作用與Bcl2抑細胞凋亡作用相互抵消,對MG63細胞無明顯影響作用。細胞內鈣離子濃度可以影響成骨細胞活性功能[15],當其濃度升高時,可抑制成骨細胞的礦化能力[16],結合本研究可說明過表達Bcl2可增強成骨細胞活性及鈣化能力、延緩成骨細胞凋亡。
OP的發生與成骨細胞主導的骨形成過程和破骨細胞調節的骨吸收過程密切相關,成骨細胞對骨組織的代謝平衡、生長發育和損傷修復起主要作用。其主要功能包括產生膠原纖維和無定形基質形成類骨質,分泌骨鈣蛋白、骨粘連蛋白和骨唾液酸蛋白等非膠原蛋白促進骨組織的礦化。成骨細胞表面還存在多種骨吸收刺激因子的受體,并能分泌一些細胞因子,調節骨組織形成和吸收。研究發現轉化生長因子β1可誘導成骨細胞中CTGF的表達,并且在其誘導成骨細胞產生胞外基質的過程中,CTGF為其重要的下游調節器[17-18]。OPN是細胞外多功能基質蛋白,在骨改建中多由成骨細胞和破骨細胞分泌,維持骨基質礦化和骨吸收的平衡,介導骨組織細胞與骨基質間的橋接[19],常作為成骨細胞成熟階段的特異性標志物之一[20]。Runx2屬于runt結構域基因家族成員之一,是調控成骨細胞和破骨細胞的分化促進骨形成的關鍵調控因子,可通過調控成骨細胞特異性細胞外基質蛋白基因的表達和成骨細胞周期參與成骨細胞的分化過程[21]。TNF-α不僅能直接作用于破骨前體細胞促進其分化,還可通過誘導成骨細胞表達RANKL間接促進破骨細胞分化,而且能增加破骨細胞介導的骨吸收,對成骨細胞功能也有直接影響[22-23]。以上蛋白均與成骨細胞密切相關,本研究結果顯示Bcl2重組腺病毒載體轉染MG63細胞可提高CTGF、Runx2、OPN蛋白的相對表達量,降低TNF-α相對表達量,Bak1重組腺病毒載體轉染則可產生相反的作用;共轉染后各蛋白相對表達量無顯著性改變。提示過表達Bcl2不僅可通過抑制細胞凋亡增強成骨細胞活性及鈣化能力,還可影響成骨相關蛋白的表達,具有促成骨效應。
綜上,本研究結果提示過表達Bcl2既可增強成骨細胞活性及鈣化能力,又可影響成骨相關蛋白的表達,這為通過干預成骨細胞凋亡來影響骨質疏松骨形成提供了實驗依據。

